2.10: Білки
- Page ID
- 5881
Білки - макромолекули. Вони побудовані з однієї або декількох нерозгалужених ланцюгів амінокислот; тобто є полімерами. Середній еукаріотичний білок містить близько 500 амінокислот, але деякі з них набагато менші (найменші часто називають пептидами), а деякі набагато більші (найбільший на сьогоднішній день - титін білок, який міститься в скелетних і серцевих м'язах; одна версія містить 34 350 амінокислот в одному ланцюжку! ).
Кожна функція живої клітини залежить від білків.
- Рух і рух клітин і організмів залежить від білків. [Приклади: М'язи, вії та джгутики]
- Каталізом всіх біохімічних реакцій займаються ферменти, які містять білок.
- Будова клітин, і позаклітинний матрикс, в який вони вбудовані, багато в чому складається з білка. [Приклади: колагени] (Рослини та багато мікробів більше залежать від вуглеводів, наприклад, клітковини, для підтримки, але вони синтезуються ферментами.)
- Транспортування матеріалів у рідині організму залежить від білків.
- Рецепторами до гормонів та інших сигнальних молекул є білки.
- Білки є необхідною поживною речовиною для гетеротрофів.
- Фактори транскрипції, які включають та вимикають гени, щоб керувати диференціацією клітини та її подальшою реакцією на сигнали, що досягають її, - це білки.
- і багато іншого — білки дійсно є фізичною основою життя.
 Представлений тут білок відображає багато особливостей білків. Давайте розглянемо деякі з них, коли ви прокручуєте зображення вниз. Білок складається з двох поліпептидних ланцюгів, довга зліва з 346 амінокислот - це називається важкий ланцюг - і короткий праворуч з 99 амінокислот. Важкий ланцюг показаний як складається з 5 основних регіонів або доменів:
Представлений тут білок відображає багато особливостей білків. Давайте розглянемо деякі з них, коли ви прокручуєте зображення вниз. Білок складається з двох поліпептидних ланцюгів, довга зліва з 346 амінокислот - це називається важкий ланцюг - і короткий праворуч з 99 амінокислот. Важкий ланцюг показаний як складається з 5 основних регіонів або доменів:
- три позаклітинних домену, позначені тут як N (включає N-термінал), C1 і C2;
- трансмембранний домен, де поліпептидний ланцюг проходить через плазматичну мембрану клітини;
- цитоплазматичний домен (з терміналом С) всередині цитоплазми клітини.
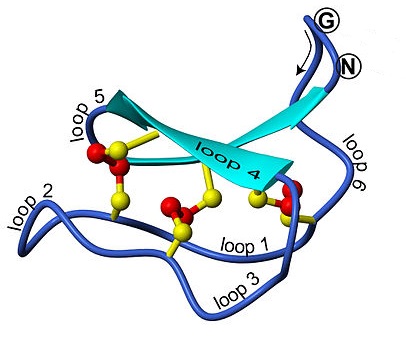
Кишки
Інша, дуже рідкісна, посттрансляційна модифікація - це пізніше видалення ділянки поліпептиду і зрощування разом (з пептидним зв'язком) інших N-кінцевих і C-кінцевих сегментів. Видалена частина називається кишечником («білковий інтрон»), а ліговані сегменти називаються екстеїнами («білкові екзони»). Гени, що кодують кишечник, були виявлені в різних організмах, в тому числі
- деякі «справжні» бактерії, такі як
- субтилісна паличка
- кілька мікобактерій
- кілька синьо-зелених водоростей (ціанобактерій)
- деякі Археї, такі як
- Метанокок яний
- Аеропірум Пернікс
- і кілька одноклітинних еукаріотів, наприклад, бутонізуючі дріжджі (Saccharomyces cerevisiae).
- Жодного не знайдено в геномах багатоклітинних еукаріотів, таких як Drosophila, C. elegans або зелена рослина Арабідопсис.
Як білки набувають свою форму
Функція білка визначається його формою. Форма білка визначається його первинною структурою (послідовністю амінокислот). Послідовність амінокислот в білку визначається послідовністю нуклеотидів в гені (ДНК), що його кодує. Функція білка (крім випадків, коли він служить їжею) абсолютно залежить від його тривимірної структури. Ряд агентів може порушити цю структуру, таким чином денатуруючи білок.
- зміни рН (змінює електростатичні взаємодії між зарядженими амінокислотами)
- зміни концентрації солі (робить те ж саме)
- зміни температури (більш високі температури знижують міцність водневих зв'язків)
- наявність відновників (розрив S-S-зв'язків між цистеїнами)
Жоден з цих агентів не розриває пептидні зв'язки, тому первинна структура білка залишається незмінною при його денатурації. При денатурації білка він втрачає свою функцію.

- Денатурований фермент перестає функціонувати.
- Денатуроване антитіло більше не може зв'язувати свій антиген.
Часто, коли білок був м'яко денатурований, а потім повертається до нормальних фізіологічних умов температури, рН, концентрації солі тощо, він спонтанно відновлює свою функцію (наприклад, ферментативну активність або здатність зв'язувати свій антиген). Це говорить нам
- Білок спонтанно відновив свою рідну тривимірну форму.
- Його здатність робити це є невід'ємною; жоден сторонній агент не потрібен, щоб змусити його правильно скласти.
Однак існують:
- ферменти, які додають цукру до певних амінокислот, і вони можуть бути необхідними для правильного згортання;
- білки, звані молекулярними шаперонами, які можуть дозволити новосинтезованому білку набувати свою кінцеву форму швидше і надійніше, ніж це було б інакше.
Шаперони
Хоча тривимірна (третинна) структура білка визначається його первинною структурою, йому може знадобитися допомога в досягненні його остаточної форми.
- Коли поліпептид синтезується, він виходить (спочатку N-термінал) з рибосоми і починається процес згортання.
- Однак з'являється поліпептид опиняється оточений водянистим цитозолем і багатьма іншими білками.
- У міру появи гідрофобних амінокислот вони повинні знайти інші гідрофобні амінокислоти для асоціації з. В ідеалі вони повинні бути власними, але існує небезпека того, що вони можуть асоціюватися з сусідніми білками, що призводить до агрегації та нездатності сформувати належну третинну структуру.
Щоб уникнути цієї проблеми, клітини всіх організмів містять молекулярні шаперони, які стабілізують новоутворені поліпептиди, поки вони складаються в свою належну структуру. Шаперони використовують енергію АТФ для виконання цієї роботи.
Шапероніни
Деякі білки настільки складні, що необхідна підмножина молекулярних шаперонів - званих шаперонінами. Чапероніни - це порожнисті циліндри, в які вписується щойно синтезований білок, поки він складається. Внутрішня стінка циліндра вистелена гідрофобними амінокислотами, які стабілізують гідрофобні області поліпептидного ланцюга, в той час як він надійно складається від
- водянистий цитозол і
- інші білки зовні.
Шапероніни також використовують АТФ як джерело енергії для керування процесом складання.
Як уже згадувалося вище, високі температури можуть денатурувати білки, а коли клітина піддається впливу високих температур, кілька типів молекулярних шаперонів коливаються в дію. З цієї причини ці шаперони також називають білками теплового шоку (HSP). Молекулярні шаперони не тільки допомагають у складанні новосинтезованих білків, але деякі з них також можуть розгортати агреговані білки, а потім правильно розгортати білок. Агрегація білка є причиною таких розладів, як хвороба Альцгеймера, хвороба Гентінгтона та прионні захворювання (наприклад, хвороба «безумної корови»). Можливо, коли-небудь будуть знайдені способи лікування цих захворювань за рахунок підвищення ефективності дезагрегації шаперонів.
Незважаючи на важливість шаперонів, правило все ж дотримується: кінцева форма білка визначається лише одним: точною послідовністю амінокислот в білку. А послідовність амінокислот в кожному білку продиктована послідовністю нуклеотидів в гені, що кодує цей білок. Так функція кожного з тисяч білків в організмі визначається одним або декількома генами.
первинна структура

Первинною структурою білка є його лінійна послідовність амінокислот і розташування будь-яких дисульфідних (-S-S-) мостів. Зверніть увагу на амінотермінал або "N-термінал" (NH 3 +) на одному кінці; карбоксильний термінал (» C-термінал «) (COO -) на іншому.
вторинна структура
Більшість білків містять один або кілька відрізків амінокислот, які приймають характерну структуру в 3-D просторі. Найпоширенішими з них є альфа-спіраль та бета-конформація.
Альфа спіраль

R групи амінокислот поширюються назовні.
- Спіраль робить повний оборот кожні 3,6 амінокислоти.
- Спіраль правостороння, вона крутиться за годинниковою стрілкою.
- Карбонільна група (-C = O) кожної пептидної зв'язку простягається паралельно осі спіралі і вказує безпосередньо на -N-H групу пептидного зв'язку 4 амінокислоти нижче неї в спіралі. Між ними утворюється водневий зв'язок [-N-H·····O=C-]
Бета-конформація
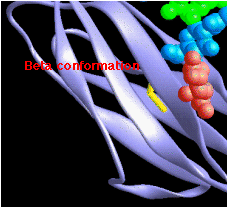 складається з пар ланцюгів, що лежать пліч-о-пліч і
складається з пар ланцюгів, що лежать пліч-о-пліч і- стабілізується водневими зв'язками між атомом карбонільного кисню на одному ланцюжку і групою -NH на сусідньому ланцюзі.
- Ланцюги часто є «антипаралельними»; N-термінал до C-термінального напрямку одного є зворотним іншим.
третинна структура
Третинна структура відноситься до тривимірної структури всього поліпептидного ланцюга.
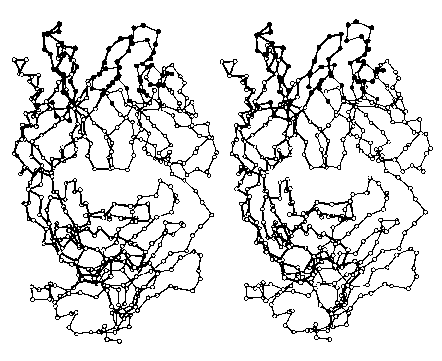
Зображення (люб'язно надано доктором Д. Р. Девісом) представляють третинну структуру антигензв'язуючої частини молекули антитіл. Кожне коло являє собою альфа-вуглець в одній з двох поліпептидних ланцюгів, що входять до складу цього білка. (Заповнені кола вгорі - це амінокислоти, які зв'язуються з антигеном.) Велика частина вторинної структури цього білка складається з бета-конформації, яку особливо легко побачити в правій частині зображення.
Спробуйте об'єднати ці два зображення в стереоскопічному (3D) вигляді. Я вважаю, що це найкраще працює, коли мої очі знаходяться приблизно на 18 «від екрану, і я намагаюся розслабитися, щоб мої очі були спрямовані в точку за екраном.
Там, де весь білок або частини білка піддаються впливу води (наприклад, в крові або цитозолі), гідрофільні групи R - включаючи групи R із прикріпленими цукрами, знаходяться на поверхні; гідрофобні групи R поховані у внутрішню частину.
Важливість третинної структури
Функція білка (крім як їжі) залежить від його третинної структури. Якщо це порушується, білок, як кажуть, денатурований, і він втрачає свою активність. Приклади:
- денатуровані ферменти втрачають свою каталітичну силу
- денатуровані антитіла більше не можуть зв'язувати антиген
Мутація в гені, що кодує білок, є частою причиною зміни третинної структури.
- Цікаво, що крихітні кількості мутантної версії можуть спровокувати перетворення альфа-бета в нормальний білок. При цьому мутантний варіант може бути заразним. У Європі було кілька випадків, коли люди хворіють на хворобу Крейцфельдта-Якоба, які, можливо, придбали її від вживання крихітних кількостей мутантного білка в яловичині.
- Ряд інших білків, змінених точковою мутацією в гені, що їх кодує, наприклад,
- фібриноген
- лізоцим
- транстиретин (сироватковий білок, який транспортує тироксин і ретинол (вітамін А) в крові)
Багато водневих зв'язків, які можуть утворюватися між поліпептидними кістками в бета-конформації, свідчить про те, що це стабільна вторинна структура, потенційно доступна багатьом білкам, і тому тенденція до утворення нерозчинних агрегатів також є. Уникнення утворення амілоїду може пояснити великі інвестиції в клітину в
- шаперони
- протеасоми
а також вирішальне значення конкретних амінокислотних бічних ланцюгів у підтримці кулястої, а отже, розчинної, третинної структури.
Протеїнові домени
 Третинна структура багатьох білків побудована з декількох доменів. Часто кожен домен має окрему функцію для виконання білка, таку як:
Третинна структура багатьох білків побудована з декількох доменів. Часто кожен домен має окрему функцію для виконання білка, таку як:
- зв'язування невеликого ліганду (наприклад, пептид у молекулі, показаної тут)
- охоплюють плазматичну мембрану (трансмембранні білки)
- що містить каталітичний сайт (ферменти)
- ДНК-зв'язування (в транскрипційних факторах)
- забезпечення поверхні для зв'язування конкретно з іншим білком
У деяких (але не всіх) випадках кожен домен в білку кодується окремим екзоном в гені, що кодує цей білок. У молекулі гістосумісності, показаної тут,
- три домени α 1, α 2 та α 3 кодуються власним екзоном.
- Два додаткових домену - трансмембранний домен і цитоплазматичний доментакож кодуються окремими екзонами.
- (β 2 -мікроглобулін, «β 2 м», НЕ є доменом цієї молекули. Це окрема молекула, яка зв'язується лише з трьома альфа-доменами (червоною лінією та колом) лише нековалентними силами. Комплекс цих двох білків є прикладом четвертинної структури.)
Це зображення (люб'язно надано П.Джей Бьоркманом з Nature 329:506, 1987) є схематичним зображенням позаклітинної частини HLA-A2, молекули гістосумісності класу людини I. Він також ілюструє два загальні приклади вторинної структури: розтяжки бета-конформації представлені широкими зеленими стрілками (вказуючи N -> C термінал); області альфа-спіралі показані у вигляді гвинтових стрічок. Пари фіолетових сфер представляють дисульфідні містки. Відповідність між екзонами та доменами, швидше за все, спостерігається в недавно еволюціонували білках. Імовірно, "перетасування екзонів" під час еволюції дозволило організмам виробляти нові білки з новими функціями, додаючи екзони з інших частин генома для кодування нових доменів (скоріше, як Lego® частин).
Четвертинна структура
Комплекси 2 або більше поліпептидних ланцюгів, що утримуються разом нековалентними силами (зазвичай), але в точних співвідношеннях і з точною 3-D конфігурацією. Прикладом є нековалентна асоціація молекули бета-2 мікроглобуліну з важким ланцюгом кожної молекули гістосумісності класу I.
протеїновий кінез
Всі білки синтезуються рибосомами за допомогою інформації, закодованої в молекулах месенджерної РНК (мРНК). Різні напрямки для білків відбуваються в двох основних наборах:
- один набір для тих білків, синтезованих рибосомами, які залишаються підвішеними в цитозолі, і
- другий набір для білків, синтезованих рибосомами, які прикріплені до мембран ендоплазматичного ретикулума (ЕР), утворюючи «шорсткий ендоплазматичний ретикулум» (РЕР).
Деякі з важливих напрямків для білків:
- цитозоль
- ядро
- мітохондрій
- хлоропласти
- пероксисоми
