11.3: Коефіцієнт реакції
- Page ID
- 19112
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- При об'єднанні довільних величин різних компонентів хімічної реакційної системи загальний склад системи, швидше за все, не буде відповідати рівноважному складу. В результаті чиста зміна складу («зсув вправо або вліво») буде мати тенденцію до досягнення рівноважного стану.
- Стан реакційної системи щодо її рівноважного стану характеризується величиною вираження рівноваги, формулювання якого визначається коефіцієнтами в рівнянні збалансованої реакції; воно може виражатися через концентрації, або у випадку газоподібних компонентів, як парціальний тиск.
- Різні терміни в виразі рівноваги можуть мати будь-яке довільне значення (включаючи нуль); значення самого вираження рівноваги називається коефіцієнтом реакції Q.
- Якщо умови концентрації або тиску в вираженні рівноваги відповідають рівноважному стану системи, то Q має спеціальне значення K, яке ми називаємо постійною рівноваги.
- Співвідношення Q/K (будь то 1, >1 або <1), таким чином, служить показником того, наскільки система знаходиться від свого рівноважного складу, а його значення вказує напрямок, в якому повинна протікати чиста реакція, щоб досягти свого рівноважного стану.
- Коли Q = K, то стан рівноваги досягнуто, і подальша чиста зміна складу не відбуватиметься до тих пір, поки система залишається непорушеною.
Розглянемо таку просту реакцію, як газофазний синтез йодистого водню з його елементів:\[H_2 + I_2 \rightarrow 2 HI\] Припустимо, ви об'єднаєте довільні величини\(H_2\),\(I_2\) і\(HI\). Чи створить реакція більше HI, або частина HI буде споживатися, коли система рухається до свого рівноважного стану? Поняття коефіцієнта реакції, який є центром цього короткого уроку, дозволяє легко передбачити, що станеться.
Що таке коефіцієнт рівноваги?
У попередньому розділі ми визначили вираз рівноваги для реакції
У загальному випадку, коли концентрації можуть мати будь-які довільні значення (включаючи нуль), цей вираз називається коефіцієнтом реакції (також зазвичай використовується термін коефіцієнт рівноваги.) І його значення позначається\(Q\) (\(Q_c\)або\(Q_p\) якщо ми хочемо підкреслити, що терміни представляють молярні концентрації або парціальний тиск.) Якщо терміни відповідають рівноважним концентраціям, то вищевказане вираз називається постійною рівноваги і його значення позначається\(K\) (або\(K_c\) або\(K_p\)).
\(K\)Таким чином, особливе значення, яке\(Q\) має, коли реакція знаходиться в рівновазі
Значення Q по відношенню до K служить показником того, як склад реакційної системи порівнюється з складом рівноважного стану, і, таким чином, вказує напрямок, в якому повинна протікати будь-яка чиста реакція. Наприклад, якщо об'єднати два реагенти A і B в концентраціях 1 моль L —1 кожен, значення Q буде 0÷1=0. Єдине можлива зміна - перетворення деяких з цих реагентів в продукти. Якщо замість цього наша суміш складається тільки з двох продуктів C і D, Q буде невизначено великим (1÷0) і єдина можлива зміна буде в зворотному напрямку.
Наприклад, якщо об'єднати два реагенти A і B в концентраціях 1 моль L —1 кожен, значення Q буде 0÷1=0. Єдине можлива зміна - перетворення деяких з цих реагентів в продукти. Якщо замість цього наша суміш складається тільки з двох продуктів C і D, Q буде невизначено великим (1÷0) і єдина можлива зміна буде в зворотному напрямку.
Легко помітити (шляхом простого застосування принципу Ле Шательє), що співвідношення Q/K відразу говорить нам про те, чи буде відбуватися чиста реакція, коли система рухається до свого рівноважного стану, і в якому напрямку. Схематичне зображення цього співвідношення показано нижче:
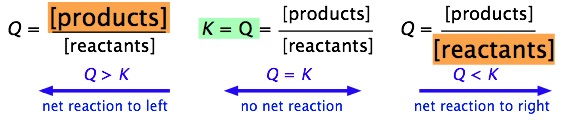
Дуже важливо, щоб ви змогли виробити ці відносини для себе, не запам'ятовуючи їх, а з визначень\(Q\) і\(K\).
| Стан | Стан системи |
|---|---|
| Q > К | Концентрація продукту занадто висока для рівноваги; чиста реакція протікає вліво. |
| Q = К | Система знаходиться в рівновазі; ніяких чистих змін не відбудеться. |
| Q < К | Концентрація продукту занадто низька для рівноваги; чиста реакція протікає вправо. |
Дуже важливо, щоб ви змогли виробити ці відносини для себе, не запам'ятовуючи їх, а з визначень\(Q\) і\(K\).
Константа рівноваги для окислення діоксиду сірки - К р = 0,14 при 900 К.
\[\ce{2 SO_2(g) + O_2(g) \rightleftharpoons 2 SO_3(g)} \nonumber\]
Якщо реакційна посудина заповнена SO 3 при парціальному тиску 0,10 атм і O 2 і SO 2 кожен при парціальному тиску 0,20 атм, що можна зробити висновок про те, чи буде відбуватися і в який бік будь-яка чиста зміна складу?
Рішення:
Значення рівноважного частки Q для початкових умов дорівнює
\[ Q= \dfrac{p_{SO_3}^2}{p_{O_2}p_{SO_2}^2} = \dfrac{(0.10\; atm)^2}{(0.20 \;atm) (0.20 \; atm)^2} = 1.25\; atm^{-1} \nonumber\]
Починаючи з Q > K, реакція не знаходиться в рівновазі, тому чиста зміна відбудеться в напрямку, який зменшує Q. Це може статися лише в тому випадку, якщо частина SO 3 перетворюється назад у продукти. Іншими словами, реакція буде «зміщуватися вліво».
Формальні визначення Q і K досить прості, але вони мають обмежену корисність, якщо ви не зможете пов'язати їх з реальними хімічними ситуаціями. Наступні діаграми ілюструють зв'язок між Q і K з різних точок зору. Приділіть трохи часу, щоб уважно вивчити кожну з них, переконавшись, що ви в змозі пов'язати опис з ілюстрацією.
Для реакції
\[N_2O_{4(g)} \rightleftharpoons 2 NO_{2(g)} \nonumber\]
К с = 0,0059 при 298 К.
Ця умова рівноваги представлено червоною кривою, яка проходить через всі точки на графіку, що задовольняють вимозі, що
\[Q = \dfrac{[NO_2]^2}{ [N_2O_4]} = 0.0059 \nonumber\]
Звичайно, існує нескінченна кількість можливих Q цієї системи в межах концентрації, показаних на сюжеті. Тільки ті точки, які потрапляють на червону лінію, відповідають рівноважним станам цієї системи (ті, для яких\(Q = K_c\)). Сама лінія - це ділянка [NO 2], яку ми отримуємо шляхом перестановки виразу рівноваги
\[[NO_2] = \sqrt{[N_2O_4]K_c} \nonumber\]
Якщо система спочатку знаходиться в нерівноважному стані, її склад буде прагнути змінюватися в напрямку, який переміщує її в той, який знаходиться на лінії. Показано два таких нерівноважних стану. Стан, позначений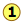 має\(Q > K\), тому ми очікуємо чистої реакції, яка зменшує Q шляхом перетворення деякої частини NO 2 в N 2 O 4; іншими словами, рівновага «зсувається вліво». Аналогічно в стані
має\(Q > K\), тому ми очікуємо чистої реакції, яка зменшує Q шляхом перетворення деякої частини NO 2 в N 2 O 4; іншими словами, рівновага «зсувається вліво». Аналогічно в стані Q < K, що вказує на те, що відбудеться пряма реакція.
Q < K, що вказує на те, що відбудеться пряма реакція.
Сині стрілки на наведеній вище діаграмі вказують на послідовні значення, які Q приймає, коли реакція рухається ближче до рівноваги. Нахил лінії відображає стехіометрію рівняння. При цьому один моль реагенту дає два молі продуктів, тому укоси мають абсолютне значення 2:1.
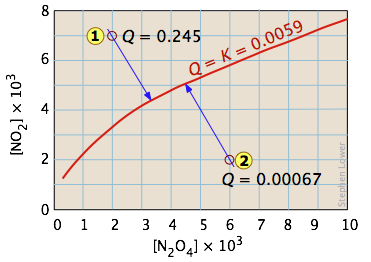
Одне з найпростіших рівноваг, яке ми можемо написати, - це між твердим тілом та його парою. При цьому постійна рівноваги - це якраз тиск пари твердого тіла. Таким чином, для процесу
\[I_{2(s)} \rightleftharpoons I_{2(g)} \nonumber\]
всі можливі рівноважні стани системи лежать на горизонтальній червоній лінії і не залежать від кількості твердого тіла (до тих пір, поки є хоча б достатньо для подачі відносної крихітної кількості пари.)
Так додавання різних кількостей твердого речовини в порожній закритий посудину (станів і
і ) викликає поступове накопичення парів йоду. Оскільки рівноважний тиск пари настільки малий, кількість твердого речовини, споживаного в процесі, незначна, тому стрілки йдуть прямо вгору і все призводять до однакового рівноважного тиску пари.
) викликає поступове накопичення парів йоду. Оскільки рівноважний тиск пари настільки малий, кількість твердого речовини, споживаного в процесі, незначна, тому стрілки йдуть прямо вгору і все призводять до однакового рівноважного тиску пари.
Розпад хлористого амонію - поширений приклад неоднорідного (двофазного) рівноваги. Твердий хлорид амонію має істотний тиск пари навіть при кімнатній температурі:
\[NH_4Cl_{(s)} \rightleftharpoons NH_{3(g)} + HCl_{(g)}\]
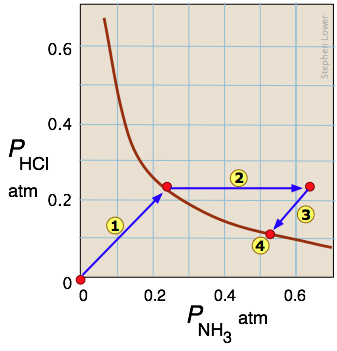
Стрілка простежує стани, через які проходить система, коли твердий NH 4 Cl поміщається в закритий контейнер. Стрілка
простежує стани, через які проходить система, коли твердий NH 4 Cl поміщається в закритий контейнер. Стрілка являє собою додавання аміаку до рівноважної суміші; система реагує шляхом
являє собою додавання аміаку до рівноважної суміші; система реагує шляхом повернення до нового стану рівноваги,
повернення до нового стану рівноваги, який, як прогнозує принцип Ле Шательє, містить меншу кількість аміаку, ніж було додано. Одиниці нахилів доріжок
який, як прогнозує принцип Ле Шательє, містить меншу кількість аміаку, ніж було додано. Одиниці нахилів доріжок і
і відображають стехіометрію 1:1 газоподібних продуктів реакції.
відображають стехіометрію 1:1 газоподібних продуктів реакції.
