13.2: Константи рівноваги
- Page ID
- 22709
- Вивести коефіцієнти реакції з хімічних рівнянь, що представляють однорідні та гетерогенні реакції
- Обчисліть значення коефіцієнтів реакції та констант рівноваги, використовуючи концентрації та тиски
- Пов'язати величину константи рівноваги з властивостями хімічної системи
Тепер, коли у нас є символ (\(\rightleftharpoons\)) для позначення оборотних реакцій, нам знадобиться спосіб математично висловити, як кількість реагентів і продуктів впливає на рівновагу системи. Загальне рівняння оборотної реакції можна записати наступним чином:
\[m\ce{A}+n\ce{B}+ \rightleftharpoons x\ce{C}+y\ce{D} \label{13.3.1} \]
Ми можемо записати коефіцієнт реакції (\(Q\)) для цього рівняння. При оцінці за допомогою концентрацій він називається\(Q_c\). Ми використовуємо дужки для позначення молярних концентрацій реагентів та продуктів.
\[ Q_c=\dfrac{[\ce{C}]^x[\ce{D}]^y}{[\ce{A}]^m[\ce{B}]^n} \label{13.3.2} \]
Коефіцієнт реакції дорівнює молярним концентраціям продуктів хімічного рівняння (помножених разом) над реагентами (також помноженими разом), причому кожна концентрація підвищується до потужності коефіцієнта цієї речовини в збалансованому хімічному рівнянні. Наприклад, коефіцієнт реакції для оборотної реакції
\[\ce{2NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \label{13.3.3} \]
дається цим виразом:
\[Q_c=\ce{\dfrac{[N_2O_4]}{[NO_2]^2}} \label{13.3.4} \]
Напишіть вираз для коефіцієнта реакції для кожної з наступних реакцій:
- \(\ce{3O}_{2(g)} \rightleftharpoons \ce{2O}_{3(g)}\)
- \(\ce{N}_{2(g)}+\ce{3H}_{2(g)} \rightleftharpoons \ce{2NH}_{3(g)}\)
- \(\ce{4NH}_{3(g)}+\ce{7O}_{2(g)} \rightleftharpoons \ce{4NO}_{2(g)}+\ce{6H_2O}_{(g)}\)
Рішення
- \(Q_c=\dfrac{[\ce{O3}]^2}{[\ce{O2}]^3}\)
- \( Q_c=\dfrac{[\ce{NH3}]^2}{\ce{[N2][H2]}^3}\)
- \( Q_c=\dfrac{\ce{[NO2]^4[H2O]^6}}{\ce{[NH3]^4[O2]^7}}\)
Напишіть вираз для коефіцієнта реакції для кожної з наступних реакцій:
- \( \ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g)\)
- \( \ce{C4H8}(g) \rightleftharpoons \ce{2C2H4}(g)\)
- \( \ce{2C4H10}(g)+\ce{13O2}(g) \rightleftharpoons \ce{8CO2}(g)+\ce{10H2O}(g)\)
- Відповідь на
-
\( Q_c=\dfrac{[\ce{SO3}]^2}{\ce{[SO2]^2[O2]}}\)
- Відповідь б
-
\( Q_c=\dfrac{[\ce{C2H4}]^2}{[\ce{C4H8}]}\)
- Відповідь c
-
\( Q_c=\dfrac{\ce{[CO2]^8[H2O]^{10}}}{\ce{[C4H10]^2[O2]^{13}}}\)
Числове значення\(Q_c\) для даної реакції змінюється; воно залежить від концентрацій продуктів і реагентів, присутніх на момент\(Q_c\) визначення. Коли змішуються чисті реагенти, спочатку\(Q_c\) дорівнює нулю, оскільки в цьому місці немає продуктів. У міру протікання реакції значення\(Q_c\) збільшується в міру збільшення концентрацій продуктів і одночасно зменшуються концентрації реагентів (рис.\(\PageIndex{1}\)). Коли реакція досягає рівноваги, значення коефіцієнта реакції більше не змінюється, оскільки концентрації більше не змінюються.
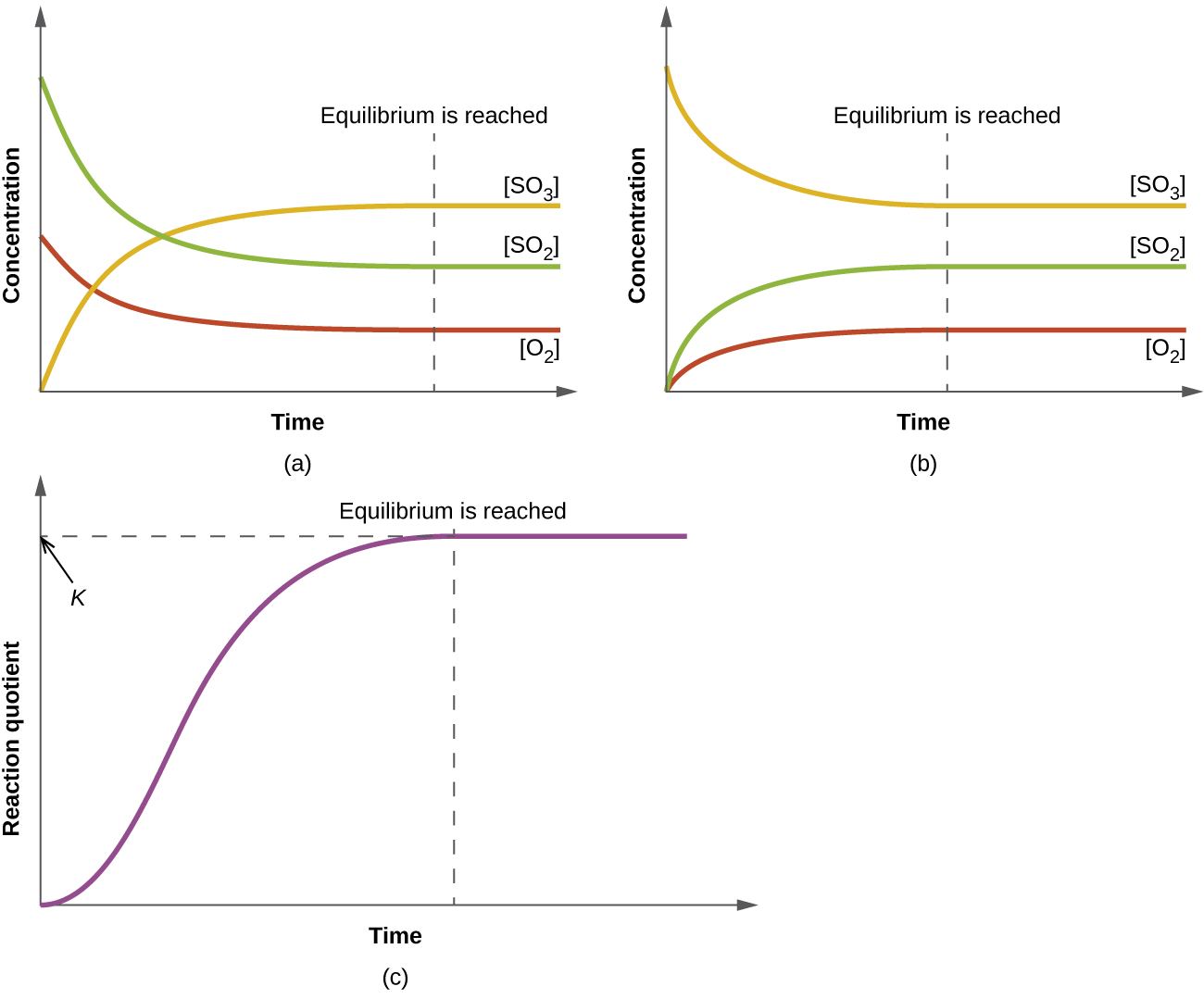
Коли суміш реагентів і продуктів реакції досягає рівноваги при заданій температурі, її коефіцієнт реакції завжди має однакове значення. Це значення називається постійною рівноваги (\(K\)) реакції при цій температурі. Що стосується коефіцієнта реакції, то при оцінці за концентраціями він відзначається як\(K_c\).
Те, що коефіцієнт реакції завжди приймає однакове значення при рівновазі, може бути виражено як:
\[Q_c \textrm{ at equilibrium}=K_c=\dfrac{[\ce C]^x[\ce D]^y...}{[\ce A]^m[\ce B]^n...} \label{13.3.5} \]
Це рівняння є математичним твердженням закону масової дії: Коли реакція досягла рівноваги при заданій температурі, коефіцієнт реакції для реакції завжди має однакове значення.
Газоподібний діоксид азоту утворює тетроксид азоту згідно з цим рівнянням:
\[\ce{2NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \nonumber \]
При додаванні 0,10 моль\(\ce{NO2}\) в колбу 1,0-л при 25° С концентрація змінюється так, що при рівновазі [NO 2] = 0,016 М і [N 2 O 4] = 0,042 М.
- Яке значення коефіцієнта реакції до того, як відбудеться будь-яка реакція?
- Яке значення константи рівноваги для реакції?
Рішення
- Перед будь-яким продуктом формується\(\mathrm{[NO_2]=\dfrac{0.10\:mol}{1.0\:L}}=0.10\:M\), а [N 2 O 4] = 0 М. Таким чином,\[Q_c=\ce{\dfrac{[N2O4]}{[NO2]^2}}=\dfrac{0}{0.10^2}=0 \nonumber \]
- При рівновазі величина постійної рівноваги дорівнює значенню коефіцієнта реакції. При рівновазі,\[K_c=Q_c=\ce{\dfrac{[N2O4]}{[NO2]^2}}=\dfrac{0.042}{0.016^2}=1.6\times 10^2. \nonumber \]
Константа рівноваги дорівнює 1,6 × 10 2.
Зауважте, що розмірний аналіз припускає, що одиницею для цього\(K_c\) значення має бути M −1. Однак звичайна практика опускати одиниці для\(K_c\) значень, обчислених, як описано тут, оскільки саме величина постійної рівноваги передає корисну інформацію. Як буде розглянуто далі в цьому модулі, строгий підхід до обчислення констант рівноваги використовує безрозмірні величини, отримані від діяльності, замість молярних концентрацій, і тому\(K_c\) значення справді безрозмірні.
Для реакції
\[\ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g) \nonumber \]
концентрації при рівновазі становлять [SO 2] = 0,90 М, [O 2] = 0,35 М, і [SO 3] = 1,1 М. Яке значення постійної рівноваги, K c?
- Відповідь
-
К с = 4,3
Величина постійної рівноваги - це міра виходу реакції при досягненні рівноваги. Велике значення для\(K_c\) вказує на те, що рівновага досягається тільки після того, як реагенти були в значній мірі перетворені в продукти. Невелике значення\(K_c\) —набагато менше 1 - вказує на те, що рівновага досягається тоді, коли лише невелика частка реагентів була перетворена в продукти.
Після того, як значення реакції\(K_c\) відомо, його можна використовувати для прогнозування спрямованих зрушень у порівнянні зі значенням\(Q_c\). Система, яка не знаходиться в рівновазі, буде діяти в напрямку, який встановлює рівновагу. Дані на малюнку\(\PageIndex{2}\) ілюструють це. При нагріванні до постійної температури, 800° C, різні початкові суміші\(\ce{CO}\)\(\ce{H_2O}\)\(\ce{CO_2}\), і\(\ce{H_2}\) реагують на досягнення композицій, дотримуючись однакової рівноваги (значення\(Q_c\) змінюється до тих пір, поки воно не дорівнює значенню K c). Ця величина дорівнює 0,640, постійна рівноваги для реакції в цих умовах.
\[\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g) \hspace{20px} K_c=0.640 \hspace{20px} \mathrm{T=800°C} \label{13.3.6} \]
Важливо визнати, що рівновага може бути встановлена, починаючи або з реагентів, або з продуктів, або з суміші обох. Наприклад, рівновага була встановлена з суміші 2 на рис.,\(\PageIndex{2}\) коли продукти реакції нагрівалися в закритій ємності. Насправді одна методика, яка використовується для визначення того, чи дійсно реакція знаходиться в рівновазі, - це наближення рівноваги, починаючи з реагентів в одному експерименті і починаючи з продуктів в іншому. Якщо однакове значення коефіцієнта реакції спостерігається, коли концентрації припиняють змінюватися в обох експериментах, то ми можемо бути впевнені, що система досягла рівноваги.
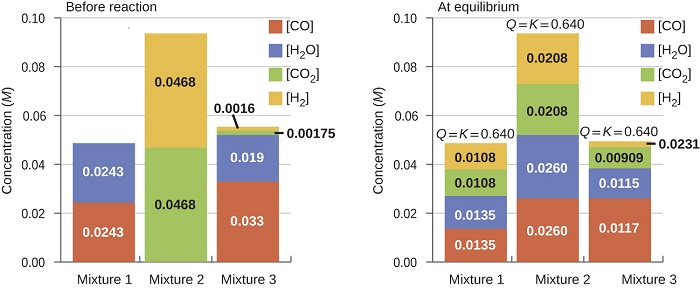
Нижче наведено початкові концентрації реагентів та продуктів для трьох експериментів, що включають цю реакцію:
\[\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g) \nonumber \]
с\(K_c=0.64 \). Визначте, в якому напрямку протікає реакція, коли вона йде до рівноваги в кожному з трьох показаних експериментів.
| Реагенти/Продукти | Експеримент 1 | Експеримент 2 | Експеримент 3 |
|---|---|---|---|
| [CO] i | 0.0203 М | 0.011 М | 0.0094 М |
| [Н 2 О] | 0.0203 М | 0.0011 М | 0.0025 М |
| [СО 2] i | 0.0040 М | 0.037 М | 0.0015 М |
| [H 2] і | 0.0040 М | 0.046 М | 0.0076 М |
Рішення
Експеримент 1:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.0040)(0.0040)}{(0.0203)(0.0203)}=0.039. \nonumber \]
Q c <\(K_c\) (0,039 < 0,64)
Реакція зміститься вправо.
Експеримент 2:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.037)(0.046)}{(0.011)(0.0011)}=1.4 \times 10^2 \nonumber \]
Q см >\(K_c\) (140 > 0,64)
Реакція зміститься вліво.
Експеримент 3:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.0015)(0.0076)}{(0.0094)(0.0025)}=0.48 \nonumber \]
Q c <\(K_c\) (0,48 < 0,64)
Реакція зміститься вправо.
Обчисліть коефіцієнт реакції і визначте напрямок, в якому кожна з наступних реакцій буде протікати для досягнення рівноваги.
(а) 1,00-л колба, що містить 0,0500 моль NO (г), 0,0155 моль Cl 2 (г) та 0,500 моль NoCl:
\[\ce{2NO}(g)+\ce{Cl2}(g)⇌\ce{2NOCl}(g)\hspace{20px}K_c=4.6\times 10^4 \nonumber \]
b) колба 5,0 л, що містить 17 г NH 3, 14 г N 2 та 12 г H 2:
\[\ce{N2}(g)+\ce{3H2}(g)⇌\ce{2NH3}(g)\hspace{20px}K_c=0.060 \nonumber \]
(c) 2,00 л колба, що містить 230 г SO 3 (г):
\[\ce{2SO3}(g)⇌\ce{2SO2}(g)+\ce{O2}(g)\hspace{20px}K_c=0.230 \nonumber \]
- Відповідь на
-
\(Q_c\)= 6,45 × 10 3, зрушення вправо.
- Відповідь б
-
\(Q_c\)= 0,12, зрушення вліво.
- Відповідь c
-
\(Q_c\)= 0, зрушення вправо
У прикладі було згадано\(\PageIndex{2}\), що звичайною практикою є опущення одиниць при оцінці коефіцієнтів реакції та констант рівноваги. Слід зазначити, що використання концентрацій в цих обчисленнях є зручним, але спрощеним підходом, який іноді призводить до результатів, які, здавалося б, суперечать закону масової дії. Наприклад, рівноваги за участю водних іонів часто виявляють константи рівноваги, які досить значно змінюються (не є постійними) при високих концентраціях розчину. Цього можна уникнути, обчислюючи\(K_c\) значення, використовуючи активність реагентів і продуктів в системі рівноваги замість їх концентрацій. Активність речовини є мірою його ефективної концентрації при заданих умовах. Хоча детальне обговорення цієї важливої величини виходить за рамки вступного тексту, необхідно усвідомлювати кілька важливих аспектів:
- Діяльність є безрозмірними (безрозмірними) величинами і по суті є «скоригованими» концентраціями.
- Для відносно розведених розчинів активність розчиненої речовини та його молярна концентрація приблизно рівні.
- Діяльність для чистих конденсованих фаз (твердих речовин і рідин) дорівнює 1.
- Діяльність для розчинників в розведеному розчині дорівнює 1.
Як наслідок цього два останні аспекти,\(Q_c\) а\(K_c\) вирази не містять термінів для твердих речовин або рідин або розчинників у розведених розчинях (будучи чисельно рівними 1, ці терміни не впливають на значення виразу). Кілька прикладів рівноваг, що дають такі вирази, будуть зустрічатися в цьому розділі.
однорідні рівноваги
Однорідна рівновага - це таке, при якому всі реагенти і продукти присутні в одному розчині (за визначенням, однорідна суміш). У цьому розділі ми зосередимося на двох найпоширеніших типах однорідних рівноваг: тих, що виникають у рідинно-фазових розчинах, і тих, що стосуються виключно газоподібних видів. Реакції між розчиненими речовинами в рідких розчинах відносяться до одного типу однорідних рівноваг. Задіяні хімічні види можуть бути молекулами, іонами або сумішшю обох. Тут наведено кілька прикладів:
Приклад 1
\[\ce{C2H2}(aq)+\ce{2Br2}(aq) \rightleftharpoons \ce{C2H2Br4}(aq)\hspace{20px} \label{13.3.7a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[C2H2Br4]}{[C2H2][Br2]^2}} \label{13.3.7b} \]
Приклад 2
\[\ce{I2}(aq)+\ce{I-}(aq) \rightleftharpoons \ce{I3-}(aq) \label{13.3.8b} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[I3- ]}{[I2][I- ]}} \label{13.3.8c} \]
Приклад 3
\[\ce{Hg2^2+}(aq)+\ce{NO3-}(aq)+\ce{3H3O+}(aq) \rightleftharpoons \ce{2Hg^2+}(aq)+\ce{HNO2}(aq)+\ce{4H2O}(l) \label{13.3.9a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[Hg^2+]^2[HNO2]}{[Hg2^2+][NO3- ][H3O+]^3}} \label{13.3.9b} \]
Приклад 4
\[\ce{HF}(aq)+\ce{H2O}(l) \rightleftharpoons \ce{H3O+}(aq)+\ce{F-}(aq) \label{13.3.10a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[H3O+][F- ]}{[HF]}} \label{13.3.10b} \]
Приклад 5
\[\ce{NH3}(aq)+\ce{H2O}(l) \rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \label{13.3.11a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}} \label{13.3.11b} \]
У кожному з цих прикладів система рівноваги являє собою водний розчин, що позначається анотаціями aq на формулах розчинених речовин. Оскільки H 2 O (l) є розчинником для цих розчинів, йому присвоюється активність 1, і, таким чином, не відображається явно як термін у\(K_c\) виразі, як обговорювалося раніше, хоча він також може відображатися як реагент або продукт у хімічному рівнянні.
Реакції, в яких всі реагенти і продукти є газами, представляють другий клас однорідних рівноваг. Ми використовуємо молярні концентрації в наступних прикладах, але незабаром побачимо, що парціальний тиск газів також може використовуватися:
Приклад 1
\[\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g) \label{13.3.12a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[C2H4][H2]}{[C2H6]}} \label{13.3.12b} \]
Приклад 2
\[\ce{3O2}(g) \rightleftharpoons \ce{2O3}(g) \label{13.3.13a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[O3]^2}{[O2]^3}} \label{13.3.13b} \]
Приклад 3
\[\ce{N2}(g)+\ce{3H2}(g) \rightleftharpoons \ce{2NH3}(g) \label{13.3.14a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[NH3]^2}{[N2][H2]^3}} \label{13.3.14b} \]
Приклад 4
\[\ce{C3H8}(g)+\ce{5O2}(g) \rightleftharpoons \ce{3CO2}(g)+\ce{4H2O}(g)\label{13.3.15a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[CO2]^3[H2O]^4}{[C3H8][O2]^5}}\label{13.3.15b} \]
Зверніть увагу, що концентрація\(\ce{H_2O}_{(g)}\) була включена в останній приклад, оскільки вода не є розчинником у цій газофазній реакції і її концентрація (і активність) змінюється.
Всякий раз, коли гази беруть участь у реакції, парціальний тиск кожного газу можна використовувати замість його концентрації в рівнянні для коефіцієнта реакції, оскільки парціальний тиск газу прямо пропорційний його концентрації при постійній температурі. Ця залежність може бути виведена з ідеального рівняння газу, де М - молярна концентрація газу,\(\dfrac{n}{V}\).
\[\begin{align} PV&=nRT \label{13.3.16} \\[4pt] P &=\left(\dfrac{n}{V}\right)RT \label{13.3.17} \\[4pt] &=MRT \label{13.3.18} \end{align} \]
Таким чином, при постійній температурі тиск газу прямо пропорційно його концентрації. Використовуючи парціальні тиски газів, ми можемо записати коефіцієнт реакції для системи
\[\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g) \label{13.3.19} \]
дотримуючись тих самих вказівок для отримання виразів на основі концентрації:
\[Q_P=\dfrac{P_{\ce{C2H4}}P_{\ce{H2}}}{P_{\ce{C2H6}}} \label{13.3.20} \]
У цьому рівнянні ми використовуємо Q P для позначення коефіцієнта реакції, записаного з парціальними тисками:\(P_{\ce{C2H6}}\) парціальний тиск C 2 H 6;\(P_{\ce{H2}}\) парціальний тиск H 2; і\(P_{\ce{C2H6}}\) парціальний тиск C 2 H 4. При рівновазі:
\[K_P=Q_P=\dfrac{P_{\ce{C2H4}}P_{\ce{H2}}}{P_{\ce{C2H6}}} \label{13.3.21} \]
Індексит\(P\) в символі\(K_P\) позначає константу рівноваги, отриману з використанням парціальних тисків замість концентрацій. Константа рівноваги, K P, все ще є постійною, але її числове значення може відрізнятися від постійної рівноваги, знайденої для тієї ж реакції за допомогою концентрацій.
Перетворення між значенням для\(K_c\), постійною рівноваги, вираженою через концентрації, і значенням для\(K_P\), постійної рівноваги, вираженої через тиск, є прямим (A K або Q без індексу може бути або концентрацією, або тиском).
Рівняння, що стосується\(K_c\) і\(K_P\) виводиться наступним чином. Для газофазної реакції:
\[m\ce{A}+n\ce{B} \rightleftharpoons x\ce{C}+y\ce{D} \label{13.3.22} \]
із
\[ \begin{align} K_P &=\dfrac{(P_C)^x(P_D)^y}{(P_A)^m(P_B)^n} \label{13.3.23} \\[4pt] &=\dfrac{([\ce C]×RT)^x([\ce D]×RT)^y}{([\ce A]×RT)^m([\ce B]×RT)^n} \label{13.3.24} \\[4pt] &=\dfrac{[\ce C]^x[\ce D]^y}{[\ce A]^m[\ce B]^n}×\dfrac{(RT)^{x+y}}{(RT)^{m+n}} \label{13.3.25} \\[4pt] &=K_c(RT)^{(x+y)−(m+n)} \label{13.3.26} \\[4pt] &=K_c(RT)^{Δn} \label{13.3.27} \end{align} \]
Відносини між\(K_c\) і\(K_P\) є
\[ \color{red} K_P=K_c(RT)^{Δn} \label{13.3.28} \]
У цьому рівнянні Δn - різниця між сумою коефіцієнтів газоподібних продуктів і сумою коефіцієнтів газоподібних реагентів в реакції (зміна молів газу між реагентами і продуктами). Для газофазної реакції\(m\ce{A}+n\ce{B} \rightleftharpoons x\ce{C}+y\ce{D}\) ми маємо
\[Δn=(x+y)−(m+n) \label{13.3.29} \]
Напишіть рівняння для перетворення\(K_c\) в K P для кожної з наступних реакцій:
- \(\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g)\)
- \(\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g)\)
- \(\ce{N2}(g)+\ce{3H2}(g) \rightleftharpoons \ce{2NH3}(g)\)
- K c дорівнює 0,28 для наступної реакції при 900 °С:
\[\ce{CS2}(g)+\ce{4H2}(g) \rightleftharpoons \ce{CH4}(g)+\ce{2H2S}(g) \nonumber \]
Що таке К Р при такій температурі?
Рішення
(а) Δ n = (2) − (1) = 1
К Р =\(K_c\) (РТ) Δ n =\(K_c\) (РТ) 1 =\(K_c\) (РТ)
(б) Δ n = (2) − (2) = 0
К Р =\(K_c\) (РТ) Δ n =\(K_c\) (РТ) 0 = К с
(c) Δ n = (2) − (1 + 3) = −2
К Р =\(K_c\) (РТ) Δ n =\(K_c\) (РТ) −2 =\(\dfrac{K_c}{(RT)^2}\)
г) К Р =\(K_c\) (РТ) Δ n = (0,28) [(0,0821) (1173)] −2 = 3,0 × 10 −5
Напишіть рівняння для перетворення\(K_c\) в K P для кожної з наступних реакцій, які відбуваються в газовій фазі:
- \(\ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g)\)
- \(\ce{N2O4}(g) \rightleftharpoons \ce{2NO2}(g)\)
- \(\ce{C3H8}(g)+\ce{5O2}(g) \rightleftharpoons \ce{3CO2}(g)+\ce{4H2O}(g)\)
- При 227° С наступна реакція має\(K_c\) = 0,0952:
\[\ce{CH3OH}(g) \rightleftharpoons \ce{CO}(g)+\ce{2H2}(g) \nonumber \]
Яким буде значення K P при цій температурі?
- Відповідь на
-
К Р =\(K_c\) (РТ) −1
- Відповідь б
-
К Р =\(K_c\) (РТ)
- Відповідь c
-
К Р =\(K_c\) (РТ);
- Відповідь d
-
160 або 1,6 × 10 2
Гетерогенні рівноваги
Гетерогенна рівновага - це система, в якій реагенти і продукти знаходяться в двох і більше фазах. Фази можуть бути будь-якою комбінацією твердих, рідких або газових фаз і розчинів. Маючи справу з цими рівновагами, пам'ятайте, що тверді речовини та чисті рідини не з'являються в рівноважних постійних виразах (діяльність чистих твердих речовин, чистих рідин та розчинників становить 1).
Деякі гетерогенні рівноваги включають хімічні зміни:
Приклад 1
\[\ce{PbCl2}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{2Cl-}(aq) \label{13.3.30a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{[Pb^2+][Cl- ]^2} \label{13.3.30b} \]
Приклад 1
\[\ce{CaO}(s)+\ce{CO2}(g) \rightleftharpoons \ce{CaCO3}(s) \label{13.3.31a} \]
з пов'язаною постійною рівноваги
\[K_c=\dfrac{1}{[\ce{CO2}]} \label{13.3.31b} \]
Приклад 1
\[\ce{C}(s)+\ce{2S}(g) \rightleftharpoons \ce{CS2}(g) \label{13.3.32a} \]
з пов'язаною постійною рівноваги
\[K_c=\ce{\dfrac{[CS2]}{[S]^2}} \label{13.3.32b} \]
Інші гетерогенні рівноваги передбачають фазові зміни, наприклад, випаровування рідкого брому, як показано в наступному рівнянні:
\[\ce{Br2}(l) \rightleftharpoons \ce{Br2}(g) \label{13.3.33a} \]
з пов'язаною постійною рівноваги
\[K_c=[\ce{Br2}] \label{13.3.33b} \]
Ми можемо написати рівняння для коефіцієнтів реакції гетерогенних рівноваг, що включають гази, використовуючи парціальні тиски замість концентрацій. Два приклади:
\[\ce{CaO}(s)+\ce{CO2}(g) \rightleftharpoons \ce{CaCO3}(s)\label{13.3.34a} \]
з пов'язаною постійною рівноваги
\[K_P=\dfrac{1}{P_{\ce{CO2}}} \label{13.3.34b} \]
\[\ce{C}(s)+\ce{2S}(g) \rightleftharpoons \ce{CS2}(g)\label{13.3.35a} \]
з пов'язаною постійною рівноваги
\[K_P=\dfrac{P_{\ce{CS2}}}{(P_{\ce S})^2} \label{13.3.35b} \]
Резюме
Для будь-якої реакції, яка знаходиться в рівновазі, коефіцієнт реакції Q дорівнює постійній рівноваги K для реакції. Якщо реагентом або продуктом є чиста тверда речовина, чиста рідина або розчинник в розведеному розчині, концентрація цього компонента не відображається в вираженні для константи рівноваги. При рівновазі значення концентрацій реагентів і продуктів постійні. Їх конкретні значення можуть змінюватися в залежності від умов, але значення коефіцієнта реакції завжди дорівнюватиме K (K c при використанні концентрацій або K P при використанні парціальних тисків).
Однорідна рівновага - це рівновага, при якому всі компоненти знаходяться в одній фазі. Гетерогенна рівновага - це рівновага, при якому компоненти знаходяться в двох і більше фазах. Ми можемо вирішити, чи є реакція в рівновазі, порівнявши коефіцієнт реакції з постійною рівноваги для реакції.
Ключові рівняння
- \(Q=\dfrac{[\ce C]^x[\ce D]^y}{[\ce A]^m[\ce B]^n}\hspace{20px}\textrm{where }m\ce A+n\ce B⇌x\ce C+y\ce D\)
- \(Q_P=\dfrac{(P_C)^x(P_D)^y}{(P_A)^m(P_B)^n}\hspace{20px}\textrm{where }m\ce A+n\ce B⇌x\ce C+y\ce D\)
- Р = МРТ
- К Р =\(K_c\) (РТ) Δ n
Глосарій
- постійна рівноваги (K)
- значення коефіцієнта реакції для системи при рівновазі
- гетерогенні рівноваги
- рівноваги між реагентами і продуктами в різних фазах
- однорідні рівноваги
- рівноваги в межах однієї фази
- К с
- константа рівноваги для реакцій на основі концентрацій реагентів і продуктів
- К П
- константа рівноваги для газофазних реакцій на основі парціальних тисків реагентів і продуктів
- закон масового позову
- коли оборотна реакція досягла рівноваги при заданій температурі, коефіцієнт реакції залишається постійним
- коефіцієнт реакції (Q)
- відношення добутку молярних концентрацій (або тисків) продуктів до показника реагентів, кожна концентрація (або тиск) підвищується до потужності, рівної коефіцієнту в рівнянні
