11.4: Вирази рівноваги
- Page ID
- 19125
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Рівноважний коефіцієнт Q - це значення рівноважного вираження реакції для будь-якого довільного набору концентрацій або парціальних тисків компонентів реакції.
- Константа рівноваги K - це значення Q, коли реакція знаходиться в рівновазі. K має унікальне значення для даної реакції при фіксованій температурі і тиску.
- Q і K можуть бути виражені через концентрації, парціальний тиск або, коли це доречно, в деякій комбінації цих.
- Для реакції, в якій всі компоненти є газами, Q c і K c матимуть різні значення за винятком особливого випадку, коли загальна кількість молів газу не змінюється.
- Терміни концентрації для речовин, концентрації яких не змінюються в реакції, не відображаються в рівноважних виразах. Найбільш поширеними прикладами є [Н 2 О], коли реакція протікає у водному розчині (так що [Н 2 О] ефективно постійна при 55,6 М), і в неоднорідних реакціях за участю твердих тіл, в яких концентрація твердого речовини визначається щільністю сама тверда речовина.
- Реакція, постійна рівноваги якої знаходиться в діапазоні приблизно від 0,01 до 100, вважається неповною або [термодинамічно] оборотною.
- Q і K умовно розглядаються як безрозмірні величини, і зазвичай не повинні мати одиниць, пов'язаних з ними.
- Гетерогенні реакції - це ті, в яких беруть участь дві або більше фаз; однорідні реакції протікають в одній фазі. Поширеним типом гетерогенної реакції є втрата води кристалізації твердим гідратом типу CuSo 4 ·5H 2 O.
- Вираз рівноваги можна маніпулювати та комбінувати наступними способами:
- Якщо реакція записана в зворотному порядку, Q стає Q —1;
- Якщо коефіцієнти рівняння помножити на n, Q стає Q n;
- Q для суми двох реакцій (тобто для двох реакцій, що протікають послідовно) - добуток (Q 1) (Q 2).
Ви знаєте, що вираз постійної рівноваги виглядає приблизно на кшталт K = [продукти]/[реагенти]. Але як перевести це в формат, який відноситься до реальної хімічної системи, яка вас цікавить? Цей урок покаже вам, як написати вирази постійної рівноваги, які вам потрібно буде використовувати при вирішенні проблем розрахунку рівноваги в главі, що слідує за цим.
Тиск може виражати концентрації
Хоча ми зазвичай пишемо коефіцієнти рівноваги та константи рівноваги з точки зору молярних концентрацій, можна використовувати будь-який термін, подібний до концентрації, включаючи молярну фракцію та моляльність. Іноді символи\(K_c\)\(K_x\), і\(K_m\) використовуються для позначення цих форм постійної рівноваги. Майте на увазі, що числові значення K та Q, виражені цими різними способами, як правило, не будуть однаковими.
Більшість рівноваг, з якими ми маємо справу в цьому курсі, відбуваються в рідких розчині і газоподібних сумішах. Ми можемо висловити\(K_c\) значення в перерахунку молів на літр для обох, але при роботі з газами часто зручніше використовувати парціальний тиск. Ці два заходи концентрації, звичайно, прямо пропорційні:
\[c=\dfrac{n}{V}=\dfrac{\dfrac{PV}{RT}}{V}=\dfrac{P}{RT} \label{Eq1}\]
тому для реакції\(A_{(g)} \rightarrow B_{(g)}\) ми можемо записати постійну рівноваги як
\[K_p =\dfrac{P_B}{P_A} \label{Eq2}\]
Завдяки взаємодії між молекулами, особливо коли беруть участь іони, всі ці форми постійної рівноваги є лише приблизно правильними, найкраще працюють при низьких концентраціях або тиску. Єдина постійна рівноваги, яка дійсно «постійна» (за винятком того, що вона все ще змінюється в залежності від температури!) виражається з точки зору діяльності, яку можна вважати «ефективними концентраціями», що дозволяють взаємодіяти між молекулами. На практиці це розмежування стає важливим лише для рівноваг за участю газів при дуже високих тисках (таких, як часто зустрічаються в хімічній техніці) та в іонних розчинях, більш концентрованих, ніж близько 0,001 М. Ми не будемо багато займатися діяльністю в цьому курсі.
Для такої реакції, як
\[CO_{2\, (g)} + OH^–_{(aq)} \rightleftharpoons HCO_{3\, (aq)}^- \label{Eq3}\]
що включає як газоподібні, так і розчинені компоненти, зазвичай використовується «гібридна» константа рівноваги:
\[ K =\dfrac{[HCO_3^-]}{P_{CO_2}[OH^-]} \label{Eq4}\]
Зрозуміло, що важливо бути впевненим у одиницях, коли ви бачите постійну рівноваги, представлену просто "\(K\)».
На цьому уроці (і в більшості інших у цьому наборі) ми виражаємо концентрації в молі L -1 і тиск в атмосферах. Хоча це відображає поширене використання серед хіміків (особливо старих!) , ці одиниці не є частиною системи СІ, яка є міжнародним стандартом з останньої частини 20-го століття.
Молярні концентрації зараз більш правильно виражені в моль дм —3, а «стандартна атмосфера» відповідає тиску 101,325 кПа. До 1990 року 1 атм був «стандартним тиском», використовуваним при розрахунках за участю газових законів, а також в термодинаміці. З цієї дати «стандартний тиск» становив 100.000 кПа, також виражений як 1 бар.
Для більшості практичних цілей відмінності між цими значеннями настільки малі, що ними можна знехтувати.
Перетворення між\(K_p\) і\(K_c\)
Іноді необхідно перетворити між константами рівноваги, вираженими в різних одиницях. Найбільш поширений випадок передбачає константи рівноваги тиску і концентрації. Відзначимо, що при вираженні V в літрах і P в атмосферах R повинен мати значення 0,08206 L-атм/моль К.). Закон ідеального газу пов'язує парціальний тиск газу до кількості молів і його обсягу:
\[PV = nRT \]
Концентрації виражаються в моль/одиничному об'ємі Н/в, тому шляхом перестановки вищевказаного рівняння отримуємо явне відношення тиску до концентрації:
\[P = \left(\dfrac{n}{V} \right)RT \label{Eq5}\]
І навпаки,
\[c = \dfrac{n}{V} = \dfrac{P}{RT}\]
тому концентрація газу [А] може бути виражена як\(\dfrac{P_A}{RT}\).
Для реакції форми\(A + 3 B\rightleftharpoons 2C\) ми можемо написати
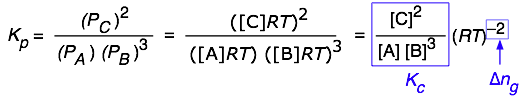
Якщо припустити, що всі компоненти є газами, різниця
\[(\text{moles of gas in products}) – (\text{moles of gas in reactants}) = \Delta{n_g} \nonumber\]
дається
\[ \color{red} {K_p = K_c (RT)^{\Delta{n_g}} \label{Eq6}}\]
Не показуйте незмінних концентрацій!
Речовини, концентрації яких не зазнають значних змін в хімічній реакції, не виявляються в рівноважних постійних виразах. Як може не змінюватися концентрація реагенту або продукту, коли відбувається реакція, що включає цю речовину? Є два загальних випадки, які слід розглянути.
Речовина також є розчинником
Це відбувається весь час в кислотно-лужної хімії. Таким чином, для гідролізу ціаністого іона
\[\ce{CN^{-} + H2O <=> HCN + OH^{–}} \nonumber\]
пишемо
\[K_c= \dfrac{[\ce{HCN}][\ce{OH^-}]}{[\ce{CN^-}]} \nonumber\]
в якому немає жодного\([H_2O]\) терміну. Обгрунтування цього упущення полягає в тому, що вода є одночасно розчинником і реагентом, але лише крихітна частина, яка діє як реагент, зазвичай переходить у вираження рівноваги. Кількість води, що споживається в реакції, настільки хвилинна (\(K\)тому що дуже мала), що будь-яка зміна концентрації\(H_2O\) від концентрації чистої води (55,6 моль L —1) буде незначною.
Аналогічно і для «автодисоціації» води
\[H_2O = H^+ + OH^– \nonumber\]
константа рівноваги виражається як «іонний продукт»
\[K_w = [H^+][OH^–] \nonumber\]
Будьте обережні, щоб викинути H 2 O щоразу, коли ви його бачите. У реакції етерифікації
\[\ce{CH3COOH + C2H5OH <=> CH3COOC2H5 + H2O} \nonumber\]
про який ми говорили в попередньому розділі, термін [H 2 O] повинен бути присутнім у вираженні рівноваги, якщо передбачається, що реакція між двома рідинами оцтової кислоти та етанолу. Якщо, з іншого боку, реакція відбувається між розведеним водним розчином кислоти і спиртом, то термін [H 2 O] не буде включений.
Речовина являє собою тверду або чисту рідку фазу
Це найчастіше спостерігається в рівновагах розчинності, але є багато інших реакцій, в яких тверді речовини беруть безпосередню участь:
\[CaF_{2\, (s)} \rightarrow Ca^{2+}_{(aq)} + 2F^-_{(aq)} \label{Eq11}\]
\[Fe_3O_4(s) + 4 H_{2\, (g)} \rightarrow 4 H_2O_{(g)} + 3Fe_{(s)} \label{Eq12}\]
Це гетерогенні реакції (мається на увазі реакції, в яких деякі компоненти знаходяться в різних фазах), і аргумент тут полягає в тому, що концентрація має сенс лише при застосуванні до речовини в межах однієї фази.
Таким чином, термін\([CaF_2]\) буде стосуватися «концентрації фториду кальцію всередині твердої\(CaF_2\) речовини «, яка є постійною залежно від молярної маси\(CaF_2\) та щільності цього твердого тіла. Концентрації двох іонів будуть незалежними від кількості\(CaF_2\) твердої речовини, що контактує з водою; Іншими словами, система може перебувати в рівновазі до тих пір, поки будь-який\(CaF_2\) взагалі присутній. Викидання термінів постійної концентрації може призвести до деяких досить рідкісних виразів рівноваги. Наприклад, вираз рівноваги для кожного з процесів, показаних у наступній таблиці, складається виключно з одного терміна, що включає парціальний тиск газу:
| \(CaCO_{3(s)} \rightleftharpoons CaO_{(s)} + CO_{2(g)}\) |
\(K_p = P_{CO_2}\) |
Термічне розкладання вапняку, перший крок у виготовленні цементу. |
| \ (Na_2SO_4\ cdot 10 Н_2О_ {(и)} Na_2SO_ {4 (и)} + 10 Н_2О_ {(г)}\) |
\(K_p = P_{H_2O}^{10}\) |
Сульфат натрію декагідрат - тверда речовина, в якій молекули Н2О («води гідратації») включені в кристалічну структуру.) |
| \(I_{2(s)} \rightleftharpoons I_{2(g)}\) |
\(K_p = P_{I_2}\) |
сублімація твердого йоду; це джерело фіолетового пари ви можете побачити вище твердого йоду в закритій ємності. |
| \(H_2O_{(l)} \rightleftharpoons H_2O_{(g)}\) |
\(K_p = P_{H_2O}\) |
Випаровування води. Коли парціальний тиск водяної пари в повітрі дорівнює К, відносна вологість становить 100%. |
Останні два процеси являють собою зміни стану (фазові зміни), які можна лікувати точно так само, як і хімічні реакції. У кожному з різнорідних процесів, показаних в табл\(\PageIndex{1}\), реагенти і продукти можуть перебувати в рівновазі (тобто постійно співіснувати) тільки тоді, коли парціальний тиск газоподібного продукту має значення, відповідне зазначеному\(K_p\). Майте на увазі також, що\(K_p\) це все збільшується з температурою.
Які значення рівноваги між рідкою водою та її парою при 25° C, 100° C та 120° C?\(K_p\) Тиск пари води при цих трьох температурах становить 23,8 торр, 760 торр (1 атм) і 1489 торр відповідно.
Коментар: Thes e тиск пари є парціальним тиском водяної пари в рівновазі з рідиною, тому вони ідентичні з тими, коли виражені в одиницях атмосфер.\(K_p\)
Рішення
|
25°C
|
100°C
|
120°C
|
|---|---|---|
| \(K_p = \dfrac{23.8\; torr}{ 760\; torr/atm} = 0.031\; atm\) | \(K_p = 1.00\; atm\) | \(K_p = \dfrac{1489\; torr}{ 760\; torr/atm} = 1.96\; atm\) |
| Парціальний тиск Н2О над поверхнею рідкої води в закритій ємності при 25° C буде наростати до цієї величини. Якщо кришку зняти так, що цей тиск не можна підтримувати, система перестане бути в рівновазі і вода буде випаровуватися. |
Ця температура відповідає, звичайно ж, температурі кипіння води. Нормальною температурою кипіння рідини вважається температура, при якій парціальний тиск її пари становить 1 атм.
|
Єдиний спосіб нагріти воду вище її нормальної температури кипіння - це робити в закритій ємності, яка витримує підвищений тиск пари. Таким чином, скороварка, яка працює при 120° C, повинна бути сконструйована таким чином, щоб витримувати внутрішній тиск не менше 2 атм. |
Значення констант рівноваги
або «оборотний».
Оскільки постійна рівноваги наближається до меж нуля або нескінченності, реакцію можна все частіше характеризувати як односторонній процес; ми говоримо, що вона «повна» або «незворотна». Останній термін, звичайно, не слід приймати буквально; принцип Ле Шательє все ще застосовується (особливо, що стосується температури), але додавання або видалення реагентів або продуктів матиме менший ефект.
Кінетично ускладнені реакції
Хоча це аж ніяк не є загальним правилом, часто трапляється, що реакції, що мають дуже великі константи рівноваги, кінетично перешкоджають, часто в тій мірі, в якій реакція по суті не відбувається.
Приклади в наступній таблиці покликані показати, що числа (значення K), якими б тьмяними вони не виглядали, мають практичні наслідки!
| Реакція |
К
|
зауваження |
|---|---|---|
| \(N_{2(g)} + O_{2(g)} \rightleftharpoons 2 NO_{(g)}\) | \(5 \times 10^{–31}\)при 25°C, 0.0013 при 2100 °C |
Ці два дуже різні значення K дуже добре ілюструють, чому зниження температури камери згоряння в автомобільних двигунів є екологічно чистим. |
| \(3 H_{2(g)} + N_{2(g)} \rightleftharpoons 2 NH_{3(g)}\) | \(7 \times 10^5\)при 25°C, 56 при 1300°C |
Дивіться обговорення цієї реакції в розділі, присвяченому процесу Хабера. |
| \(H_{2(g)} \rightleftharpoons 2 H_{(g)}\) | \(10^{–36}\)при 25°C, \(6 \times 10^{–5}\) при 5000° |
Дисоціація будь-якої стабільної молекули на її атоми носить ендотермічний характер. Це означає, що всі молекули будуть розкладатися при досить високих температурах. |
| \(H_2O_{(g)} \rightleftharpoons H_{2(g)} + ½ O_{2(g)}\) | \(8 \times 10^{–41}\)при 25°C | Ви не знайдете воду дуже хорошим джерелом газу кисню при звичайних температурах! |
| \ (CH_3COOH_ {(l)}\ правий лівий гарпуни 2 H_2O_ {(l)} + 2 C_ {(s)}\) |
\(K_c = 10^{13}\)при 25°C | Це говорить нам про те, що оцтова кислота має велику тенденцію до розкладання на вуглець, але ніхто ніколи не знаходив графіту (або алмази!) формування в пляшці оцту. Хороший приклад супер кінетично ускладненої реакції! |
Рівноважний експресія для синтезу аміаку
\[3 H_{2(g)} + N_{2(g)} \rightarrow 2 NH_{3(g)} \label{Eq13}\]
може виражатися як
\[ K_p =\dfrac{P^2_{NH_3}}{P_{N_2}P^3_{H_2}} \label{Eq14}\]
або
\[ K_c = \dfrac{[NH_3]^2}{[N_2] [H_2]^3} \label{Eq15}\]
так що\(K_p\) для цього процесу, як видається, мають одиниці атм —1, і\(K_c\) буде виражено в моль —2 L 2. І все ж ці величини часто представляються як безрозмірні. Що правильно? Відповідь полягає в тому, що обидві форми прийнятні. Є деякі ситуації (з якими ви зіткнетеся пізніше), в яких K повинні вважатися безрозмірними, але, просто цитуючи значення константи рівноваги, допустимо включити одиниці, і це може бути навіть корисно для того, щоб усунути будь-які сумніви щодо одиниць індивіда терміни в рівноважних виразах, що містять терміни як тиску, так і концентрації. При проведенні власних розрахунків, однак, рідко виникає реальна необхідність показати одиниці.
Строго кажучи, рівноважні вирази не мають одиниць, оскільки терміни концентрації або тиску, що входять в них, насправді є співвідношеннями, що мають форми (n моль L —1)/(1 моль L —1) або (n атм)/(1 атм), в яких одинична кількість в знаменник відноситься до стандартного стану речовини; таким чином одиниці завжди скасовують. (Але студенти першого курсу, як очікується, не дізнаються про це!)
Для речовин, які є рідинами або твердими речовинами, стандартний стан - це лише концентрація речовини всередині рідини або твердої речовини, тому для чогось подібного CaF (s) термін, що переходить у вираз рівноваги, є [CaF 2]/[CaF 2] який скасовує до єдності; це Причина нам не потрібно включати терміни для твердих або рідких фаз у вираження рівноваги. Тема стандартних станів виведе нас за межі того місця, де ми повинні бути в цей момент в курсі, тому ми просто скажемо, що концепція необхідна тим, що енергія, яка в кінцевому підсумку регулює хімічні зміни, завжди відносно деякого довільно визначеного нульового значення, яке для хімічних речовин, є стандартним станом.
Як рівняння реакції впливає на K
Важливо пам'ятати, що рівноважний частка або постійна завжди прив'язана до конкретного хімічного рівняння, і якщо ми запишемо рівняння в зворотному порядку або помножимо його коефіцієнти на загальний коефіцієнт, значення\(Q\) або\(K\) зміниться. Правила дуже прості:
- Запис рівняння в зворотному порядку дозволить інвертувати вираз рівноваги;
- Множення коефіцієнтів на загальний коефіцієнт підвищить Q або K до відповідної потужності.
Ось деякі можливості реакції, що передбачає рівновагу між газоподібною водою та її елементами:
Приклад 1:\(\ce{2 H2 + O2 <=> 2 H2O} \) з виразом рівноваги\[K_p = \dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}} \nonumber\]
Приклад 2:\(\ce{10 H2 + 5 O2 <=> 10 H2O}\) з виразом рівноваги\[\begin{align*} K_p &= \dfrac{P_{H_2O}^{10}}{P_{H_2}^{10}P_{O_2}^5} \\[4pt] &= \left(\dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}}\right)^{5}\end{align*}\]
Приклад 3:\(\ce{H2 + 1/2 O2 <=> H2O} \) з виразом рівноваги\[\begin{align*} K_p &= \dfrac{P_{H_2O}}{P_{H_2}P_{O_2}^{1/2}} \\[4pt] &= \left(\dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}}\right)^{1/2} \end{align*}\]
Приклад 4:\(\ce{H2O <=> H2 + 1/2 O2 } \) з виразом рівноваги\[\begin{align*} K_p &= \dfrac{P_{H_2}P_{O_2}^{1/2}}{P_{H_2O}} \\[4pt] &= \left(\dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}}\right)^{-1/2} \end{align*}\]
Багато хімічні зміни можна розглядати як суму або різницю двох або більше інших реакцій. Якщо ми знаємо константи рівноваги окремих процесів, ми можемо легко обчислити це для загальної реакції за наступним правилом.
T постійна рівноваги для суми двох і більше реакцій є добутком констант рівноваги для кожного з кроків.
Обчисліть значення\(K\) для реакції
\[\ce{CaCO3(s) + H^{+}(aq) <=> Ca^{2+}(aq) + HCO^{–}3(aq)} \nonumber\]
задані наступні константи рівноваги:
|
\(CaCO_{3(s)} \rightleftharpoons Ca^{2+}_{(aq)} + CO^{2–}_{3(aq)}\) |
\(K_1 = 10^{–6.3}\) |
|
\(HCO^–_{3(aq)} \rightleftharpoons H^+_{(aq)} + CO^{2–}_{3(aq)}\) |
\(K_2 = 10^{–10.3}\) |
Рішення
Чиста реакція - це сума реакції 1 і зворотна реакція 2:
|
\(CaCO_{3(s)} \rightleftharpoons Ca^{2+}_{(aq)} + CO^{2–}_{3(aq)}\) |
\(K_1 = 10^{–6.3}\) |
|
\( H^+_{(aq)} + CO^{2–}_{3(aq)} \rightleftharpoons HCO^–_{3(aq)} \) |
\(K_{–2} = 10^{–(–10.3)}\) |
|
\(CaCO_{3(s)} + H^+_{(aq)} \rightarrow Ca^{2+}_{(aq)} + HCO^–_{3(aq)}\) |
\(K = \dfrac{K_1}{K_2} = 10^{(-6.4+10.3)} =10^{+3.9}\) |
Коментар:
Ця чиста реакція описує розчинення вапняку кислотою; вона відповідає за розмиває вплив кислотних дощів на будівлі та статуї. Це приклад реакції, яка практично не має тенденції відбуватися сама по собі (малий K 1), будучи «керованим» другою реакцією, що має велику константу рівноваги (K —2). З точки зору принципу Ле Шательє перша реакція «тягнеться вправо» видаленням карбонату іоном водню. Пов'язані реакції цього типу широко зустрічаються у всіх областях хімії, і особливо в біохімії, в якій може бути пов'язано близько десятка реакцій.
Синтез\(\ce{HBr}\) from hydrogen and liquid bromine has an equilibrium constan t\(K_p = 4.5 \times 10^{15}\) a t 25°C Враховуючи, що тиск пари рідкого брому становить 0,28 атм, знаходять\(K_p\) for the homogeneous gas-phase reaction at the same temperature.
Рішення
Чиста реакція, яку ми шукаємо, - це сума гетерогенного синтезу\(\ce{HBr}\) and the reverse of the vaporization of liquid bromine:
| \(H_{2(g)} + Br_{2(l)} \rightleftharpoons 2 HBr_{(g)}\) | \(K_p = 4.5\times 10^{15}\) |
| \(Br_{2(g)} \rightleftharpoons Br_{2(l)}\) | \(K_p = (0.28)^{–1}\) |
| \(H_{2(g)} + Br_{2(g)} \rightleftharpoons 2 HBr_{(g)}\) | \(K_p = 1.6 \times 10^{16}\) |
Детальніше про гетерогенні реакції
Гетерогенні реакції - це реакції, що включають більше однієї фази. Деякі приклади:
| \(Fe(s) + O_2(g) \rightleftharpoons FeO_2(s)\) | повітряне окислення металевого заліза (утворення іржі) |
|---|---|
| \ (Fe (s) + O_2 (g)\ правий лівий гарпуни FeO_2 (s)\)» стиль = «вирівнювання тексту: центр;" >\ (CAF_2 (s)\ правий лівий гарпуни Ca (aq) + F ^+ (aq)\ _ | розчинення фториду кальцію у воді |
| \ (Fe (s) + O_2 (g)\ правий лівий гарпуни FeO_2 (s)\)» стиль = «вирівнювання тексту: центр;" >\(H_2O(s) \rightleftharpoons H_2O(g)\) | сублімація льоду (зміна фази) |
| \ (Fe (s) + O_2 (g)\ правий лівий гарпуни FeO_2 (s)\) ">
\ (NaHCO_3 (s) + H ^ + (aq)\ правий лівий гарпуни |
утворення вуглекислого газу з бікарбонату натрію при додаванні води до розпушувача (іони водню надходять з винної кислоти, іншого компонента розпушувача.) |
Тиск пари твердих гідратів
Особливо цікавим видом неоднорідної реакції є та, при якій тверде тіло знаходиться в рівновазі з газом. Сублімація льоду, проілюстрована в наведеній вище таблиці, є дуже поширеним прикладом. Константа рівноваги для цього процесу - це просто парціальний тиск водяної пари в рівновазі з твердим - тиском пари льоду.
Багато поширених неорганічних солей утворюють тверді речовини, які включають молекули води в свої кристалічні структури. Ці молекули води зазвичай тримаються досить вільно і можуть виходити як водяна пара. Наприклад, сульфат міді (II) утворює пентагідрат, в якому чотири молекули води координуються з іоном Cu 2 +, тоді як п'ята пов'язана з воднем з SO 4 2—. Ця остання вода більш щільно пов'язана, так що пентагідрат втрачає воду в два етапи при нагріванні:
\[\ce{CuSO4 \cdot 5H2O ->[140^oC] CuSO4 \cdot 5H2O ->[400^oC] CuSO4} \nonumber\]
Ці етапи зневоднення проводяться при температурах, зазначених вище, але при будь-якій температурі деяка кількість вологи може вийти з гідрату. Для повного зневоднення пентагідрату ми можемо визначити постійну рівноваги:
\[\ce{CuSO4 \cdot 5H2O(s) <=> CuSO4(s) + 5 H2O(g)} \quad K_p = 1.14 \times 10^{10} \nonumber\]
Тиск пари гідрату (для цієї реакції) - парціальний тиск водяної пари, при якому два тверді речовини можуть співіснувати нескінченно довго; його значення становить \(K_p\)1/5 атм. Якщо гідрат піддається впливу повітря, в якому парціальний тиск водяної пари менше, ніж тиск його пари, реакція буде протікати вправо і гідрат втратить вологу. Тиск пари завжди збільшується з температурою, тому будь-яке з цих сполук може зневоднюватися нагріванням.
Втрата води зазвичай викликає руйнування структури кристала; це зазвичай спостерігається при сульфаті натрію, тиск пари якого досить великий, щоб він міг перевищувати парціальний тиск водяної пари в повітрі при низькій відносній вологості. Те, що видно, полягає в тому, що добре сформовані кристали декагідрату зазнають погіршення в порошкоподібну форму, явище відоме як висоли е.
| найменування | формула | тиск пари, торр | |
|---|---|---|---|
| 25° C | 30°C | ||
| сульфат натрію декагідрат | Na 2 СО 4 · 10H 2 О | 19.2 | 25.3 |
| пентагідрат сульфату міді (II) | КуСо 4 · 5 Ч 2 О | 7.8 | 12.5 |
| хлорид кальцію моногідрат | CaCl 2 · Н 2 О | 3.1 | 5.1 |
| (вода) | Н 2 О | 23.5 | 31.6 |
При якій відносній вологості пентагідрат мідного купоросу втратить води гідратації при температурі повітря 30°C? Що таке\(K_p\) for this process at this temperature?
РішенняЗ таблиці ми бачимо\(\PageIndex{3}\), що тиск пари гідрату становить 12,5 торр, що відповідає відносній вологості 12,5/31,6 = 0,40 або 40%. Це вологість, яка буде підтримуватися, якщо гідрат помістити в закриту ємність сухого повітря.
Для цього гідру, тому частина тиску водяної пари\(K_p = \sqrt{p_{H_2O)}}\), яка буде в рівновазі з гідратом і зневодненою твердою речовиною (пам'ятайте, що обидва тверді речовини повинні бути присутніми, щоб мати рівновагу!) , що виражається в атмосферах, буде
\[\left(\dfrac{12.5}{760}\right)^5 = 1.20 \times 10^{-9}. \nonumber\]
Одним з перших детально досліджених гідратів був напівгідрат сульфату кальцію (CaSO 4 · ½ H 2 O), який Le Chatelier (він з «принципу») показав, що це затверділа форма CaSO 4, відома як штукатурка Парижа. Безводний CaSO 4 утворює компактні, порошкоподібні кристали, тоді як витягнуті кристали напівгідрату зв'язуються в цементоподібну масу, що робить цей матеріал корисним для виготовлення предметів мистецтва, зліпків для іммобілізації пошкоджених кінцівок, а також в якості будівельного матеріалу (вогнезахисний, гіпсокартон).
