11.2: Принцип Ле Шательє
- Page ID
- 19121
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Система в її рівноважному стані залишатиметься в цьому стані на невизначений термін до тих пір, поки вона не порушена. Якщо рівновагу зруйнувати, піддаючи систему зміні тиску, температури або кількості молей речовини, то буде мати тенденцію до чистої реакції, яка переміщує систему в новий стан рівноваги. Принцип Ле Шательє говорить, що ця чиста реакція відбуватиметься у напрямку, який частково компенсує зміни.
- Принцип Ле Шательє має практичний ефект лише для реакцій, в яких значні кількості як реагентів, так і продуктів присутні в рівновазі - тобто для термодинамічно оборотних реакцій.
- Додавання більшої кількості речовин продукту в рівноважну суміш змістить рівновагу вліво; додавання більшої кількості реагентів змістить його вправо. Ці ефекти легко пояснюються з точки зору конкуруючих вперед- і зворотних реакцій - тобто законом масової дії.
- Якщо реакція екзотермічна (виділяє тепло), підвищення температури змусить рівновагу вліво, змушуючи систему поглинати тепло і, таким чином, частково компенсувати підвищення температури. Протилежний ефект настає для ендотермічних реакцій, які зміщуються вправо при підвищенні температури.
- Вплив тиску на рівновагу значний лише для реакцій, які включають різну кількість молів газів з двох сторін рівняння. Якщо кількість молів газів збільшується, то збільшення загального тиску буде прагнути ініціювати зворотну реакцію, яка споживає частину продуктів, частково зменшуючи ефект підвищення тиску.
- Класичним прикладом практичного використання принципу Ле Шательє є процес Хабера-Боша для синтезу аміаку, в якому необхідно знайти баланс між низькою температурою і високим тиском.
У попередньому модулі підкреслювався динамічний характер рівноваги, виражений Законом масової дії. Цей закон служить моделлю, що пояснює, як на склад рівноважного стану впливають «активні маси» (концентрації) реагентів і продуктів. У цьому уроці ми розробляємо наслідки цього закону, щоб відповісти на дуже практичне питання про те, як впливає на існуючий рівноважний склад додавання або виведення одного з компонентів.
Принцип Ле Шательє
Якщо реакція знаходиться в рівновазі, і ми змінюємо умови таким чином, щоб створити новий стан рівноваги, то склад системи буде мати тенденцію змінюватися, поки не буде досягнуто цього нового стану рівноваги. (Ми говоримо «схильні до змін», тому що якщо реакція кінетично гальмується, зміна може бути занадто повільною, щоб спостерігати, або вона може ніколи не відбутися.) У 1884 році французький інженер-хімік і викладач Анрі Ле Шательє (1850-1936) показав, що в кожному такому випадку новий стан рівноваги - це той, який частково зменшує ефект змін, які його привели.
Цей закон відомий кожному студенту хімії як принцип Ле Шательє. Його первісна формулювання була дещо складною, але досить корисний перефраз її звучить наступним чином:
Принцип Ле Шательє: Якщо система в рівновазі піддається зміні тиску, температури або кількості молей компонента, буде тенденція до чистої реакції в напрямку, що зменшує ефект цієї зміни.
Щоб побачити, як це працює (і ви повинні це зробити, оскільки це має настільки фундаментальне значення, що ви просто не можете зробити жодної значущої хімії без ретельного робочого розуміння цього принципу), знову подивіться на реакцію дисоціації йодидиду водню
\[2 HI \rightarrow H_2 + I_2\]
Розглянемо довільну суміш цих трьох компонентів при рівновазі, і припустимо, що ми впорскуємо в ємність більше водневого газу. Оскільки концентрація Н 2 тепер перевищує нове значення рівноваги, система більше не перебуває у стані рівноваги, тому зараз виникає чиста реакція, коли система рухається до нового стану.
Принцип Ле Шательє стверджує, що чиста реакція буде в напрямку, який має тенденцію до зменшення ефекту доданого Н 2. Це може статися, якщо частина Н 2 споживається, реагуючи з I 2, щоб утворити більше HI; іншими словами, чиста реакція відбувається в зворотному напрямку. Хіміки зазвичай просто говорять, що «рівновага зміщується вліво».
Щоб отримати краще уявлення про те, як це працює, уважно вивчіть діаграму нижче, яка слідує концентрації трьох компонентів цієї реакції, оскільки вони можуть змінюватися в часі (часова шкала тут зазвичай становить близько години):
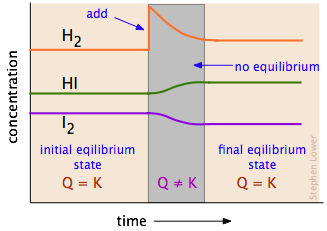
Порушення і відновлення рівноваги. Зліва концентрації трьох компонентів не змінюються з часом, оскільки система знаходиться в рівновазі. Потім додаємо в систему більше водню, порушуючи рівновагу. Потім виникає чиста реакція, яка переміщує систему в новий стан рівноваги (праворуч), в якому кількість йодиду водню збільшилася; в процесі споживається частина I 2 і H 2. Зверніть увагу, що новий стан рівноваги містить більше водню, ніж початковий стан, але не стільки, скільки було додано; як прогнозує принцип Ле Шательє, зміна, яку ми зробили (додавання H 2), частково протидіяла «зрушенням вправо». Таблиця\(\PageIndex{1}\) містить кілька прикладів, що показують, як зміна кількості компонента реакції може зрушити встановлену рівновагу.
|
|
|
результат
|
|---|---|---|
| СО 2 + Н 2 → Н 2 О (г) + СО | для поглинання Н 2 О додають сушильний агент | Зсув вправо. Безперервне видалення продукту змусить будь-яку реакцію вправо |
| Н 2 (г) + I 2 (г) → 2HI (г) | Додається деяка кількість азотного газу | Без змін; N 2 не є компонентом цієї реакційної системи. |
| NaCl (s) + H 2 SO 4 (л) → Na 2 SO 4 (s) + HCl (г) | реакція проводиться у відкритому контейнері | Оскільки HCl - це газ, який може виходити з системи, реакція змушена вправо. Це основа для промислового виробництва соляної кислоти. |
| Н 2 О (л) → Н 2 О (г) | вода випаровується з відкритої ємності | Безперервне видалення водяної пари змушує реакцію вправо, тому рівновага ніколи не досягається. |
| HCN (aq) → Н + (aq) + CN — (aq) | розчин розбавляється | Зсув вправо; продукт [H +] [CN —] зменшується швидше, ніж робить [HCN]. |
| AgCl (и) → Ag + (aq) + Сл — (aq) | в розчин додається трохи NaCl | Зсув вліво за рахунок збільшення Cl — концентрації. Це відомо як загальний вплив іонів на розчинність. |
| Н 2 + 3 Н 2 → 2 Н 3 | для прискорення цієї реакції додається каталізатор | Без змін. Каталізатори впливають тільки на швидкість реакції; вони взагалі не впливають на склад рівноважного стану. |
Як зміни температури впливають на рівноваги?
Практично всі хімічні реакції супроводжуються виділенням або поглинанням тепла. Якщо розглядати тепло як «реагент» або «продукт» в ендотермічній або екзотермічній реакції відповідно, ми можемо використовувати принцип Ле Шательє для прогнозування напрямку, в якому підвищення або зниження температури змістить стан рівноваги. Таким чином, для окислення азоту, ендотермічного процесу, ми можемо написати
\[\text{[heat]} + N_2 + O_2 \rightleftharpoons 2 NO\]
Припустимо, ця реакція знаходиться в рівновазі при якійсь температурі\(T_1\) і ми підвищуємо температуру до\(T_2\). Принцип Ле Шательє говорить нам, що чиста реакція відбудеться в напрямку, який частково протидіє цій зміні. Так як реакція ендотермічна, відбудеться зсув рівноваги вправо.

Оксид азоту, продукт цієї реакції, є основним забруднювачем повітря, який ініціює послідовність кроків, що ведуть до утворення атмосферного смогу. Його утворення є небажаною побічною реакцією, яка виникає при нагріванні повітря (який вводиться в камеру згоряння двигуна для подачі кисню) нагрівається до високої температури. Конструктори двигунів внутрішнього згоряння зараз намагаються різними способами обмежити температуру в області згоряння, або обмежити її найбільш високотемпературну частину невеликим обсягом всередині камери згоряння.
Як зміни тиску впливають на рівноваги?
Ви нагадаєте, що при зниженні тиску газу його обсяг збільшиться; тиск і обсяг обернено пропорційні. Маючи це на увазі, припустимо, що реакція
\[2 NO_{2(g)} \rightleftharpoons N_2O_{4(g)}\]
знаходиться в рівновазі при деякій довільній температурі і тиску, і що ми подвоюємо тиск, можливо, стискаючи суміш до меншого обсягу. З принципу Ле Шательє ми знаємо, що стан рівноваги зміниться на той, який має тенденцію протидіяти підвищенню тиску. Це може статися, якщо деяка частина NO 2 реагує на утворення більшої кількості тетроксиду азоту, оскільки з системи видаляються два молі газу на кожен утворений моль N 2 O 4, тим самим зменшуючи загальний обсяг системи. Таким чином, підвищення тиску змістить цю рівновагу вправо.
\[Δn_g = (n_{products} – n_{reactants}) = 1 – 2 = –1.\]
У разі реакції окислення азоту
\[N_2 + O_2 \rightleftharpoons 2 NO\]
Δ n g = 0 і зміна тиску не вплине на рівновагу.
Обсяги твердих речовин і рідин практично не впливають на тиск, тому для реакцій, в яких не беруть участь газоподібні речовини, наслідки змін тиску зазвичай незначні. Винятки виникають в умовах дуже високого тиску, таких як існують у надрах Землі або біля дна океану. Хорошим прикладом може служити розчинення карбонату кальцію
\[CaCO_{3(s)} \rightleftharpoons Ca^{2+} + CO_3^{2–}\]
Відбувається невелике зменшення обсягу, коли відбувається ця реакція, тому підвищення тиску змістить рівновагу вправо, в результаті чого карбонат кальцію стає більш розчинним при більш високих тисках.
Скелети декількох різновидів мікроскопічних організмів, які населяють вершину океану, складаються з CaCo 3, тому відбувається безперервний дощ цієї речовини до дна океану, коли ці організми гинуть. Як наслідок, дно Атлантичного океану покривається ковдрою з карбонату кальцію. Це не стосується Тихого океану, який глибше; як тільки скелети опускаються нижче певної глибини, більший тиск змушує їх розчинятися. Деякі підводні гори (підводні гори) в Тихому океані простягаються вище межі розчинності так, що їх верхні частини покриті відкладеннями CaCo 3.
Вплив тиску на реакцію за участю речовин, температура кипіння яких потрапляє в діапазон часто зустрічається температури, буде чутливим до станів цих речовин при цікавій температурі. Для реакцій, що включають гази, важливі лише зміни парціального тиску тих газів, які безпосередньо беруть участь у реакції; наявність інших газів не впливає.
Промислове виробництво водню здійснюється шляхом обробки природного газу парою при високих температурах і в присутності каталізатора («парового риформінгу метану»):
\[CH_4 + H_2O \rightleftharpoons CH_3OH + H_2 \nonumber\]
Враховуючи наступні точки кипіння: CH 4 (метан) = —161°C, H 2 O = 100° C, CH 3 ОН = 65°, H 2 = —253°C, прогнозують вплив збільшення загального тиску на цю рівновагу при 50°, 75° і 120°С.
Рішення
Обчисліть зміну молів газу для кожного процесу:
|
темп
|
рівняння
|
\(Δn_g\)
|
зрушення
|
|---|---|---|---|
|
50° |
СН 4 (г) + Н 2 О (л) → СН 3 ОН (л) + Н 2 (г) | 0 | жоден |
| 75° | СН 4 (г) + Н 2 О (л) → СН 3 ОН (г) + Н 2 (г) | +1 | вліво |
| 120° | СН 4 (г) + Н 2 О (г) → СН 3 ОН (г) + Н 2 (г) | 0 | жоден |
Процес Хабера і чому це важливо
Процес Хабера для синтезу аміаку заснований на екзотермічній реакції
N 2 (г) + 3 Н 2 (г) → 2 Н 3 (г) Δ H = —92 кДж/моль
Принцип Ле Шательє говорить нам, що для того, щоб максимально збільшити кількість продукту в реакційній суміші, його слід проводити при високому тиску і низькій температурі. Однак чим нижче температура, тим повільніше протікає реакція (це стосується практично всіх хімічних реакцій.) Поки вибір доводилося робити між низьким виходом аміаку швидко або високим виходом протягом тривалого періоду часу, ця реакція була нездійсненною економічно.
Азот доступний безкоштовно, будучи основним компонентом повітря, але міцний потрійний зв'язок в N 2 робить надзвичайно важким включення цього елемента до таких видів, як NO 3 - і NH 4 +, які служать відправними точками для широкого різноманітність азотовмісних сполук, які необхідні для сучасної промисловості. Ця конверсія відома як фіксація азоту, і оскільки азот є важливою поживною речовиною для рослин, сучасне інтенсивне сільське господарство повністю залежить від величезної кількості фіксованого азоту у вигляді добрив. Приблизно до 1900 року основним джерелом фіксованого азоту був NaNo 3, знайдений у великих родовищах у Південній Америці. Кілька хімічних процесів отримання сполук азоту були розроблені на початку 1900-х років, але вони виявилися занадто неефективними для задоволення зростаючого попиту.
Хоча прямий синтез аміаку з його елементів був відомий протягом деякого часу, вихід продукту виявився незначним. У 1905 році Фріц Хабер (1868-1934) почав вивчати цю реакцію, використовуючи мислення, ініційоване Ле Шательє та іншими, і новоспечену область термодинаміки, яка послужила основою цих принципів. Тільки з закону Ле Шательє очевидно, що ця екзотермічна реакція сприяє низькій температурі та високому тиску. Однак це було не так просто: швидкість будь-якої реакції збільшується з температурою, тому працюючи лише з температурою, можна вибрати між високим виходом продукту, досягнутим лише дуже повільно, або дуже низьким виходом швидко. Далі обладнання і високоміцних легованих сталей, необхідних для його побудови, не існувало в той час. Габер вирішив першу проблему, розробивши каталізатор, який би значно прискорив реакцію при більш низьких температурах.
Друга проблема, і розробка ефективного способу отримання водню, затримала б практичну реалізацію процесу до 1913 року, коли прийшов перший завод, заснований на процесі Хабер-Боша (як це більш правильно відомо, Карл Бош - людина, яка вирішила основні інженерні завдання) в експлуатацію. Терміни не могли бути кращими для Німеччини, оскільки ця країна збиралася вступити в Першу світову війну, а союзники встановили морську блокаду Південної Америки, відключивши поставки нітратів для німецької боєприпасної промисловості.
Завод Bosch експлуатував аміачний реактор при температурі 200 атм і 550° С, а пізніше, коли були розроблені більш міцні леговані сталі, тиск 800-1000 атм став поширеним явищем. Джерелом водню в сучасних установках зазвичай є природний газ, яким в основному є метан:
| СН 4 + Н 2 О → СО + 3 Н 2 | утворення синтез-газу з метану |
| СО + Н 2 О → СО 2 + Н 2 | реакція зсуву, проведена в риформері |
Процес Хабер-Боша вважається найважливішим хімічним синтезом, розробленим в 20 столітті. Окрім свого наукового значення як першого масштабного застосування законів хімічної рівноваги, він мав величезний економічний та соціальний вплив; без недорогого джерела фіксованого азоту інтенсивне рослинництво, необхідне для годування зростаючого населення світу, було б неможливим. Хабер був удостоєний Нобелівської премії 1918 року з хімії в знак визнання його творчості. Карл Бош, який удосконалив процес, отримав Нобелівську премію в 1931 році.
Принцип Ле Шательє в фізіології
Багато хімічних реакцій, що відбуваються в живих організмах, регулюються за принципом Ле Шательє.
Транспортування кисню кров'ю
Мало хто з них важливіші для теплокровних організмів, ніж ті, що стосуються аеробного дихання, при якому кисень транспортується до клітин, де він поєднується з глюкозою і метаболізується до вуглекислого газу, який потім рухається назад до легенів, з яких він вигнаний.
гемоглобін + O 2 оксигемоглобін
Парціальний тиск O 2 в повітрі становить 0,2 атм, достатній для того, щоб ці молекули були прийняті гемоглобіном (червоним пігментом крові), в якому він стає нещільно пов'язаним у комплексі, відомому як оксигемоглобін. На кінцях капілярів, які доставляють кров до тканин, концентрація O 2 знижується приблизно на 50% завдяки його споживанню клітинами. Це зміщує рівновагу вліво, вивільняючи кисень, щоб він міг розсіюватися в клітини.
Підтримка рН крові
Вуглекислий газ реагує з водою, утворюючи слабку кислоту H 2 CO 3, яка призведе до падіння рН крові до небезпечних рівнів, якщо його не було негайно видалено, оскільки він виводиться клітинами. Це досягається шляхом об'єднання його з карбонатним іоном через реакцію.
\[H_2CO_3 + CO_3^{2–} \rightleftharpoons 2 HCO_3^– \nonumber\]
яка змушена вправо високою локальною концентрацією CO 2 всередині тканин. Як тільки іони гідрокарбонату (бікарбонату) досягають легеневих тканин, де парціальний тиск CO 2 значно менший, реакція змінюється і СО 2 виганяється.
Отруєння чадним газом
Окис вуглецю, продукт неповного згоряння, який присутній в автомобільних вихлопних газах і сигаретному димі, зв'язується з гемоглобіном в 200 разів щільніше, ніж робить O 2. Це блокує поглинання та транспортування кисню, встановлюючи конкуруючу рівновагу.
O 2 -гемоглобін гемоглобін
 Co-гемо
Co-гемо
Повітря, що містить всього 0,1 відсотка чадного газу, може зв'язати близько половини місць зв'язування гемоглобіну, зменшуючи кількість O 2, що досягає тканин до смертельного рівня. Отруєння чадним газом лікують введенням чистого О 2, що сприяє зсуву вищевказаного рівноваги вліво. Це можна зробити ще більш ефективним, помістивши потерпілого в гіпербаричну камеру, в якій тиск О 2 можна зробити більше 1 атм.
