14.4: Застосування окислювально-відновних реакцій - вольтаїчні клітини
- Вивчіть частини вольтаїчної клітини.
- Поєднуйте половинні реакції для визначення напруги вольтаїчного елемента.
- Зрозумійте, як вольтаїчні елементи використовуються в якості акумуляторів.
Розглянемо цю окислювально-відновну реакцію:
Zn+Cu2+→Zn2++Cu
Якби ви змішували метал цинку та іони міді в контейнері, ця реакція протікала б сама собою; ми говоримо, що ця реакція спонтанна.
Припустимо, однак, ми встановили цю реакцію способом, зображеним на рис. 14.4.1 - Редокс-реакція, в якій дві половинні реакції фізично розділені. Іони цинку та цинку знаходяться на одній стороні системи, а іони міді та міді - на іншій стороні системи. Дві частини з'єднуються дротом.
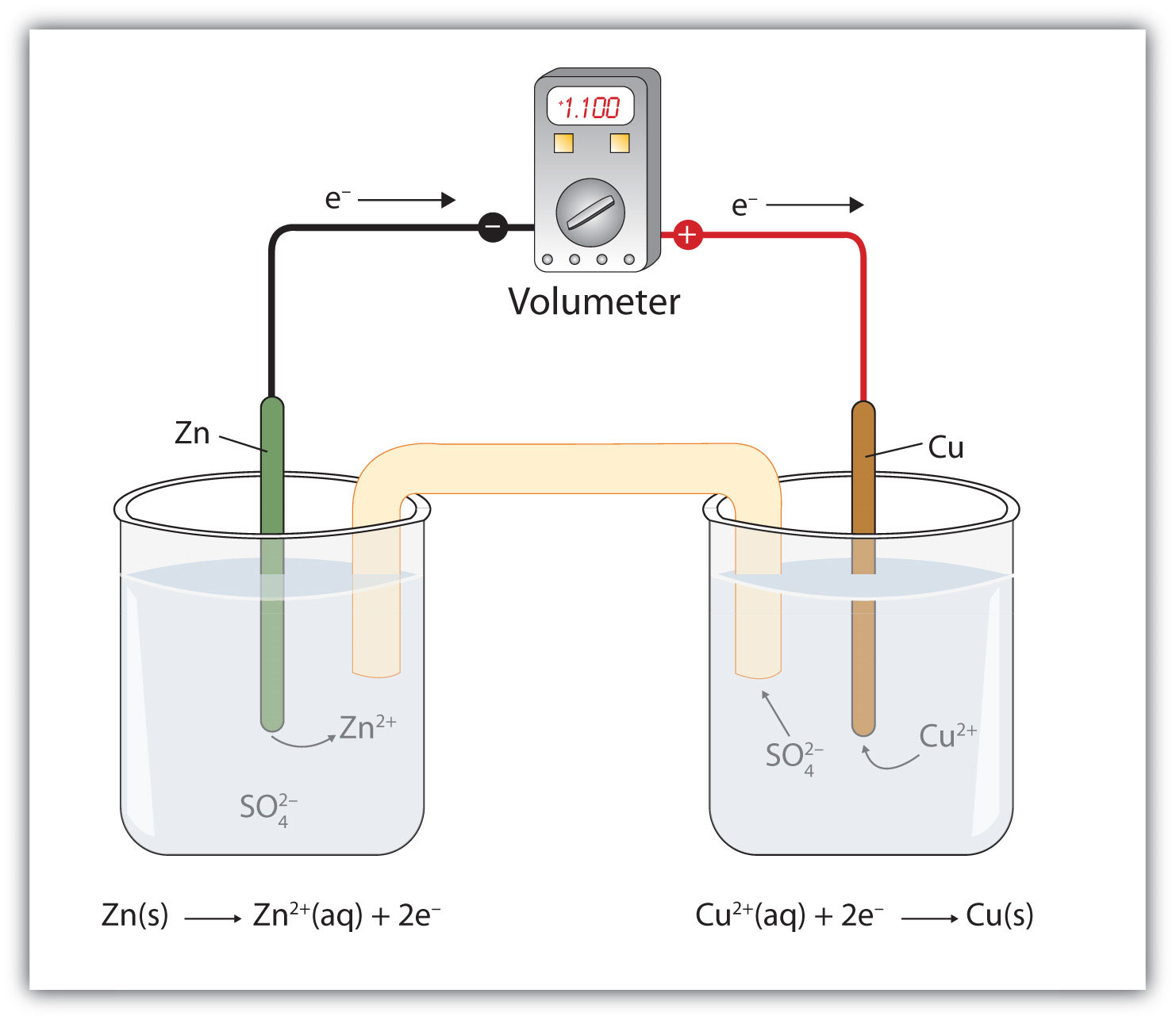
Незважаючи на те, що дві половинні реакції фізично розділені, спонтанна окислювально-відновна реакція все ще відбувається. Однак в цьому випадку електрони передаються через провід, що з'єднує дві половинні реакції; тобто ця установка стає джерелом електрики. Корисну роботу можна витягти з електронів у міру їх передачі з одного боку на інший. Наприклад, може горіти лампочка, а можна експлуатувати мотор. Апарат в цілому, що дозволяє витягти корисні електротехнічні роботи з окислювально-відновної реакції, називається вольтаїчним (гальванічним) елементом.
Кожна окрема система, яка містить половинну реакцію, називається половинкою клітини. Половина клітини, яка містить реакцію окислення, називається анодом, тоді як половина клітини, яка містить реакцію відновлення, називається катодом. Катод і анод в сукупності є електродами вольтаїчного елемента. Оскільки електрони надходять від анода, анод вважається негативним електродом осередку, тоді як катод вважається позитивним електродом осередку. Нарешті, оскільки електрони рухаються від однієї половини клітини до іншої, дисбаланс заряду накопичується в міру протікання реакції. Щоб протистояти цьому, використовується соляний міст; сольовий міст містить розчин деякої іонної сполуки, іони якої мігрують в обидві сторони від вольтаїчної клітини для підтримки балансу заряду.
Тенденція переходу електронів від однієї половини осередку до іншої називається напругою вольтаїчної осередку, представленої Е. Іноді термін потенціал використовується для представлення напруги комірки. Напруга виражається в вольтах (В). Напруга вольтаїчного елемента визначається різницею тенденцій окремих половинних осередків і характерно для даної окислювально-відновної реакції, коли концентрації специфічні (1,0 М для розчинених видів і 1,0 атм для газів). Оскільки напруга окислювально-відновної реакції визначається різницею тенденцій окремих половинних реакцій, абсолютні напруги є непотрібними; потрібні лише відносні напруги кожної половини реакції. Відносна напруга кожної половини осередку представлено як E 1/2 і базується на стандарті, що E 1/2 для реакції
H++e−→12H2
призначається рівно 0,000 В при стандартних умовах тиску і концентрації. Таблиця14.4.1 - Стандартні потенціали відновлення напівреакцій, перераховані деякі відносні значення E 1/2 для деяких половинних реакцій. Зверніть увагу, що всі половинні реакції перераховані як реакції відновлення, тому ці значення називаються стандартними потенціалами відновлення кожної половини реакції.
| Зменшення половини реакції | Е 1/2 (В) |
|---|---|
| Ф 2 + 2е − → 2Ф − | 2.87 |
| Се 4 + е − → Се 3 + | 1.61 |
| МпН 4 − + 8 ч + 5е − → Мн 2 + 4Н 2 О | 1.51 |
| Сл 2 + 2е − → 2Сл − | 1.36 |
| О 2 + 4Н + 4е − → 2Н 2 О | 1.23 |
| Бр 2 + 2е − → 2Бр − | 1.06 |
| НІ 3 − + 4H + 3e − → НІ + 2H 2 О | 0,96 |
| Ag + e − → Ag | 0,80 |
| Фе 3 + е − → Фе 2 + | 0,77 |
| Я 2 + 2е − → 2І − | 0,54 |
| Куб 2 + 2е − → Куб | 0,34 |
| AgCl + е − → Аг + Кл − | 0,222 |
| Сн 4 + 2е − → Сн 2 + | 0,15 |
| 2Н + 2е − → Н 2 | 0.000 |
| Пб 2 + 2е − → Пб | −0.126 |
| Ni 2 + 2e − → Ni | −0,25 |
| Кр 3 + е − → Кр 2 + | −0.41 |
| Фе 2 + 2е − → Фе | −0.44 |
| Кр 3 + 3е − → Кр | −0.74 |
| Зн 2 + 2е − → Zn | −0,76 |
| Кр 2 + 2е − → Кр | −0.91 |
| Ба 2 + 2е − → Ба | −1.57 |
| Всі 3 + 3е − → Аль | −1.66 |
| Мг 2 + 2е − → Мг | −2.37 |
| Na + e − → Na | −2.714 |
| Li + e − → Лі | −3.045 |
Таблиця14.4.1 Стандартні потенціали скорочення половинних реакцій
У наведеній вище таблиці перераховані тільки реакції відновлення, але окислювально-відновна реакція має відновлення і окислення. Щоб здійснити реакцію окислення, просто поверніть реакцію відновлення у наведеній вище таблиці та змініть знак на значення E 1/2. Якщо потенціал відновлення негативний, зробіть напругу для окислення позитивним; якщо потенціал відновлення позитивний, зробіть напругу для окислення негативним.
Яке значення Е 1/2 для цієї половинної реакції?
Аг + Сл − → AgCl + е −Рішення
Дана реакція є зворотною цією реакцією:
AgCl + е − → Аг + Кл − Е 1/2 = 0,222 ВОтже, Е 1/2 даної реакції становить −0,222 В.
Яке значення Е 1/2 для цієї половинної реакції?
Na → Na + е −Відповідь
2.714 Г
Щоб визначити загальну напругу конкретного вольтаїчного елемента, просто об'єднайте напруги окислювальної і відновної напівреакцій. Навіть якщо вам потрібно взяти кратну половині реакції для скасування електронів, не приймайте кратну E 1/2. Використовуйте значення безпосередньо, як є з таблиці14.4.1 - Стандартні потенціали скорочення половинних реакцій.
Спонтанні окислювально-відновні реакції мають позитивні загальні напруги. Якщо напруга реакції, як написано, негативне, воно не є спонтанним в цьому напрямку. Швидше, зворотна реакція - це спонтанна окислювально-відновна реакція.
Яке напруга вольтаїчного елемента, заснованого на цій реакції? Чи є реакція спонтанною, як написано?
2НО 3 − + 8H + 3Cu → 2НО + 4Н 2 О + 3Cu 2 +Рішення
Загальна окислювально-відновна реакція формується з цих двох половинних реакцій:
НІ 3 − + 4Н + + 3е − → НІ + 2Н 2 О Е 1/2 = 0,96 ВCu 2 + 2 е − → Куб Е 1/2 = 0,34 ВДруга реакція зворотна в загальній окислювально-відновної реакції, тому її напруга змінюється знаком від реакції відновлення:
Cu → Су 2 + 2 е − Е 1/2 = −0,34 ВЩоб отримати напругу вольтаїчної комірки на основі загальної реакції, ми просто об'єднаємо дві напруги половинних реакцій:
Е = 0,96 + (−0,34) = 0,62 ВОскільки загальна напруга позитивна, реакція спонтанна, як написано.
Яке напруга вольтаїчного елемента, заснованого на цій реакції? Чи є реакція спонтанною, як написано?
5Н+2МН 4 − + 16Н + → 3Мн 2 + 8H 2 О +5Нi 2 +Відповідь
1.76 В; спонтанний
Технічно будь-яка окислювально-відновна реакція може бути створена для створення вольтаїчної клітини. Однак у сучасному суспільстві лише певні окислювально-відновні реакції застосовуються на практиці. Портативний вольтаїчний елемент, який виробляє електроенергію для живлення пристроїв для нашої зручності, називається акумулятором. Всі акумулятори засновані на окислювально-відновних реакціях.
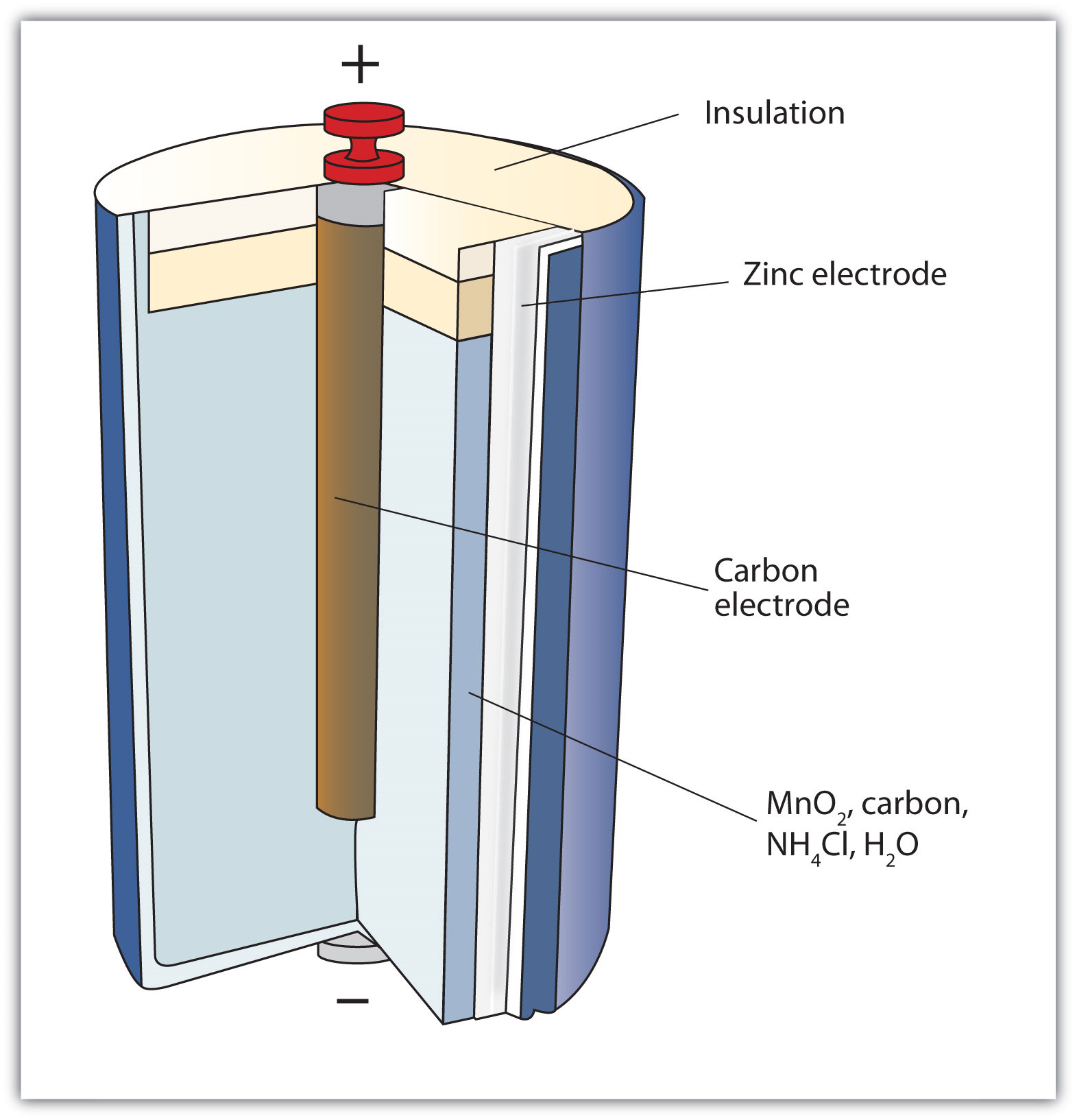
Перша батарея (звана «вольтовою палею») була побудована італійським вченим Алессандро Вольта в 1800 році і була заснована на реакції міді/цинку, зображеної на малюнку14.4.1 - окислювально-відновна реакція, в якій дві половинні реакції фізично відокремлені. На жаль, це було безладно, вимагаючи кількості солей міді та цинку, розчинених у воді. У 1866 році французький вчений Жорж Лекланше винайшов сухий елемент, попередник сучасної сучасної батареї. Схема сухопарника показана на малюнку14.4.2 - Dry Cell. Цинковий корпус і центральний вугільний стрижень служать анодом і катодом відповідно. Інші реагенти об'єднані у вологу пасту, яка мінімізує вільну рідину, тому акумулятор менш брудний (звідси і назва сухої клітини).
Фактична окислювально-відновна реакція є складною, але може бути представлена наступною окислювально-відновною реакцією:
Зн + 2МН 2 + 2НН 4 + → Зн 2 + Мн 2 О 3 + 2НН 3 + Н 2 О
Сухий елемент має напругу близько 1,56 В. Хоча звичайні і корисні, сухі клітини мають відносно короткий термін служби і містять кислі компоненти. Їх також не можна заряджати, тому вони є лише одноразовими. Батареї, які можна використовувати тільки один раз, називаються первинними батареями.
Наприкінці 1950-х років Льюїс Уррі з компанії Eveready Battery Company в Огайо винайшов лужну батарею (все ще продається сьогодні під торговою назвою Energizer). Лужні батареї схожі на сухі клітини, але в них використовується основна волога паста, а не кислотна. Більш того, чиста кількість бази не змінюється в ході окислювально-відновної реакції. Загальна окислювально-відновна реакція така:
Зн + 2МН 2 → ZnO + Мн 2 О 3
Лужні батареї мають перевагу в тому, що вони довговічні і краще утримують свою напругу - близько 1,54 В - протягом усього терміну служби.
Поширеним видом акумуляторів, особливо при підвищеній популярності персональних електронних пристроїв, є кнопковий акумулятор (рис.14.4.3 - Button Battery). Кнопковий акумулятор - це невелика батарея, яка може живити невеликі електронні пристрої; батареї можуть бути лише 5 мм в поперечнику. Дві популярні окислювально-відновні реакції, що використовуються для кнопочних батарей, - це лужна реакція сухих клітин та реакція на основі оксиду срібла:
Зн + Аг 2 О → Зно + 2Аг
Деякі кнопкові батареї використовують окислювально-відновну реакцію на основі літію, характерну для цієї анодної реакції:
Лі → Лі + е − Е 1/2 = 3,045 В
Фактична окислювально-відновна реакція залежить від складу катода і є змінною в залежності від напруги. Літієві батареї також можна використовувати для додатків, які вимагають більше енергії, таких як портативні комп'ютери та електромобілі. Деякі батареї на основі літію перезаряджаються і можуть використовуватися знову і знову; такі батареї називаються вторинними батареями.
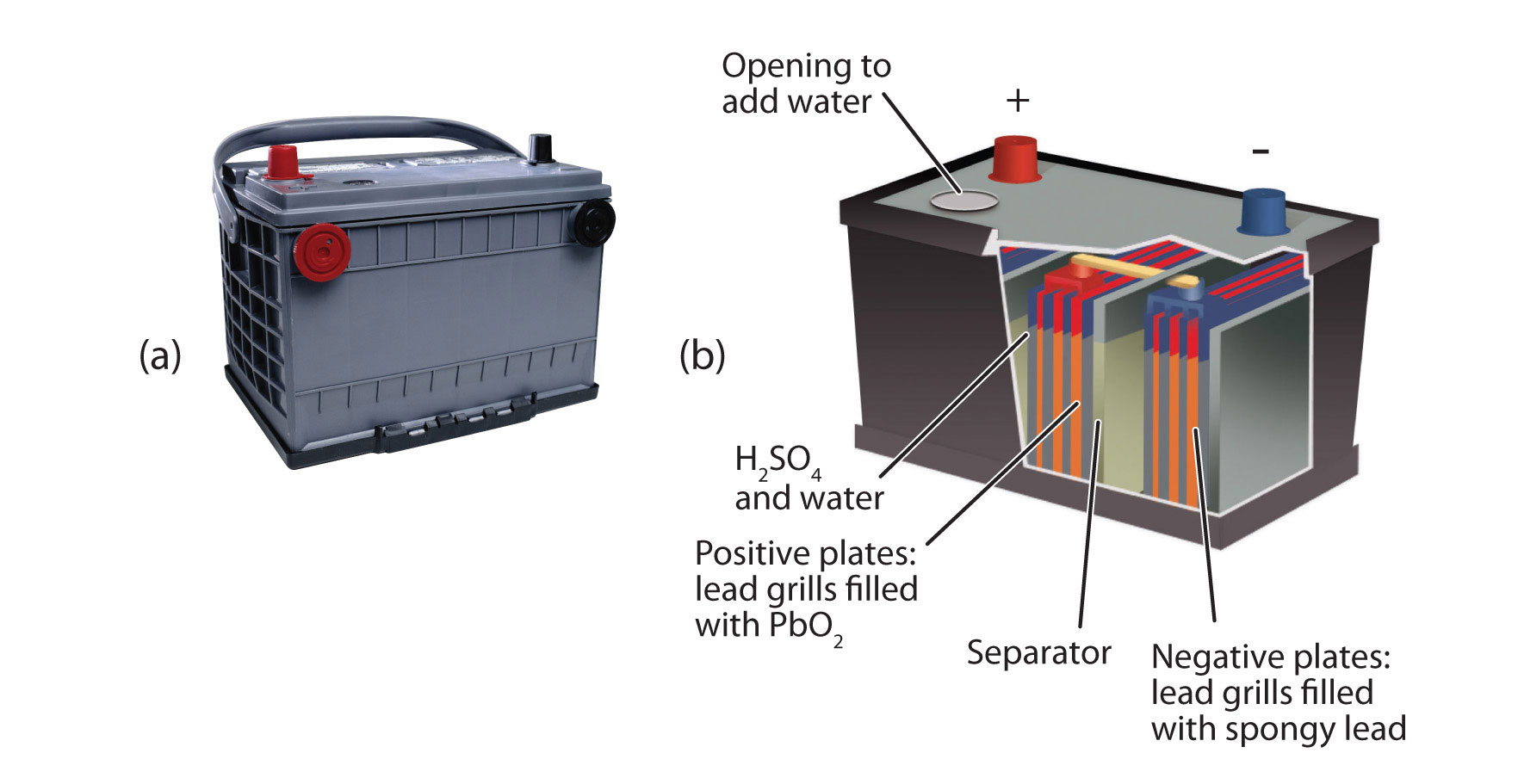
Важливим вторинним акумулятором є свинцева акумуляторна батарея, показана на малюнку14.4.4 - свинцеві акумуляторні батареї. Свинцева акумуляторна батарея заснована на цій окислювально-відновній реакції:
Пб + ПБО 2 + 4Н + СО 4 2 − → 2ПБСО 4 + 2Н 2 О
Окислювально-відновна реакція виробляє близько 2 В, але типово зв'язати кілька окремих батарей разом, щоб генерувати більшу напругу. Свинцева акумуляторна батарея має відмінність, що продуктом обох половинних реакцій є PbSO 4, який як тверда речовина, яка накопичується на багатьох пластин всередині кожної клітини. Свинцева акумуляторна батарея є вторинною батареєю, оскільки її можна багато разів заряджати та використовувати повторно. Оскільки в його основі лежить свинець, ці батареї досить важкі. Їх також слід переробляти при заміні, щоб потенційно небезпечний свинець не виходив у навколишнє середовище. Через свої характеристики свинцеві акумуляторні батареї використовуються для запуску великих двигунів в автомобілі, човни та літаки.
Паливний елемент - це тип батареї, в якій реагенти безперервно надходять у спеціалізовану реакційну камеру, і продукти витікають безперервно, поки електрони витягуються з реакції. Оскільки всі реакції в паливному елементі складаються з палива та окислювача, що проходять окислювально-відновну реакцію, введення паливних елементів знаходиться вдома в обговоренні окислювально-відновної хімії.
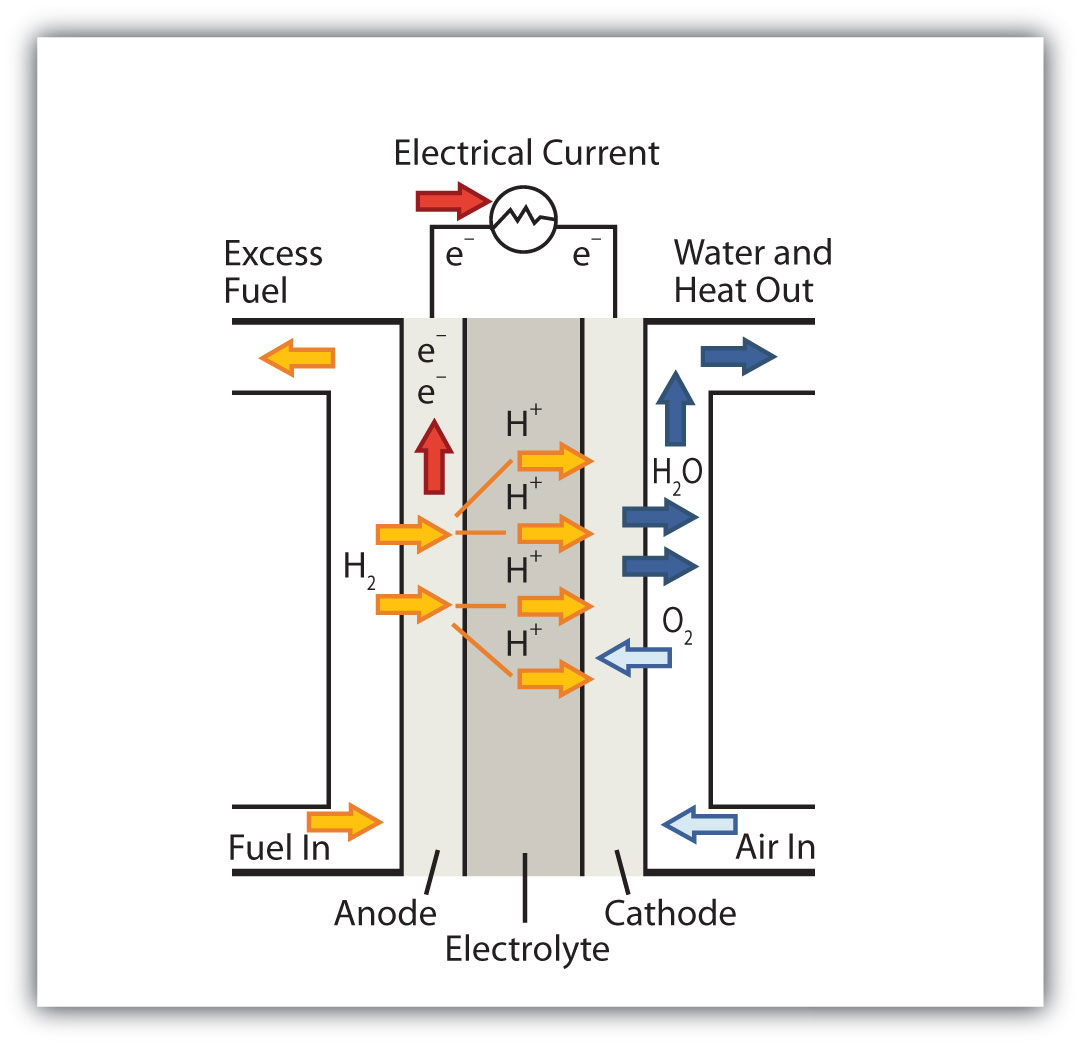
На сьогоднішній день найбільш поширена реакція паливних елементів заснована на водні і кисні:
2Н 2 + О 2 → 2Н 2 О Е = 1,23 В при стандартних умовах
Однак паливні елементи, як правило, не працюють ні в стандартних, ні навіть оптимальних умовах, тому вони зазвичай генерують близько 0,6-0,7 В. У цьому паливному елементі єдиними двома продуктами є вода та електроенергія, тому паливний елемент не тільки не створює забруднення, але й робить побічний продукт, який у деяких середовищах є цінний товар (вода). Крім водню можна використовувати інші види палива; були розроблені паливні елементи, які працюють на метані, метиловому спирті, етиловому спирті, багатих вуглецем матеріалах і навіть металі магнію.
Паливні елементи на основі водню були і використовуються для забезпечення електрикою пілотованих космічних апаратів, почасти тому, що їх єдиним хімічним продуктом є вода, яку можна було б використовувати для пиття. Однак останнім часом спостерігається відродження інтересу до паливних елементів через їх потенційне використання в електромобілів. Більшість електромобілів працюють на звичайних акумуляторах, які можуть бути дуже важкими і дорогими для заміни. Вважається, що паливні елементи, а не звичайні батареї, можуть бути кращими джерелами електроенергії для автомобілів.
Кілька сучасних бар'єрів для використання паливних елементів в електромобілів включають потужність, вартість та загальну енергоефективність. 2008 Honda FCX, перша виробнича модель автомобіля, що працює з паливним елементом, може вмістити 4,1 кг (трохи менше 9 фунтів) газу високого тиску H 2 і має діапазон 450 км (280 миль). Це коштує близько $120,000—$140 000, щоб побудувати, що робить транспортний засіб поза здатністю більшості людей володіти. Нарешті, для отримання елементарного водню як палива завжди потрібно більше енергії, ніж можна витягти з водню як палива. Таким чином, водень описується як енергоносій (як електроенергія), а не джерело енергії (наприклад, нафта і газ). Ця відмінність вказує на фундаментальний аргумент проти паливних елементів як «кращого» джерела живлення.

2008 Honda FCX був першим серійним автомобілем, який використовував паливний елемент як джерело живлення. Тим не менш, автомобіль знаходиться в дуже обмеженому обслуговуванні через його необхідність у відносно великій кількості елементарного водню як палива.
Незважаючи на обмеження, існує великий інтерес до досліджень паливних елементів. Якщо можна знайти способи обійти їх поточні обмеження, паливні елементи можуть ставати все більш поширеними як джерела живлення.
Ключові виноси
- Вольтаїчна клітина виробляє електрику, коли відбувається окислювально-відновна реакція.
- Напруга вольтаїчного елемента можна визначити за відновними потенціалами половинних реакцій.
- Вольтаїчні елементи формуються в батареї, які є зручним джерелом електрики.
