17.2: Гальванічні елементи
- Page ID
- 22481
- Використовуйте позначення комірок для опису гальванічних елементів
- Опишіть основні складові гальванічних елементів
Гальванічні елементи, також відомі як вольтаїчні елементи, є електрохімічними елементами, в яких спонтанні окислювально-відновні реакції виробляють електричну енергію. При написанні рівнянь часто зручно розділяти окислювально-відновні реакції на напівреакції, щоб полегшити збалансування загального рівняння та підкреслити фактичні хімічні перетворення.
Розглянемо, що відбувається, коли чистий шматок мідного металу поміщають в розчин нітрату срібла (рис.\(\PageIndex{1}\)). Як тільки додається метал міді, починає утворюватися метал срібла і іони міді переходять в розчин. Синій колір розчину в крайньому правому куті свідчить про наявність іонів міді. Реакція може бути розщеплена на дві її напівреакції. Напівреакції відокремлюють окислення від відновлення, тому кожну можна розглядати індивідуально.
\ [\ почати {вирівняти}
&\ textrm {окислення:}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ підкреслення {\ textrm {скорочення:} 2 × (\ ce {Ag+} (q) +\ ce {e-} ⟶\ ce {Ag} (s)\ hspace {40px}\ ce {або}\ hspace {40px}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (и)}\\
&\ textrm {загальний:}\ ce {2Ag+} (q) +\ ce {Cu} (s) ⟶\ ce {2Ag} (и) +\ ce {Cu^2+} (q)
\ кінець {вирівняти}\ номер\]
Рівняння відновної напівреакції довелося подвоїти, тому число електронів, «отриманих» у відновній напівреакції, дорівнювало кількості електронів, «втрачених» у напівреакції окислення.

Гальванічні або вольтаїчні елементи включають спонтанні електрохімічні реакції, в яких напівреакції розділені (рис.\(\PageIndex{2}\)), щоб струм міг протікати через зовнішній провід. Стакан з лівого боку фігури називається полуосередковий, і містить 1 М розчин нітрату міді (II) [Cu (NO 3) 2] з частково зануреним в розчин шматком мідного металу. Мідний метал - це електрод. Мідь піддається окисленню; отже, мідний електрод є анодом. Анод з'єднується з вольтметром проводом, а інша клема вольтметра з'єднується з срібним електродом дротом. Срібло піддається відновленню; отже, срібний електрод є катодом. Полукомірка з правого боку фігури складається з срібного електрода в 1 М розчині нітрату срібла (AgNO 3). У цей момент струм не протікає - тобто не відбувається значного руху електронів через дріт, оскільки ланцюг розімкнутий. Ланцюг замикається за допомогою соляного містка, який передає струм з рухомими іонами. Сольовий міст складається з концентрованого, нереактивного розчину електроліту, такого як розчин нітрату натрію (NaNO 3), який використовується в цьому прикладі. Коли електрони протікають зліва направо через електрод і дріт, нітратні іони (аніони) проходять через пористу пробку зліва в розчин нітрату міді (II). Це тримає склянку зліва електрично нейтральною, нейтралізуючи заряд на іоні міді (II), які утворюються в розчині, коли метал міді окислюється. При цьому нітратні іони рухаються вліво, іони натрію (катіони) рухаються вправо, через пористу пробку, і в розчин нітрату срібла справа. Ці додані катіони «замінюють» іони срібла, які видаляються з розчину, оскільки вони були відновлені до срібного металу, зберігаючи склянку праворуч електрично нейтральною. Без соляного містка відсіки не залишалися б електрично нейтральними і не протікав би значний струм. Однак якщо два відсіки знаходяться в безпосередньому контакті, соляний міст не потрібен. Моментально схема завершена, вольтметр зчитує +0,46 В, це називається потенціалом осередку. Потенціал клітини створюється при з'єднанні двох різнорідних металів і є мірою енергії на одиницю заряду, доступної в результаті реакції окислення-відновлення. Вольт - це похідна одиниця СІ для електричного потенціалу
\[\mathrm{volt=\mathit{V}=\dfrac{J}{C}} \nonumber \]
У цьому рівнянні А - струм в амперах і С - заряд в кулоні. Зверніть увагу, що вольти потрібно помножити на заряд в кулоні (С), щоб отримати енергію в джоулі (J).
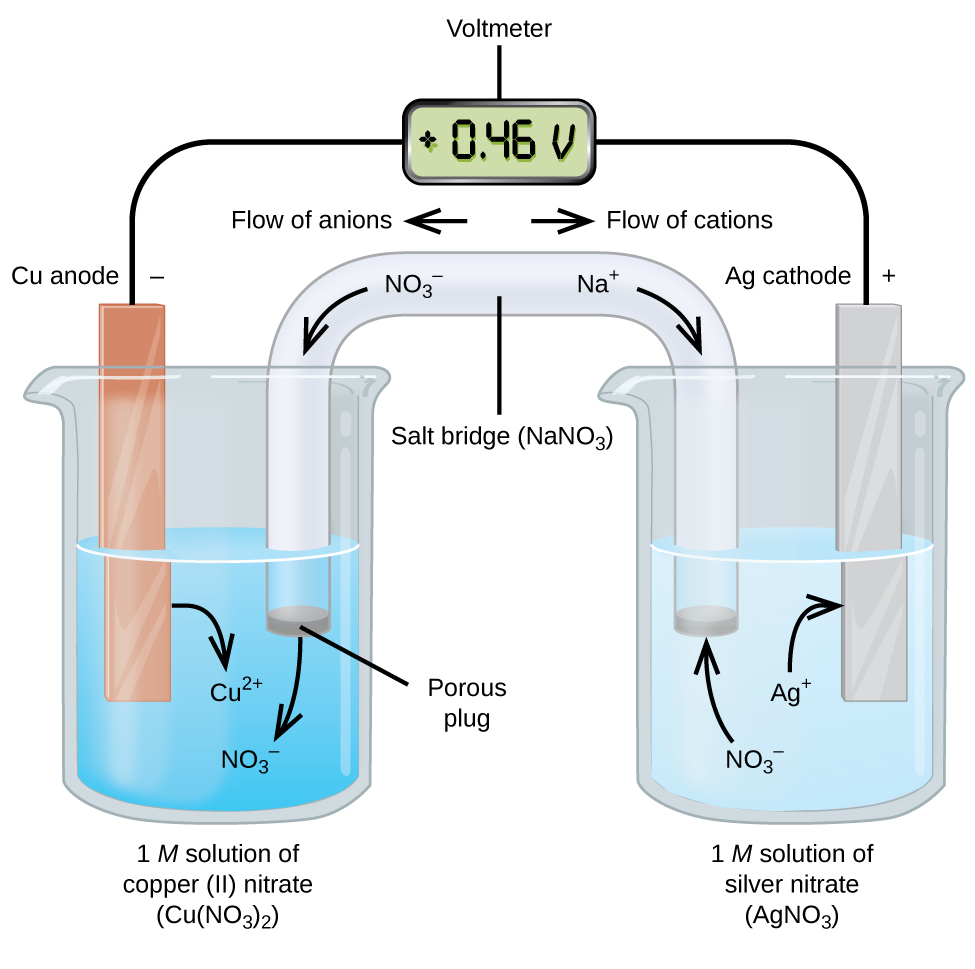
Коли електрохімічна комірка побудована таким чином, позитивний потенціал клітини вказує на спонтанну реакцію і що електрони течуть зліва направо. На малюнку багато чого відбувається\(\PageIndex{2}\), тому корисно підсумувати речі для цієї системи:
- Електрони течуть від анода до катода: зліва направо в стандартному гальванічному елементі на малюнку.
- Електрод в лівій половині клітини є анодом, тому що тут відбувається окислення. Назва відноситься до потоку аніонів в соляному мосту до нього.
- Електрод в правій половині комірки є катодом, тому що тут відбувається зменшення. Назва відноситься до потоку катіонів в соляному мосту до нього.
- Окислення відбувається у анода (ліва половина осередку на малюнку).
- Зменшення відбувається у катода (права половина осередку на малюнку).
- Потенціал клітини, +0,46 В, в цьому випадку є результатом властивих відмінностей у природі матеріалів, використовуваних для виготовлення двох напівклітин.
- Соляний міст повинен бути присутнім, щоб закрити (завершити) ланцюг, і для протікання струму повинні відбуватися як окислення, так і відновлення.
Існує багато можливих гальванічних елементів, тому для їх опису зазвичай використовується стенографічне позначення. Позначення клітин (іноді її називають клітинною діаграмою) дає інформацію про різні види, які беруть участь в реакції. Це позначення працює і для інших типів клітин. Вертикальна лінія, │, позначає межу фази і подвійну лінію,, соляний міст. Зліва записується інформація про аноді, далі йде анодний розчин, потім сольовий міст (коли він присутній), потім катодний розчин, і, нарешті, інформація про катоді праворуч. Позначення комірки для гальванічного елемента на малюнку\(\PageIndex{2}\)
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Зверніть увагу, що глядачі іони не включені і що була використана найпростіша форма кожної напівреакції. Коли відомо, початкові концентрації різних іонів зазвичай включаються.
Однією з найпростіших клітин є клітина Деніелла. Спорудити цю батарею можна, помістивши на дно банки мідний електрод і накривши метал розчином мідного купоросу. Зверху розчину мідного купоросу плавають розчин сульфату цинку, потім в розчин сульфату цинку поміщають цинковий електрод. Підключення мідного електрода до цинкового електрода дозволяє протікати електричний струм. Це приклад клітини без соляного містка, і іони можуть протікати через інтерфейс між двома розчинами.
Деякі окислювально-відновні реакції включають види, які є поганими провідниками електрики, і тому використовується електрод, який не бере участі в реакціях. Часто електродом є платина, золото або графіт, всі вони інертні до багатьох хімічних реакцій. Одна з таких систем показана на рис\(\PageIndex{3}\). Магній піддається окисленню на аноді зліва на малюнку, а іони водню піддаються відновленню на катоді праворуч. Реакція може бути узагальнена як
\ [\ почати {вирівняти}
&\ textrm {окислення:}\ ce {Mg} (s) ⟶\ ce {Mg^2+} (q) +\ ce {2e-}\\
&\ textrm {скорочення:}\ ce {2H+} (q) +\ ce {2e-} ⟶\ ce {H2} (г)\\
&\ overline {\ textrm {загальний:}\ ce {Мг} (s) +\ ce {2H+} (aq) ⟶\ ce {Мг^2+} (aq) +\ ce {H2} (г)}
\ кінець {вирівнювання}\ nonumber\]
У осередку використовувався інертний платиновий провід для катода, тому позначення осередків
\[\ce{Mg}(s)│\ce{Mg^2+}(aq)║\ce{H+}(aq)│\ce{H2}(g)│\ce{Pt}(s) \nonumber \]
Магнієвий електрод є активним електродом, оскільки він бере участь в окислювально-відновній реакції. Інертні електроди, як і платиновий електрод на малюнку\(\PageIndex{3}\), не беруть участі в окислювально-відновній реакції і присутні так, що струм може протікати через осередок. Платина або золото зазвичай роблять хороші інертні електроди, оскільки вони хімічно не реагують.

Розглянемо гальванічний елемент, що складається з
\[\ce{2Cr}(s)+\ce{3Cu^2+}(aq)⟶\ce{2Cr^3+}(aq)+\ce{3Cu}(s) \nonumber \]
Запишіть напівреакції окислення та відновлення і запишіть реакцію за допомогою клітинних позначень. Яка реакція відбувається на аноді? Катод?
Рішення
При огляді Cr окислюється, коли три електрони втрачаються, утворюючи Cr 3 +, і Cu 2 + зменшується, коли він отримує два електрони для утворення Cu. Балансування заряду дає
\ [\ почати {вирівняти}
&\ textrm {окислення:}\ ce {2Cr} (и) ⟶\ ce {2Cr^3+} (aq) +\ ce {6e-}\\
&\ textrm {скорочення:}\ ce {3Cu^2+} (q) +\ ce {6e-} ⟶\ ce {3Cu} (s)\\
&\\ overline\ текст {загальний:}\ ce {2Cr} (и) +\ ce {3Cu ^ 2+} (aq) ⟶\ ce {2Cr^3+} (aq) +\ ce {3Cu} (и)}
\ кінець {вирівнювання}\ номер\]
Позначення осередків використовує найпростішу форму кожного з рівнянь, і починається з реакції на аноді. Ніяких концентрацій не було вказано так:
\[\ce{Cr}(s)│\ce{Cr^3+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s). \nonumber \]
Окислення відбувається на аноді і відновлення на катоді.
Розглянемо гальванічний елемент, що складається з
\[\ce{5Fe^2+}(aq)+\ce{MnO4-}(aq)+\ce{8H+}(aq)⟶\ce{5Fe^3+}(aq)+\ce{Mn^2+}(aq)+\ce{4H2O}(l) \nonumber \]
Запишіть напівреакції окислення та відновлення і запишіть реакцію за допомогою клітинних позначень. Яка реакція відбувається на аноді? Катод?
Рішення
При огляді Fe 2 + піддається окисленню, коли один електрон втрачається з утворенням Fe 3 +, а MnO 4 - зменшується, коли він отримує п'ять електронів, утворюючи Mn 2 +. Балансування заряду дає
\ [\ почати {вирівняти}
&\ textrm {окислення:} 5 (\ ce {Fe^2+} (aq) ⟶\ ce {Fe^3+} (aq) +\ ce {e-})\\
&\ підкреслення {\ textrm {скорочення:}\ ce {MnO4-} (q) +\ ce {8H+} (q) +\ ce {5e}\ ce {Mn^2+} (q) +\ ce {4H2O} (л)}\\
&\ textrm {загальний:}\ ce {5Fe^2+} (ак) +\ ce {МnO4-} (ак) +\ ce {8H+} (q) ⟶\ ce {5Fe^3+} (aq ) +\ ce {Mn^2+} (q) +\ ce {4H2O} (л)
\ кінець {вирівняти}\ nonumber\]
Позначення осередків використовує найпростішу форму кожного з рівнянь, і починається з реакції на аноді. Необхідно використовувати інертний електрод, такий як платина, оскільки немає металу для проведення електронів від анода до катода. Ніяких концентрацій не було вказано так:
\[\ce{Pt}(s)│\ce{Fe^2+}(aq),\: \ce{Fe^3+}(aq)║\ce{MnO4-}(aq),\: \ce{H+}(aq),\: \ce{Mn^2+}(aq)│\ce{Pt}(s). \nonumber \]
Окислення відбувається на аноді і відновлення на катоді.
Використовуйте позначення комірок для опису гальванічного елемента, де іони міді (II) відновлюються до металу міді, а метал цинку окислюється до іонів цинку.
- Відповідь
-
З інформації, наведеної в задачі:
\ [\ почати {вирівняти}
&\ textrm {анод (окислення):}\ ce {Zn} (s) ⟶\ ce {Zn^2+} (aq) +\ ce {2e-}\
\\ textrm {катод (зменшення):}\ ce {Cu^2+} (q) +\ ce {2e-} ⟶\ ce {Cu} (с)\\\
& накладання {\ textrm {загальний:}\ ce {Zn} (и) +\ ce {Cu^2+} (aq) ⟶\ ce {Zn^2+} (aq) +\ ce {Cu} (s)}
\ end {вирівняти}\ nonumber\]Використання позначення осередків:
\[\ce{Zn}(s)│\ce{Zn^2+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s) \nonumber. \nonumber \]
Резюме
Електрохімічні клітини зазвичай складаються з двох напівклітин. Напівклітини відокремлюють напівреакцію окислення від відновної напівреакції і дають можливість струму протікати через зовнішній провід. Одна напівклітина, зазвичай зображена з лівого боку на малюнку, містить анод. Окислення відбувається на аноді. Анод підключений до катода в іншій половині комірки, часто показаний з правого боку на малюнку. Зменшення відбувається на катоді. Додавання соляного моста завершує ланцюг, що дозволяє протікати струм. Аніони в соляному мосту течуть до анода, а катіони в соляному мосту течуть до катода. Рух цих іонів завершує ланцюг і тримає кожен напівелемент електрично нейтральним. Електрохімічні клітини можуть бути описані за допомогою позначення осередків. У цьому позначенні зліва з'являється інформація про реакцію на аноді і інформація про реакцію у катода справа. Соляний міст представлений подвійною лінією, Тверда, рідка або водна фази в межах половини клітини розділені однією лінією, │. Фаза і концентрація різних видів включаються після назви виду. Електроди, які беруть участь в окислювально-відновній реакції, називаються активними електродами. Електроди, які не беруть участі в окислювально-відновній реакції, але знаходяться там, щоб пропускати струм, - це інертні електроди. Інертні електроди часто виготовляють з платини або золота, які незмінні багатьма хімічними реакціями.
Глосарій
- активний електрод
- електрод, який бере участь в окисно-відновній реакції електрохімічної клітини; маса активного електрода змінюється в ході окислювально-відновної реакції
- анод
- електрод в електрохімічній комірці, при якій відбувається окислення; інформація про аноді записується з лівого боку соляного містка в позначеннях осередків
- катод
- електрод в електрохімічній комірці, при якій відбувається відновлення; інформація про катод записується з правого боку соляного моста в позначеннях осередків
- позначення осередків
- стенографічний спосіб представлення реакцій в електрохімічній клітині
- клітинний потенціал
- різниця електричного потенціалу, що виникає при з'єднанні різнорідних металів; рушійна сила протікання заряду (струму) в окисно-відновних реакціях
- гальванічний елемент
- електрохімічна клітина, яка включає спонтанну окислювально-відновну реакцію; електрохімічні клітини з позитивними потенціалами клітин; також називається вольтаїчною клітиною
- інертний електрод
- електрод, який пропускає струм, але який інакше не бере участі в окислювально-відновній реакції в електрохімічній комірці; маса інертного електрода не змінюється під час окислювально-відновної реакції; інертні електроди часто виготовляються з платини або золота, оскільки ці метали хімічно нереактивний.
- вольтаїчна комірка
- інша назва гальванічного елемента
