14.5: Електроліз
- Page ID
- 22452
- Опишіть електроліз з точки зору окислювально-відновних реакцій.
- Наведіть приклади застосування електролізу.
До цього моменту ми розглядали окислювально-відновні реакції на процеси, які є спонтанними. При налаштуванні в якості вольтаїчного елемента або акумулятора такі реакції можуть використовуватися як джерело електрики. Однак можна піти і в іншому напрямку. Примушуючи електрику в клітину, ми можемо зробити окислювально-відновну реакцію, яка зазвичай не була б спонтанною. За цих обставин осередок називається електролітичним елементом, а процес, який відбувається в комірці, називається електролізом (рис.\(\PageIndex{1}\)).
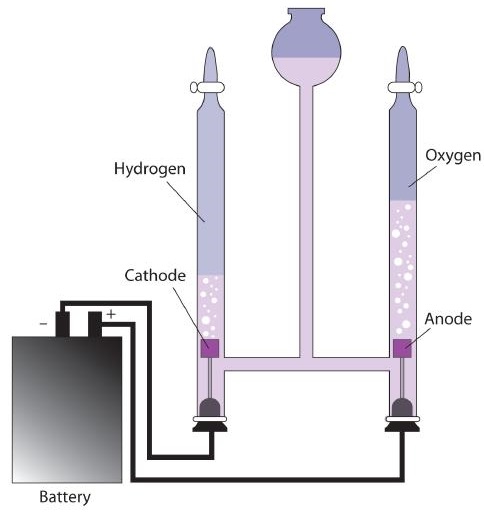
Електроліз має безліч застосувань. Наприклад, якщо NaCl розплавляється при температурі близько 800° C в електролітичній комірці і через неї пропускається електричний струм, на катоді з'явиться елементарний натрій, а елементний хлор з'явиться на аноді, коли відбуваються наступні дві реакції:
\[Na^+ + e^− \rightarrow Na\nonumber \]
\[2 Cl^− → Cl_2 + 2e^−\nonumber \]
Зазвичай ми очікуємо, що елементарний натрій і хлор реагують спонтанно, щоб зробити NaCl. Однак, використовуючи вхід електроенергії, ми можемо змусити протилежну реакцію відбутися і генерувати елементи. Літій, калій і магній також можуть бути виділені із сполук електролізом.
Ще один елемент, який виділяється електролізом - алюміній. Алюміній раніше був важким металом для ізоляції в його елементарній формі; насправді, у верхній частині пам'ятника Вашингтону є кришка з алюмінієвого металу 2,8 кг, який на той час (1884) був найбільшим шматочком елементарного алюмінію, коли-небудь ізольованим. Однак в 1886 році американець Чарльз Холл і француз Поль Еруль майже одночасно відпрацювали електролітичний процес виділення алюмінію з бокситів - руди алюмінію, хімічна формула якої становить AlO x (OH) 3 − 2 х. Основні реакції полягають в наступному:
\[Al^{3+} + 3e^− \rightarrow Al_2O^{2−} \rightarrow O_2 + 4e^−\nonumber \]
З розвитком процесу Hall-Héroult ціна на алюміній знизилася в рази понад 200, і алюмінієвий метал став поширеним явищем. У Сполучених Штатах щороку виробляється стільки елементарного алюмінію, що було підраховано, що електроліз алюмінію використовує 5% всієї електроенергії в країні. (Переробка алюмінію вимагає близько 1/70 енергії переробки алюмінію з руди, що ілюструє величезну економію енергії, яку забезпечує переробка.)
Ще одне застосування електролізу - гальванічне покриття, яке представляє собою нанесення тонкого шару металу на предмет в захисних або декоративних цілях (рис.\(\PageIndex{2}\)). По суті, металевий предмет з'єднаний з катодом електролітичного елемента і занурений в розчин конкретного катіона металу. При експлуатації електролітичного елемента тонке покриття катіону металу зменшується до елементарного металу на поверхні об'єкта; товщина покриття може становити всього кілька мікрометрів (10 −6 м). Ювелірні вироби, посуд для їжі, електричні контакти та автомобільні деталі, такі як бампери, є загальними предметами, які гальванічні. Золото, срібло, нікель, мідь та хром - поширені метали, що використовуються в гальванічних покриттях.

Ключові виноси
- Електроліз - це вимушене неспонтанне окислювально-відновне виникнення шляхом введення електрики в осередок із зовнішнього джерела.
- Електроліз використовується для ізоляції елементів і гальванічних об'єктів.
