17.5: Акумулятори та паливні елементи
- Page ID
- 22474
- Класифікуйте акумулятори як первинні або вторинні
- Перерахуйте деякі характеристики і обмеження акумуляторів
- Надайте загальний опис паливного елемента
Акумулятор - це електрохімічний елемент або ряд елементів, що виробляють електричний струм. В принципі, в якості акумулятора можна було використовувати будь-який гальванічний елемент. Ідеальна батарея ніколи не розрядилася б, виробляла незмінну напругу і була здатна витримувати екстремальні екологічні перепади тепла та вологості. Справжні акумулятори дотримуються балансу між ідеальними характеристиками і практичними обмеженнями. Наприклад, маса автомобільного акумулятора становить близько 18 кг або близько 1% від маси середнього легкового автомобіля або малої вантажівки. Цей тип батареї забезпечував би майже необмежену енергію, якщо використовувати його в смартфоні, але буде відхилений для цієї програми через його масу. Таким чином, жодна батарея не є «найкращою», і батареї підбираються для конкретного застосування, зберігаючи такі речі, як маса акумулятора, її вартість, надійність та поточна ємність на увазі. Існує два основних типи акумуляторів: первинні і вторинні. Далі описано кілька акумуляторів кожного типу.
Відвідайте цей сайт, щоб дізнатися більше про акумулятори.
Первинні акумулятори
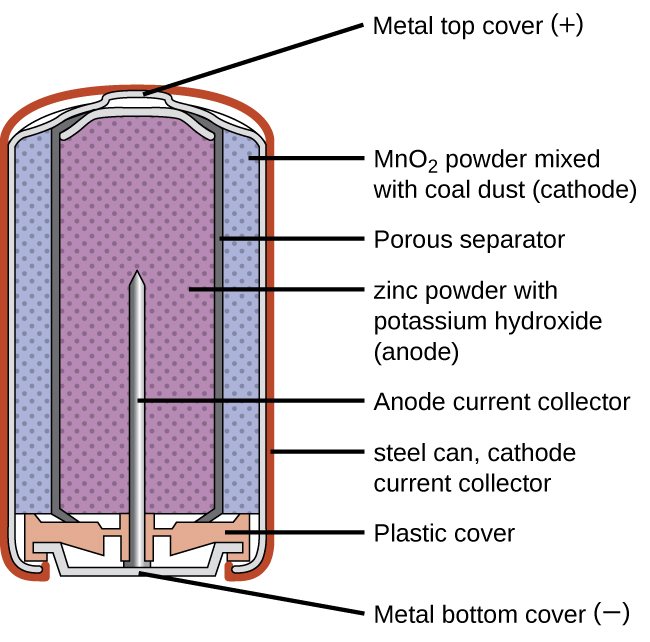
Первинні батареї - це одноразові батареї, оскільки їх неможливо зарядити. Звичайною первинною батареєю є суха батарея (рис.\(\PageIndex{1}\)). Сухий елемент являє собою цинк-вуглецеву батарею. Цинк може служити як ємністю, так і негативним електродом. Позитивний електрод являє собою стрижень, виготовлений з вуглецю, який оточений пастою оксиду марганцю (IV), хлориду цинку, хлориду амонію, порошку вуглецю та невеликої кількості води. Реакцію на аноді можна уявити як звичайне окислення цинку:
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \hspace{20px} E^\circ_{\ce{Zn^2+/Zn}}=\mathrm{−0.7618\: V} \nonumber \]
Реакція на катоді складніша, почасти тому, що відбувається не одна реакція. Ряд реакцій, що відбуваються на катоді, приблизно
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-} \nonumber \]
Загальну реакцію для цинк-вуглецевої батареї можна представити як
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-} \nonumber \]
із загальним потенціалом осередку, який спочатку становить близько 1,5 В, але зменшується в міру використання акумулятора. Важливо пам'ятати, що напруга, що подається акумулятором, однакове незалежно від розміру батареї. З цієї причини батареї D, C, A, AA та AAA мають однаковий номінал напруги. Однак більші батареї можуть доставляти більше молів електронів. У міру окислення контейнера з цинком його вміст з часом витікає, тому цей тип батареї не слід залишати в будь-якому електричному пристрої протягом тривалого періоду часу.

Лужні батарейки (рис.\(\PageIndex{2}\)) were developed in the 1950s partly to address some of the performance issues with zinc–carbon dry cells. They are manufactured to be exact replacements for zinc-carbon dry cells. As their name suggests, these types of batteries use alkaline electrolytes, often potassium hydroxide. The reactions are
\[\begin{align*} &\textrm{anode: }\ce{Zn}(s)+\ce{2OH-}(aq)⟶\ce{ZnO}(s)+\ce{H2O}(l)+\ce{2e-} \hspace{40px} E^\circ_\ce{anode}=\mathrm{−1.28\: V}\\ &\underline{\textrm{cathode: }\ce{2MnO2}(s)+\ce{H2O}(l)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2OH-}(aq) \hspace{40px} E^\circ_\ce{cathode}=\mathrm{+0.15\: V}}\\ &\textrm{overall: }\ce{Zn}(s)+\ce{2MnO2}(s)⟶\ce{ZnO}(s)+\ce{Mn2O3}(s) \hspace{40px} E^\circ_\ce{cell}=\mathrm{+1.43\: V} \end{align*} \nonumber \]
Лужна батарея може доставляти приблизно в три-п'ять разів більше енергії цинк-вуглецевої сухої клітини аналогічного розміру. Лужні батареї схильні до витоку гідроксиду калію, тому їх також слід видалити з пристроїв для тривалого зберігання. Хоча деякі лужні батареї перезаряджаються, більшість - ні. Спроби перезарядити лужну батарею, яка не перезаряджається, часто призводить до розриву акумулятора і витоку електроліту гідроксиду калію.
Вторинні батареї
Вторинні батареї є акумуляторними. Це типи акумуляторів, що зустрічаються в таких пристроях, як смартфони, електронні планшети та автомобілі.
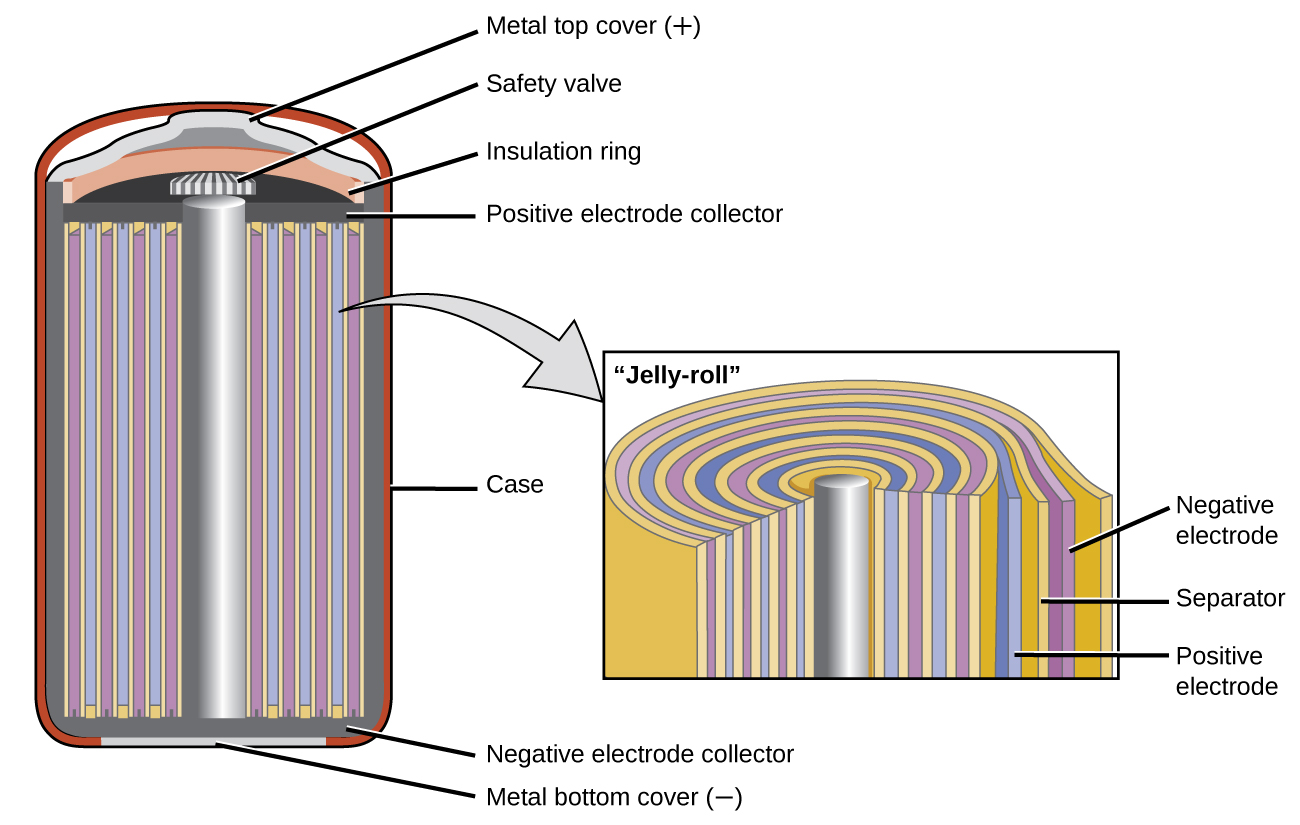
Нікель-кадмієві, або NiCd, акумулятори (рис.\(\PageIndex{3}\)) складаються з нікельованого катода, кадмієвого анода і електрода гідроксиду калію. Позитивні і негативні пластини, які запобігають замикання сепаратором, згортаються між собою і заводяться в корпус. Це конструкція «желейного рулону» і дозволяє елементу NiCd доставляти набагато більше струму, ніж лужна батарея аналогічного розміру. Реакції такі
\ [\ почати {вирівнювати*}
&\ textrm {анод:}\ ce {Cd} (s) +\ ce {2OH-} (q) ⟶\ ce {Cd (ОН) 2} (s) +\ ce {2e-}\\
&\ підкреслення {\ textrm {катод:}\ ce {Nio2} (s) +\ ce {2H2O} (л) +\ ce {2e-} ⟶\ ce {Ni (ОН) 2} (и) +\ ce {2OH-} (q)}\\
&\ textrm {загальний:}\ ce {Cd} (и) +\ ce {Nio2} (и) +\ ce {2H2O} (л) ⟶\ ce {Cd (ОН) 2} (s) +\ ce {Ni (OH) 2} (s)\ кінець {вирівнювати*}\ nonnumber\]
Напруга становить близько 1,2 В до 1,25 В при розряді акумулятора. При правильній обробці акумулятор NiCd можна заряджати близько 1000 разів. Кадмій є токсичним важким металом, тому акумулятори NiCd ніколи не слід відкривати або класти у звичайний сміття.
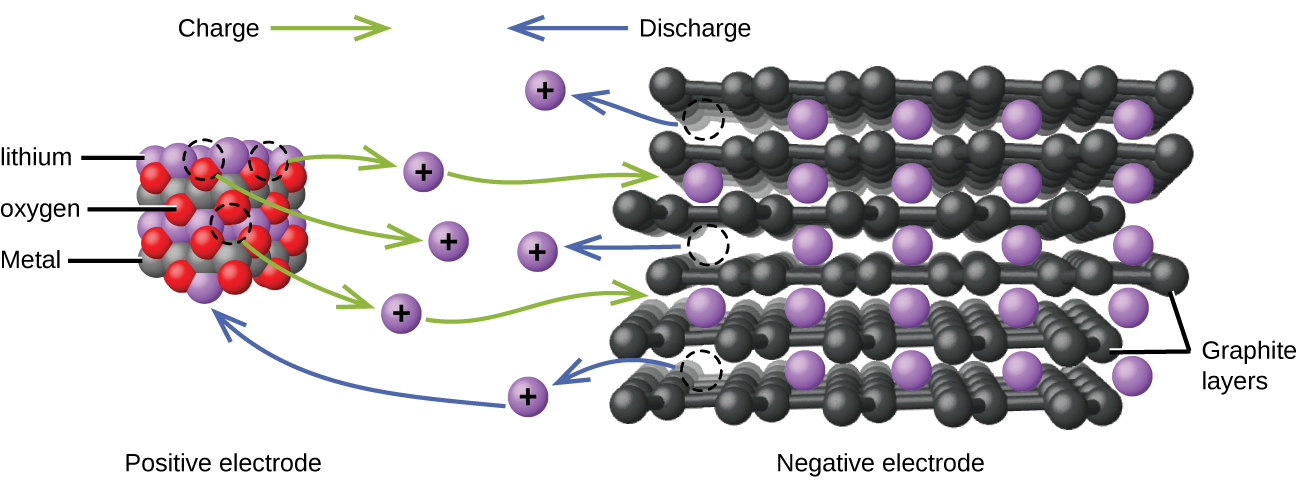
Літій-іонні акумулятори (рис.\(\PageIndex{4}\)) відносяться до найпопулярніших акумуляторних батарей і використовуються в багатьох портативних електронних пристроях. Реакції такі
\[\begin{align*} &\textrm{anode: }\ce{LiCoO2}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{Li+}+x\ce{e-}\\ &\textrm{cathode: }x\ce{Li+}+x\ce{e-}+x\ce{C6}⇌x\ce{LiC6}\\ &\overline{\textrm{overall: }\ce{LiCoO2}+x\ce{C6}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{LiC6}} \end{align*} \nonumber \]
При коефіцієнтах, що представляють молі, х становить не більше приблизно 0,5 моля. Напруга акумулятора становить близько 3,7 В. Літієві батареї популярні, оскільки вони можуть забезпечити велику кількість струму, легші, ніж порівнянні батареї інших типів, виробляють майже постійну напругу при розряді і лише повільно втрачають заряд при зберіганні.
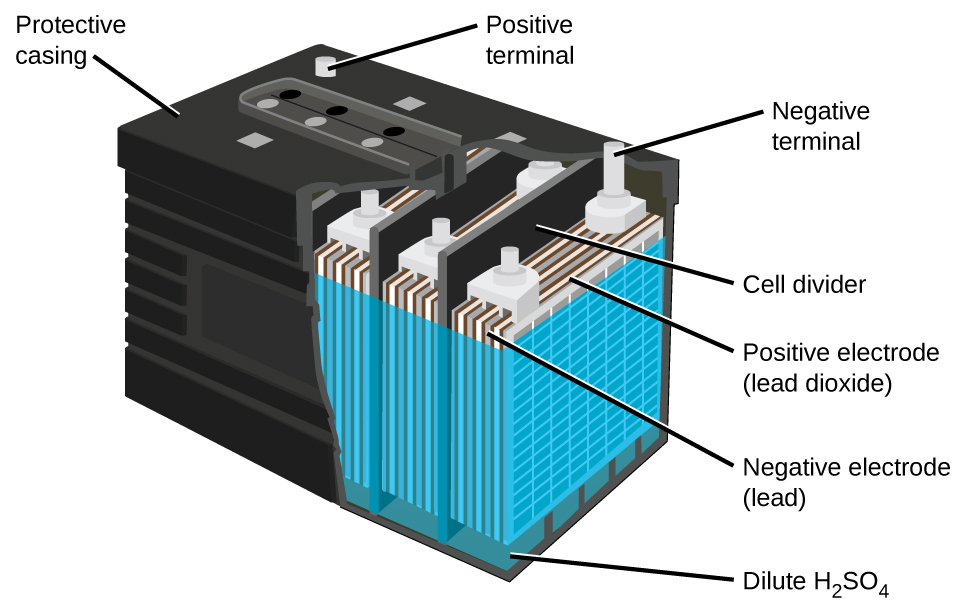
Свинцево-кислотний акумулятор (рис.\(\PageIndex{5}\)) - це тип вторинної батареї, що використовується у вашому автомобілі. Він недорогий і здатний виробляти високий струм, необхідний автомобільним стартерним двигунам. Реакції на свинцево-кислотну батарею
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*} \nonumber \]
Кожна комірка виробляє 2 В, тому шість осередків з'єднані послідовно для отримання автомобільного акумулятора на 12 В. Свинцево-кислотні батареї важкі і містять їдкий рідкий електроліт, але часто все ще є батареєю вибору через їх високу щільність струму. Оскільки ці акумулятори містять значну кількість свинцю, від них завжди потрібно утилізувати належним чином.
Паливні елементи
Паливний елемент - це пристрій, який перетворює хімічну енергію в електричну. Паливні елементи схожі на батареї, але вимагають постійного джерела палива, часто водню. Вони продовжуватимуть виробляти електроенергію до тих пір, поки буде доступне паливо. Водневі паливні елементи використовувалися для живлення супутників, космічних капсул, автомобілів, човнів та підводних човнів (рис.\(\PageIndex{6}\)).
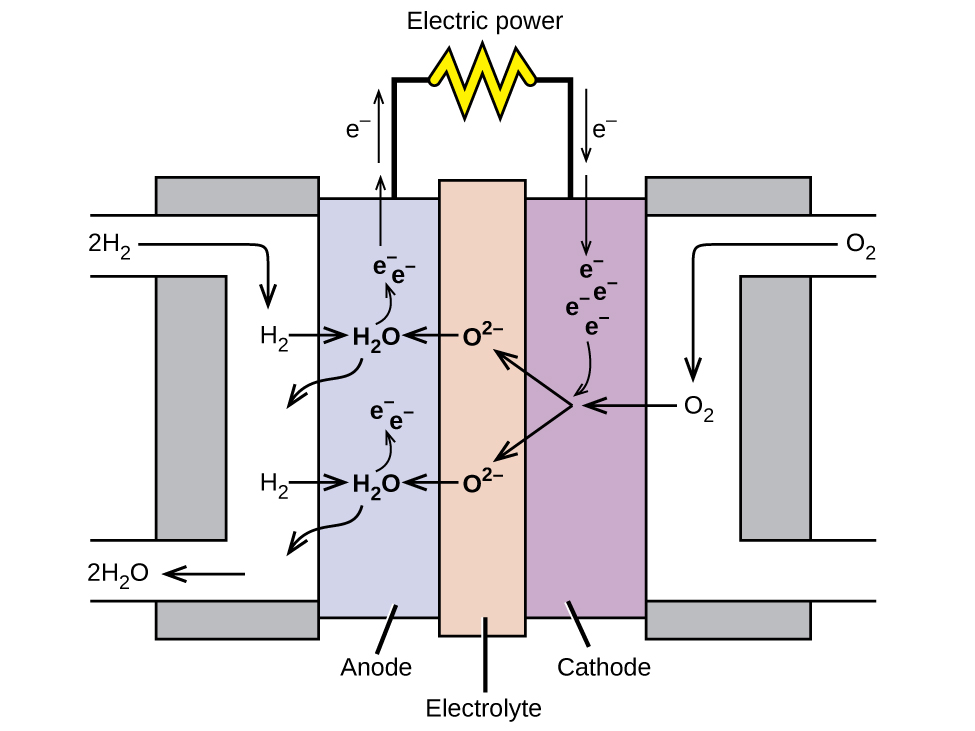
У водневому паливному елементі реакції
\ [\ почати {вирівнювати*}
&\ textrm {анод:}\ ce {2H2+ 2O ^ 2- ⟶ 2H2O + 4e-}\\
&\ підкреслення {\ textrm {катод:}\ ce {O2 + 4e- ⟶ 2O ^ 2-}\ hspace {55px}}\ &\ textrm {загальний:}\ ce {2O- 2-}\ hspace {55px}}\
&\ textrm {загальний:}\ ce {2E- H2 + O2 ⟶ 2H2O}\ кінець {вирівнювати*}\ nonumber\]
Напруга становить близько 0,9 В. ККД паливних елементів зазвичай становить близько 40% до 60%, що вище, ніж типовий двигун внутрішнього згоряння (від 25% до 35%) і, у випадку з водневим паливним елементом, виробляє тільки воду як вихлоп. В даний час паливні елементи досить дорогі і містять функції, які призводять їх до виходу з ладу через відносно короткий час.
Резюме
Батареї являють собою гальванічні елементи, або ряд елементів, які виробляють електричний струм. Коли осередки об'єднані в батареї, потенціал батареї є цілим числом кратним потенціалу однієї комірки. Існує два основних типи акумуляторів: первинні і вторинні. Первинні батареї є «одноразовими» і не підлягають зарядці. Сухі елементи і (більшість) лужних батарей є прикладами первинних батарей. Другий тип є акумуляторним і називається вторинним акумулятором. Приклади вторинних акумуляторів включають нікель-кадмієві (NiCd), свинцево-кислотні та літій-іонні акумулятори. Паливні елементи схожі на акумулятори тим, що генерують електричний струм, але вимагають безперервного додавання палива і окислювача. Водневий паливний елемент використовує водень і кисень з повітря для отримання води, і, як правило, є більш ефективним, ніж двигуни внутрішнього згоряння.
Резюме
- лужна батарея
- первинна батарея, яка використовує лужний (часто гідроксид калію) електроліт; призначений для точної заміни сухої клітини, але з більшим накопиченням енергії та меншим витоком електроліту, ніж типовий сухий елемент
- акумулятор
- гальванічний елемент або ряд елементів, що виробляють струм; в теорії будь-який гальванічний елемент
- сухі клітини
- первинний акумулятор, також званий цинково-вуглецевим акумулятором; може використовуватися в будь-якій орієнтації, оскільки він використовує пасту як електроліт; має тенденцію до витоку електроліту при зберіганні
- паливний елемент
- пристрої, що виробляють електричний струм до тих пір, поки постійно додаються паливо і окислювач; більш ефективні, ніж двигуни внутрішнього згоряння
- свинцево-кислотний акумулятор
- вторинний акумулятор, який складається з декількох елементів; свинцево-кислотна батарея, знайдена в автомобілі, має шість осередків і напругу 12 В
- літій-іонний акумулятор
- дуже популярний вторинний акумулятор; використовує іони літію для проведення струму і є легким, перезаряджається і виробляє майже постійний потенціал, коли він розряджається
- нікель-кадмієвий акумулятор
- (NiCd акумулятор) вторинний акумулятор, який використовує кадмій, який є токсичним важким металом; важче літій-іонних батарей, але з аналогічними експлуатаційними характеристиками
- первинний акумулятор
- одноразова неакумуляторна батарея
- вторинний акумулятор
- акумулятор, який можна заряджати
