17.7: Калориметрія
- Page ID
- 19300
Свого часу калорії в продуктах вимірювали за допомогою калориметра бомби. Зважена кількість їжі буде поміщена в калориметр, а потім система була герметична і заповнена киснем. Електрична іскра запалила харчово-кисневу суміш. Кількість тепла, що виділяється при спалюванні їжі, дало уявлення про калорії, присутні в їжі. Сьогодні калорії розраховуються з білкової, вуглеводної, жирності їжі (все визначається хімічним аналізом).
Калориметрія
Калориметрія - це вимірювання передачі тепла в систему або з неї під час хімічної реакції або фізичного процесу. Калориметр - це ізольована ємність, яка використовується для вимірювання теплових змін. Більшість реакцій, які можна проаналізувати в експерименті з калориметрії, є або рідинами, або водними розчинами. Часто використовуваний і недорогий калориметр - це набір вкладених пінопластових чашок, оснащених кришкою для обмеження теплообміну між рідиною в чашці і повітрям в оточенні (див. Малюнок нижче). У типовому експерименті з калориметрії конкретні обсяги реагентів розливаються в окремі ємності і вимірюється температура кожного. Потім вони змішуються в калориметр, який запускає реакцію. Суміш реагентів перемішують до завершення реакції, при цьому температура реакції безперервно контролюється.
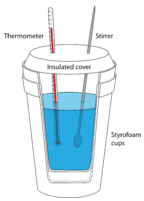
Ключем до всіх експериментів з калориметрії є припущення про відсутність теплообміну між ізольованим калориметром і приміщенням. Розглянемо випадок реакції, що відбувається між водними реагентами: вода, в якій були розчинені тверді речовини, - це оточення, тоді як розчинені речовини - це система. Зміна температури, яка вимірюється, - це зміна температури, яка відбувається в оточенні. Якщо температура води збільшується в міру протікання реакції, реакція екзотермічна. Тепло виділялося системою в навколишню воду. Ендотермічна реакція поглинає тепло з навколишнього середовища, тому температура води знижується, оскільки тепло залишає навколишнє середовище, щоб потрапити в систему.
Зміна температури води вимірюється в експерименті, і питома теплота води може бути використана для розрахунку тепла, поглиненого навколишнім середовищем\(\left( q_\text{surr} \right)\).
\[q_\text{surr} = m \times c_p \times \Delta T\nonumber \]
У рівнянні,\(m\) це маса води,\(c_p\) це питома теплоємність води, і\(\Delta T\) є\(T_f - T_i\). Тепло, поглинене навколишнім середовищем, дорівнює, але протилежне за знаком теплоті, що виділяється системою. Оскільки зміна тепла визначається при постійному тиску, тепло, що\(\left( q_\text{sys} \right)\) виділяється системою, дорівнює зміні ентальпії\(\left( \Delta H \right)\).
\[q_\text{sys} = \Delta H = -q_\text{surr} = - \left( m \times c_p \times \Delta T \right)\nonumber \]
\(\Delta H\)Ознака позитивний для ендотермічної реакції і негативний для екзотермічної реакції.
Приклад\(\PageIndex{1}\)
В експерименті,\(25.0 \: \text{mL}\) з\(1.00 \: \text{M} \: \ce{HCl}\) at\(25.0^\text{o} \text{C}\) додається до\(25.0 \: \text{mL}\)\(1.00 \: \text{M} \: \ce{NaOH}\) at\(25.0^\text{o} \text{C}\) в пінопластовій чашці калориметра. Відбувається реакція і температура підвищується до\(32.0^\text{o} \text{C}\). Обчисліть зміну\(\left( \Delta H \right)\) ентальпії\(\text{kJ}\) для цієї реакції. Припустимо, щільності розчинів є\(1.00 \: \text{g/mL}\) і що їх питома теплота така ж, як у води.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- \(c_p = 4.18 \: \text{J/g}^\text{o} \text{C}\)
- \(V_\text{final} = 25.0 \: \text{mL} + 25.0 \: \text{mL} = 50.0 \: \text{mL}\)
- \(\Delta T = 32.0^\text{o} \text{C} - 25.0^\text{o} \text{C} = 7.0^\text{o} \text{C}\)
- Щільність\(= 1.00 \: \text{g/mL}\)
Невідомий
Обсяг і щільність можна використовувати для знаходження маси розчину після замішування. Потім обчислити зміну ентальпії за допомогою\(\Delta H = q_\text{sys} = -q_\text{surr} = - \left( m \times c_p \times \Delta T \right)\).
Крок 2: Вирішіть.
\[\begin{align*} m &= 50.0 \: \text{mL} \times \frac{1.00 \: \text{g}}{\text{mL}} = 50.0 \: \text{g} \\ \Delta H &= - \left( m \times c_p \times \Delta T \right) = - \left( 50.0 \: \text{g} \times 4.18 \: \text{J/g}^\text{o} \text{C} \times 7.0^\text{o} \text{C} \right) = -1463 \: \text{J} = -1.5 \: \text{kJ} \end{align*}\nonumber \]
Крок 3: Подумайте про результат.
Зміна ентальпії негативна, оскільки реакція виділяє тепло в навколишнє середовище, що призводить до підвищення температури води.
Резюме
- Калориметрія - це вимірювання передачі тепла в систему або з неї під час хімічної реакції або фізичного процесу.
- Калориметр - це ізольована ємність, яка використовується для вимірювання теплових змін.
- Проілюстровано розрахунки, пов'язані зі змінами ентальпії.