7.4: Ентальпія та хімічні реакції
- Page ID
- 22649
- Визначте ентальпію.
- Правильно виражають ентальпію зміни хімічних реакцій.
- Поясніть, як експериментально вимірюються зміни ентальпії.
Тепер, коли ми показали, як пов'язані енергія, робота і тепло, ми готові розглянути енергетичні зміни в хімічних реакціях. Фундаментальна концепція полягає в тому, що кожна хімічна реакція відбувається з одночасною зміною енергії. Тепер потрібно навчитися правильно виражати ці енергетичні зміни.
Наше дослідження газів у розділі 6 та наше визначення роботи в розділі 7.3 вказують на те, що такі умови, як тиск, об'єм та температура, впливають на вміст енергії в системі. Що нам потрібно, так це визначення енергії, яка тримається при зазначенні деяких з цих умов (дещо схоже на наше визначення стандартної температури і тиску в нашому дослідженні газів). Ми визначаємо зміну ентальпії (Δ H) як теплоту процесу, коли тиск тримається постійним:
\[\Delta H\equiv q\; at\; constant\; pressure\nonumber \]
Буква H означає «ентальпія», свого роду енергія, тоді як Δ передбачає зміну кількості. Нас завжди буде цікавити зміна Н, а не абсолютне значення самого Н.
При виникненні хімічної реакції відбувається характерна зміна ентальпії. Зміна ентальпії для реакції, як правило, записується після збалансованого хімічного рівняння і на тому ж рядку. Наприклад, коли два молі водню реагують з одним молем кисню, щоб зробити два молі води, характерна зміна ентальпії становить 570 кДж. Запишемо рівняння як
\[\ce{2H2(g) + O2(g) → 2H2O(ℓ)}\nonumber \]
з\(ΔH = −570\, kJ\)
Хімічне рівняння, яке включає зміну ентальпії, називається термохімічним рівнянням. Прийнято, що термохімічне рівняння відноситься до рівняння в молярних кількостях, а це означає, що воно повинно інтерпретуватися термінами молів, а не окремих молекул.
Напишіть термохімічне рівняння для реакції pCl 3 (g) з Cl 2 (g), щоб зробити pCl 5 (g), який має зміну ентальпії −88 кДж.
Рішення
Термохімічне рівняння
ПКл 3 (г) + Сл 2 (г) → ПКл 5 (г) Δ Н = −88 кДж
Напишіть термохімічне рівняння для реакції N 2 (g) з O 2 (g), щоб зробити 2NO (g), що має зміну ентальпії 181 кДж.
- Відповідь
-
N 2 (г) + О 2 (г) → 2NO (г) Δ Н = 181 кДж
Можливо, ви помітили, що Δ H для хімічної реакції може бути позитивним або негативним. Число вважається позитивним, якщо воно не має знака; знак + можна додати явно, щоб уникнути плутанини. Хімічна реакція, яка має позитивний Δ H, вважається ендотермічною, тоді як хімічна реакція, яка має негативний Δ H, вважається екзотермічною.
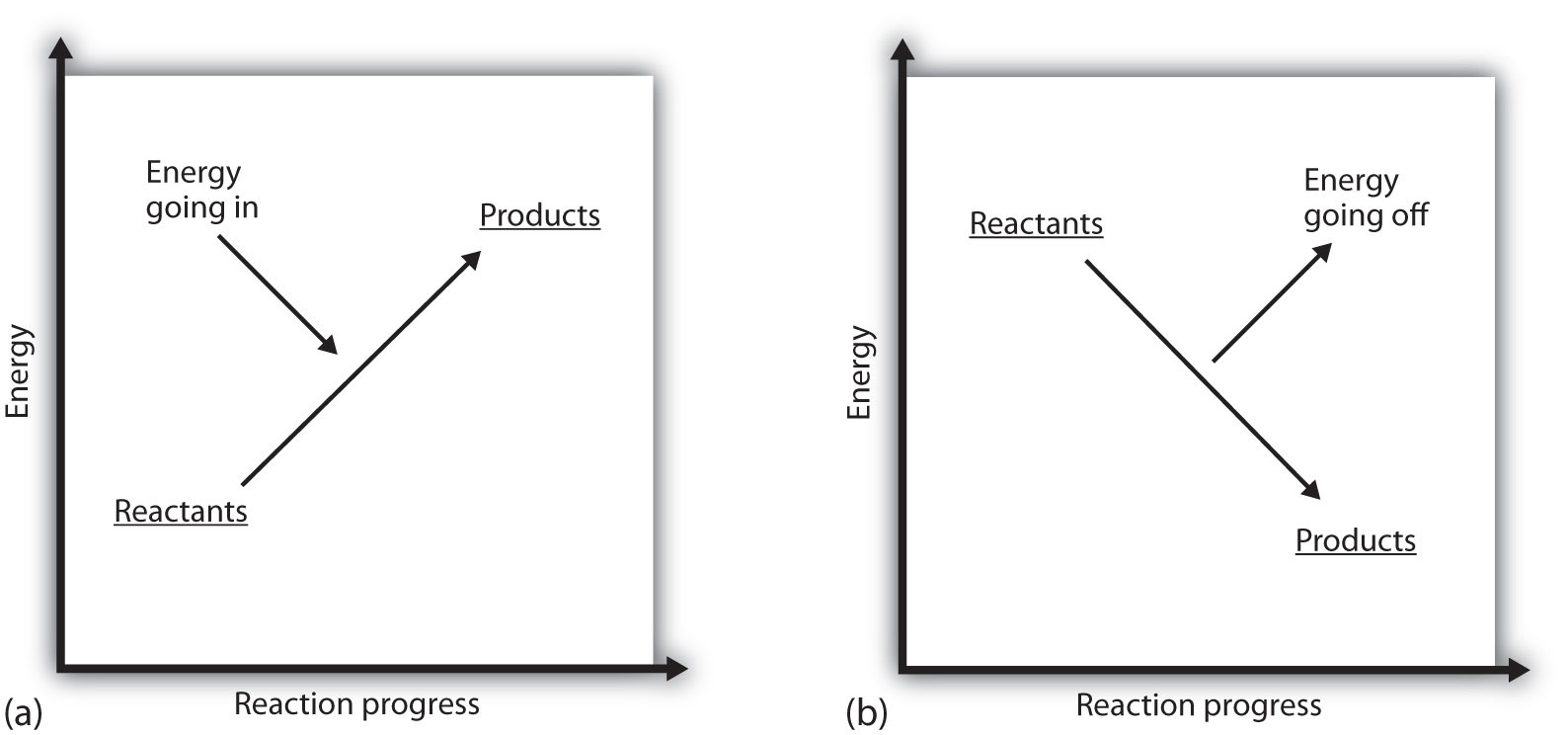
Що означає, якщо Δ H процесу є позитивним? Це означає, що система, в якій відбувається хімічна реакція, набирає енергію. Якщо розглядати енергію системи як представлену у вигляді висоти на вертикальному енергетичному графіку, зміна ентальпії, яка супроводжує реакцію, може бути скомпонована як частина (а) енергії\(\PageIndex{1}\) реакції фігури: енергія реагентів має деяку енергію, і система збільшує свою енергію, як вона йде до продуктів. Продукти вище за вертикальною шкалою, ніж реагенти. Отже, ендотермічний означає, що система отримує або поглинає енергію.
Для екзотермічного процесу існує протилежна ситуація, як показано в частині (b) малюнка\(\PageIndex{1}\) - Енергія реакції. Якщо зміна ентальпії реакції негативна, система втрачає енергію, тому продукти мають менше енергії, ніж реагенти, і продукти нижчі за шкалою вертикальної енергії, ніж реагенти. Екзотермічний, значить, має на увазі, що система втрачає або віддає енергію.
Розглянемо це термохімічне рівняння.
\[\ce{2CO(g) + O2(g) → 2CO2(g)}\nonumber \]
при Δ Н = −565 кДж
Це екзотермічний або ендотермічний? Скільки енергії віддається або поглинається?
Рішення
За визначенням, хімічна реакція, яка має негативний Δ H, є екзотермічною, що означає, що така велика енергія - у цьому випадку 565 кДж - виділяється реакцією.
Розглянемо це термохімічне рівняння.
СО 2 (г) + Н 2 (г) → СО (г) + Н 2 О (г) Δ Н = 42 кДж
Це екзотермічний або ендотермічний? Скільки енергії віддається або поглинається?
- Відповідь
-
Ендотермічні; 42 кДж всмоктуються.
Як вимірюються величини Δ H експериментально? Власне, Δ H не вимірюється; q вимірюється. Але вимірювання виконуються в умовах постійного тиску, тому Δ Н дорівнює q виміряному.
Експериментально q вимірюється, скориставшись рівнянням
\[q = mcΔT\nonumber \]
Попередньо вимірюємо масу хімічних речовин в системі. Потім ми даємо хімічній реакції відбутися і вимірюємо зміну температури (Δ T) системи. Якщо ми знаємо питому теплоємність матеріалів в системі (зазвичай ми робимо), ми можемо обчислити q. Це значення q чисельно дорівнює Δ H процесу, який ми можемо масштабувати до молярної шкали. Контейнер, в якому знаходиться система, зазвичай ізольований, тому будь-яка зміна енергії йде в зміну температури системи, а не витік з системи. Ємність іменується калориметром, а процес вимірювання змін ентальпії називається калориметрії.
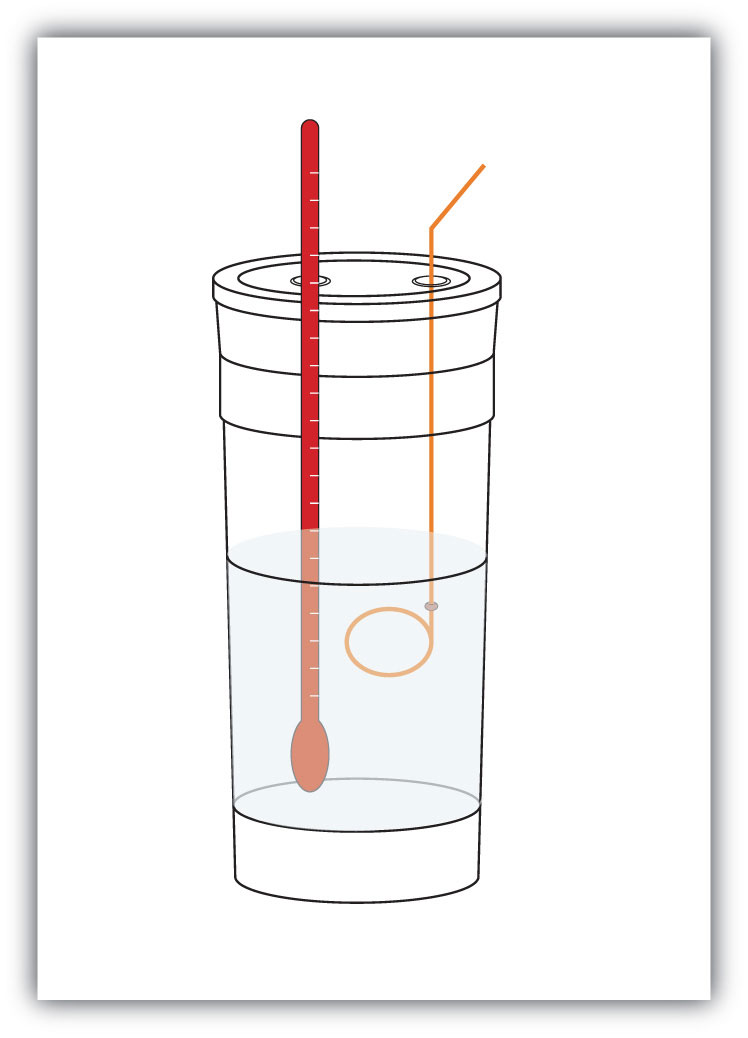
Наприклад, припустимо, що 4,0 г NaOH, або 0,10 моль NaOH, розчиняють, щоб зробити 100,0 мл водного розчину; в той час як 3,65 г HCl, або 0,10 моль HCl, розчиняють, щоб зробити ще 100,0 мл водного розчину. Два розчини змішуються в ізольованому калориметрі, вставляється термометр, і калориметр накривається (див. Рис.\(\PageIndex{2}\) - Калориметри для прикладу установки). Термометр вимірює зміну температури, оскільки відбувається наступна хімічна реакція:
NaOH (aq) + HCl (aq) → NaCl (aq) + H 2 O ()
Спостерігач зазначає, що температура зростає з 22,4° C до 29,1° C, якщо припустити, що теплоємність і щільність розчинів такі ж, як у чистої води, ми маємо інформацію, необхідну для визначення зміни ентальпії хімічної реакції. Загальна кількість розчину становить 200,0 мл, а при щільності 1,00 г/мл у нас таким чином виходить 200,0 г розчину. Використовуючи рівняння для q, підставляємо наші експериментальні вимірювання і питому теплоємність води (в таблиці\(\PageIndex{1}\) розділу 7.3).
\[q=(200.0\cancel{g})(4.184\frac{J}{\cancel{g}.\cancel{^{\circ}C}})(6.7\cancel{^{\circ}C})\nonumber \]
Вирішуючи для q, отримуємо
\[q=5600\, J\equiv \Delta H\: for\: the\: reaction\nonumber \]
Теплота q дорівнює Δ H для реакції, оскільки хімічна реакція відбувається при постійному тиску. Однак реакція виділяє цю кількість енергії, тому фактичний знак на Δ H негативний:
Δ H = −5,600 Дж для реакції
Таким чином, ми маємо наступне термохімічне рівняння хімічної реакції, що відбулася в калориметрі:
\[\frac{1}{10}NaOH(aq)+\frac{1}{10}HCl(aq)\rightarrow \frac{1}{10}NaCl(aq)+\frac{1}{10}H_{2}O(l)\; \Delta H=\, -\, 5600\: J\nonumber \]
Коефіцієнти 1/10 присутні, щоб нагадати нам, що ми почали з однієї десятої моля кожного реагенту, тому ми робимо одну десяту моль кожного продукту. Зазвичай, однак, ми повідомляємо термохімічні рівняння з точки зору родимок, а не однієї десятої молі. Щоб масштабувати до молярних величин, ми повинні помножити коефіцієнти на 10. Однак, коли ми це робимо, ми отримуємо в 10 разів більше енергії. Таким чином, ми маємо
NaOH (ак) + HCl (aq) → NaCl (aq) + Н 2 О () Δ Н = −56,000 Дж
Δ H може бути перетворений в одиниці кДж, тому наше остаточне термохімічне рівняння
NaOH (ак) + HCl (aq) → NaCl (aq) + Н 2 О () Δ Н = −56 кДж
Ми щойно взяли наші експериментальні дані з калориметрії та визначили зміну ентальпії хімічної реакції. Подібні вимірювання на інших хімічних реакціях можуть визначити значення Δ H будь-якої хімічної реакції, яку ви хочете вивчити.
100 мл розчину 0,25 моль Ca 2 + (aq) змішували з 0,50 моль іонів F − (aq), а CaF 2 випадали в осад:
Са 2 + (ак) + 2Ф − (ак) → СаФ 2 (и)
Температура розчину зросла на 10,5 °С, яка зміна ентальпії для хімічної реакції? Якою була зміна ентальпії для виробництва 1 моль CaF 2? Припустимо, що розчин має таку ж щільність і питому теплоємність, що і вода.
Рішення
Оскільки нам дано Δ T безпосередньо, ми можемо визначити теплоту реакції, яка дорівнює Δ H:
\[q=(100\cancel{g})(4.184\frac{J}{\cancel{g}.\cancel{^{\circ}C}})(10.5\cancel{^{\circ}C})\nonumber \]
Вирішуючи для q, отримуємо
q = 4,400 Дж
Тому Δ Н = −4400 Дж.
За стехіометрії реакції буде утворюватися рівно 0,25 моль CaF 2, тому ця кількість тепла припадає на 0,25 моль. Для 1 моль CaF 2 нам потрібно масштабувати тепло в чотири рази:
q = 4400 Дж × 4 = 17,600 Дж за 1 моль СаФ 2
На молярній основі зміна ентальпії становить
Δ Н = −17,600 Дж = −17,6 кДж
У калориметрі при постійному тиску реагують 0,10 моль СН 4 (г) і 0,20 моль О 2 (г).
СН 4 (г) + 2О 2 (г) → СО 2 (г) + 2Н 2 О ()
Реакція прогріває 750,0 г H 2 O на 28,4 °С Що таке Δ H для реакції за молярною шкалою?
- Відповідь
-
−891 кДж
Ключові виноси
- Кожна хімічна реакція відбувається з одночасною зміною енергії.
- Зміна ентальпії дорівнює тепла при постійному тиску.
- Зміни ентальпії можуть бути виражені за допомогою термохімічних рівнянь.
- Зміни ентальпії вимірюються за допомогою калориметрії.
