3.4: Калориметрія
- Page ID
- 21178
Як хіміки, ми стурбовані хімічними змінами і реакціями. Термодинаміка хімічних реакцій може бути дуже важливою з точки зору контролю виробництва бажаних продуктів та запобігання небезпеці, таких як вибухи. Таким чином, вимірювання та розуміння термохімії хімічних реакцій не тільки корисно, але й важливо!
Калориметрія
Методи калориметрії можуть бути використані для вимірювання q для хімічної реакції безпосередньо. Зміна ентальпії для хімічної реакції представляє значний інтерес для хіміків. Екзотермічна реакція вивільнить тепло (\(q_{reaction} < 0\),\(q_{surroundings} > 0\)), що призведе до підвищення температури навколишнього середовища. І навпаки, ендотермічна реакція (\(q_{reaction} > 0\),\(q_{surroundings} < 0\)) буде витягувати тепло з навколишнього середовища, в результаті чого температура навколишнього падає. Вимірювання зміни температури в оточенні дозволяє визначити, скільки тепла було виділено або поглинуто в реакції.
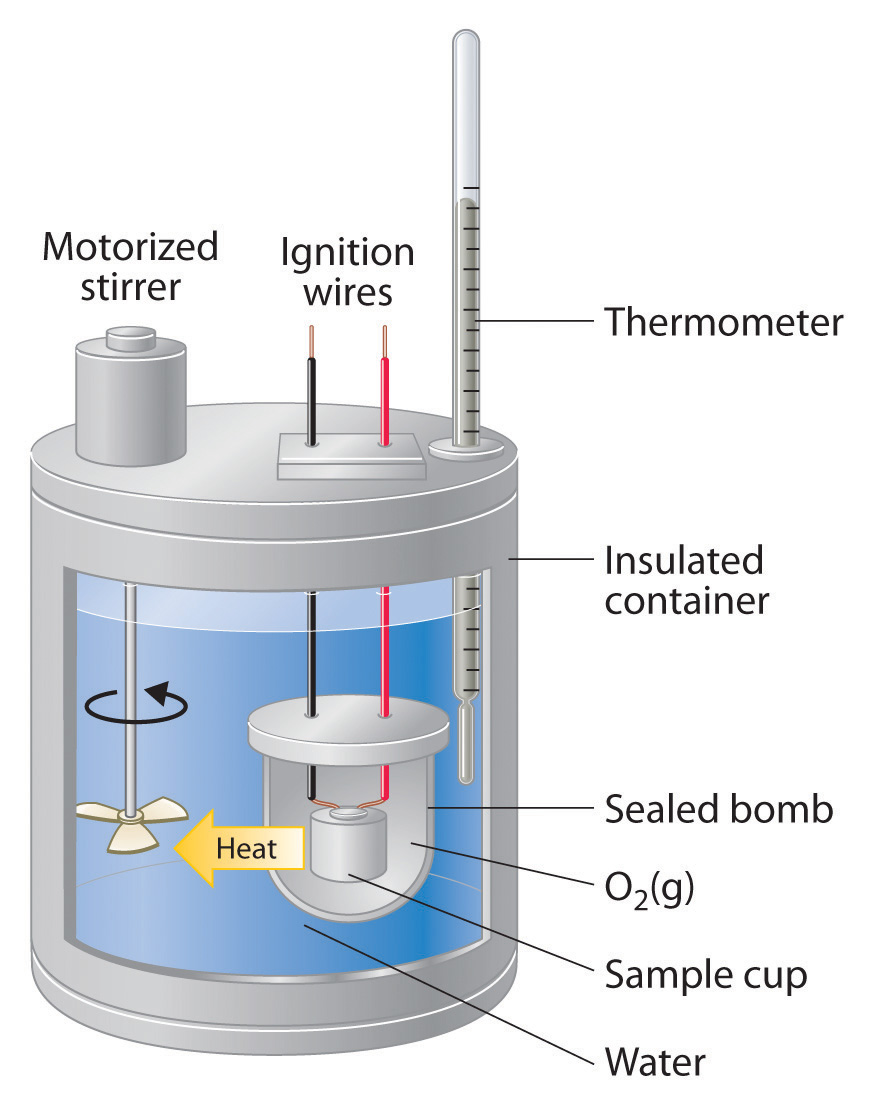
Калориметрія бомби
Калориметрія бомби використовується переважно для вимірювання тепла, що виділяється в реакціях горіння, але може бути використана для найрізноманітніших реакцій. Тут показана типова бомба калориметрії. Реакція міститься у важкому металевому контейнері (бомбі), змушуючи реакцію відбуватися в постійному обсязі. Таким чином, тепло, що виділяється (або поглинається) реакцією, дорівнює зміні внутрішньої енергії (D U rxn). Потім бомба занурюється в відтворюється кількість води, температура якої контролюється високоточним термометром.
Для реакцій горіння бомба буде завантажена невеликим зразком згоряється з'єднання, а потім бомба заповнюється високим тиском (зазвичай близько 10 атм) О 2. Реакція ініціюється подачею тепла за допомогою короткого шматка резистивного дроту, що несе електричний струм.
Калориметр повинен бути відкалібрований шляхом проведення реакції, для якої добре\(\Delta U_{rxn}\) відома, так що результуюча зміна температури може бути пов'язана з кількістю тепла, що виділяється або поглинається. Загальноприйнятою реакцією є згоряння бензойної кислоти. Це робить хороший вибір, оскільки бензойна кислота надійно реагує і відтворюється при нормальних умовах калориметрії бомби. Потім «водний еквівалент» калориметра можна обчислити за зміною температури, використовуючи наступне співвідношення:
\[W = \dfrac{n\Delta U_c +e_{wrire}+e_{other}}{\Delta T}\]
де n - число молів використовуваної бензойної кислоти,\(\Delta U_c\) - внутрішня енергія згоряння бензойної кислоти (3225,7 кДж моль -1 при 25 о С),\(e_{wire}\) припадає на енергію, що виділяється при згорянні дроти запобіжника, е інші враховують будь-які інші поправки ( наприклад, тепло, що виділяється внаслідок згоряння залишкового азоту в бомбі), а D T - виміряна зміна температури в навколишній водяній бані.
Після того, як для калориметра визначається «водний еквівалент», зміна температури може бути використана\(\Delta U_c\) для пошуку невідомого з'єднання від зміни температури, створеної при згорянні відомої кількості речовини.
\[ \Delta U_c = \dfrac{W \Delta T - e_{wire} - e_{other}}{n_{sample}}\]
Експеримент вище відомий як «ізотермічна калориметрія бомби», оскільки вся збірка знаходиться в лабораторії постійної температури. Інший підхід полягає у використанні «адіабатичної бомби калориметрії», в якій вузол сидить всередині водяної сорочки, температура якої контролюється відповідно до температури води всередині ізольованого контейнера. Підбираючи цю температуру, немає теплового градієнта, і, отже, немає витоків тепла в або з вузла під час експерименту (і, отже, експеримент ефективно «адіабатичний»).
Знаходження\(\Delta U_c\)
Ентальпію горіння можна обчислити за зміною внутрішньої енергії, якщо відома збалансована хімічна реакція. Нагадаємо з визначення ентальпії
\[\Delta H = \Delta U + \Delta (pV)\]
і якщо газофазні реагенти та продукти можна розглядати як ідеальні гази (\(pV = nRT\))
\[\Delta H = \Delta U + RT \Delta n_{gas}\]
при постійній температурі. Для згоряння бензойної кислоти при 25 о С
\[\ce{C6H5COOH (s) + 15/2 O_2(g) -> 7 CO2(g) + 3 H2O(l)} \]
видно, що\(\Delta n_{gas}\) це -0,5 моль газу на кожен моль бензойної кислоти відреагував.
Приклад\(\PageIndex{1}\): Combustion of Naphthalene
Студент спалив 0,7842 г зразка бензойної кислоти (\(\ce{C7H6O2}\)) в калориметрі бомби спочатку при 25,0 o С і побачив підвищення температури на 2,02 o С. Потім вона спалила 0,5348 г зразка нафталіну (\(\ce{C10H8}\)) (знову від початкової температури 25 o С) і побачив підвищення температури на 2,24 o С. З цих даних обчислити\(\Delta H_c\) для нафталіну (якщо припустити е дріт і е інші не важливі.)
Рішення:
По-перше, водний еквівалент:
\[W = \dfrac{\left[ (0.7841\,g) \left(\frac{1\,mol}{122.124 \, g} \right)\right] (3225.7 \,kJ/mol)}{2.02 \,°C} = 10.254 \, kJ/°C \nonumber\]
Тоді\(\Delta U_c\) для зразка:
\[\Delta H_c = \dfrac{(10.254\, kJ/\,°C)(2.24\,°C )}{(0.5308 \,g)\left(\frac{1\,mol}{128.174 \, g} \right) } = 5546.4 \, kJ/°C \nonumber\]
\(\Delta H_c\)потім дається
\[\Delta H_c = \Delta U_c + RT \Delta n_{gas} \nonumber\]
Реакція на згоряння нафталіну при 25 о С становить:
\[\ce{ C10H8(s) + 12 O2(g) -> 10 CO2(g) + 4 H2O(l)} \nonumber\]
с\(\Delta n_{gas} = -2\).
Так
\[ \Delta H_c = 5546.4 \,kJ/mol + \left( \dfrac{8.314}{1000} kJ/(mol \, K) \right) (298 \,L) (-2) = 5541\, kJ/mol \nonumber\]
Літературна цінність (Балкан, Арзік та Алтуната, 1996) становить 5150,09 кДж/моль. Так що це не надто за горами!
