14.5: Калориметрія
- Page ID
- 19022
Переконайтеся, що ви добре розумієте наступну важливу концепцію:
- Опишіть простий калориметр і поясніть, як він використовується і як визначається його теплоємність.
Постійна об'ємна калориметрія, також відома як калориметрія бомби, використовується для вимірювання тепла реакції, утримуючи постійний обсяг і чинити опір великій кількості тиску. Хоча ці два аспекти бомби калориметрії зробити для точних результатів, вони також сприяють труднощі бомби калориметрії. У цьому модулі буде розглянуто основну збірку калориметра бомби, а також те, як калориметрія бомби відноситься до теплоти реакції та теплоємності та розрахунків, пов'язаних з цими двома темами.
Вступ
Калориметрія використовується для вимірювання кількості тепла, і може бути використана для визначення теплоти реакції за допомогою експериментів. Зазвичай використовується калориметр з кавовою чашкою, оскільки він простіший, ніж калориметр бомби, але для вимірювання тепла, що виділяється в реакції горіння, ідеально підходить постійний об'єм або калориметрія бомби. Калориметр з постійним об'ємом також є більш точним, ніж калориметр з кавовою чашкою, але його складніше використовувати, оскільки він вимагає добре побудованого реакційного контейнера, який здатний витримувати велику кількість змін тиску, які трапляються в багатьох хімічних реакціях.
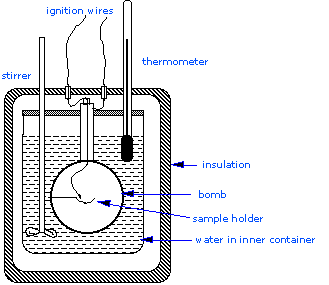
Найбільш серйозна калориметрія, проведена в дослідницьких лабораторіях\(\Delta H_{combustion}\), передбачає визначення теплоти згоряння, оскільки вони мають важливе значення для визначення стандартних ентальпій утворення тисяч нових сполук, які готуються та характеризуються щомісяця. У калориметрі постійного обсягу система герметична або ізольована від оточення, що пояснює, чому її обсяг фіксований і не проводиться робота об'ємно-тиску. Структура калориметра бомби складається з наступного:
- Сталева бомба, яка містить реагенти
- Водяна баня, в яку занурена бомба
- Термометр
- Моторизована мішалка
- Провід для розпалювання
Оскільки процес відбувається в постійному обсязі, реакційна посудина повинна бути побудована, щоб витримати високий тиск, що виникає в результаті процесу горіння, що становить обмежений вибух. Посудина прийнято називати «бомбою», а методика відома як бомба калориметрія. Реакція ініціюється розрядженням конденсатора через тонкий провід, який запалює суміш.
Ще одним наслідком умови постійного об'єму є те, що виділяється тепло відповідає\(q_v\), і, отже, зміні внутрішньої енергії,\(ΔU\) а не до\(ΔH\). Зміна ентальпії розраховується за формулою
\[ΔH = q_v + Δn_gRT\]
де\(Δn_g\) - зміна кількості молів газів в реакції.
Зразок біфенілу (\(\ce{(C6H5)2}\)) масою 0,526 г запалювали в калориметрі бомби спочатку при 25°C, виробляючи підвищення температури на 1,91 К. В окремому калібрувальному експерименті зразок бензойної кислоти (\(\ce{C6H5COOH}\)) масою 0,825 г запалювався в однакових умовах і виробляв підвищення температури на 1 .94 К. Для бензойної кислоти теплота згоряння при постійному обсязі, як відомо, дорівнює 3,226 кДж моль —1 (тобто Δ U = —3,226 кДж моль —1.) Використовуйте цю інформацію для визначення стандартної ентальпії горіння біфенілу.
Рішення
Почніть з відпрацювання константи калориметра:
- Кроти бензойної кислоти:
\[\dfrac{0.825 g}{122.1 \;g/mol} = 0.00676\; mol \nonumber\]
- Тепло, що виділяється на калориметр:
\[(0.00676\; mol) \times (3226\; kJ/mol) = 21.80\; kJ \nonumber\]
- Постійна калориметра:
\[\dfrac{21.80\; kJ}{1.94\; K} = 11.24\; kJ/K \nonumber\]
Тепер\(ΔU_{combustion}\) визначаємо дифеніл («АТ»):
- родимки дифенілу:
\[\dfrac{0.526\; g}{154.12\; g/mol} = 0.00341 \; mol \nonumber\]
- тепло, що виділяється на калориметр:
\[(1.91\; K) \times (11.24\; kJ/K) = 21.46\; kJ \nonumber\]
- тепло, що виділяється на моль дифенілу:
\[\dfrac{21.46\; kJ}{0.00341\; mol} = 6,293\; kJ/mol \nonumber\]
\[ΔU_{combustion} (BP) = –6,293\; kJ/mol \nonumber\]
Це зміна тепла при постійному обсязі,\(q_v\) негативний знак вказує на те, що реакція екзотермічна, як і всі реакції горіння.
З збалансованого рівняння реакції
\[\ce{(C6H5)2(s) + 29/2 O2(g) \rightarrow 12 CO2(g) + 5 H2O(l)} \nonumber\]
ми можемо обчислити зміну родимок газів для цієї реакції
\[Δn_g = 12 - \frac{29}{2} = \frac{-5}{2} \nonumber\]
Таким чином обсяг системи зменшується, коли відбувається реакція. Перетворивши в\(ΔH\), ми можемо записати наступне рівняння. Додатково нагадаємо, що при постійній гучності,\(ΔU = q_V\).
\[ \begin{align*} ΔH &= q_V + Δn_gRT \\[4pt] &= ΔU -\left( \dfrac{5}{2}\right) (8.314\; J\; mol^{-1}\; K^{-1}) (298 \;K) \\[4pt] &= (-6,293 \; kJ/mol)–(6,194\; J/mol) \\[4pt] &= (-6,293-6.2)\;kJ/mol \\[4pt] &= -6299 \; kJ/mol \end{align*} \]
Поширеною помилкою тут є забуття, що віднімається термін знаходиться в J, а не кДж. Зверніть увагу, що додаткові 6,2 кДж у\(ΔH\) порівнянні з\(ΔU\) відображає роботу, яку оточення виконують над системою, оскільки обсяг газів зменшується відповідно до рівняння реакції.
Визначення теплоти реакції
Кількість тепла, яке система віддає своєму оточенню, щоб вона могла повернутися до початкової температури, є теплотою реакції. Теплота реакції - це всього лише негатив теплової енергії, отриманої калориметром і його вмісту (\(q_{calorimeter}\)) через реакцію горіння.
\[q_{rxn} = -q_{calorimeter} \label{2A}\]
де
\[q_{calorimeter} = q_{bomb} + q_{water} \label{3A}\]
Якщо калориметр постійного обсягу налаштований так само, як і раніше, (та ж сталева бомба, однакова кількість води і т.д.), То теплоємність калориметра можна виміряти за такою формулою:
\[q_{calorimeter} = \text{( heat capacity of calorimeter)} \times \Delta{T} \label{4A}\]
Теплоємність визначається як кількість теплоти, необхідної для підвищення температури всього калориметра на 1 °С. Вищевказане рівняння також може бути використано для обчислення\(q_{rxn}\) за допомогою Equation\ ref {2A}.\(q_{calorimeter}\) Теплоємність калориметра можна визначити, провівши експеримент.
1,150 г сахарози проходить через горіння в калориметрі бомби. Якщо температура піднялася з 23,42 °С до 27,64 °С, а теплоємність калориметра становить 4,90 кДж/°С, то визначають теплоту згоряння сахарози,\(\ce{C12H22O11}\) (в кДж на моль\(\ce{C12H22O11}\)).
Рішення
Дано:
- маса\(C_{12}H_{22}O_{11}\): 1.150 г
- \(T_{initial}\): 23.42 °C
- \(T_{final}\): 27.64 °C
- Теплоємність калориметра: 4,90 кДж/° C
Використання рівняння\ ref {4A} для обчислення\(q_{calorimeter}\):
\[\begin{align*} q_{calorimeter} &= (4.90\; kJ/°C) \times (27.64 - 23.42)°C \\[4pt] &= (4.90 \times 4.22) \;kJ = 20.7\; kJ \end{align*}\]
Підключіть до рівняння\ ref {2A}:
\[\begin{align*} q_{rxn} &= -q_{calorimeter} \\[4pt] &= -20.7 \; kJ \; \end{align*}\]
Але питання задається кДж/моль\(\ce{C12H22O11}\), тому це потрібно перетворити:
\[\begin{align*}q_{rxn} &= \dfrac{-20.7 \; kJ}{1.150 \; g \; C_{12}H_{22}O_{11}} \\[4pt] &= \dfrac{-18.0 \; kJ}{g\; C_{12}H_{22}O_{11}} \end{align*}\]
Перетворити в за моль\(\ce{C12H22O11}\):
\[\begin{align*}q_{rxn} &= \dfrac{-18.0 \; kJ}{\cancel{g \; \ce{C12H22O11}}} \times \dfrac{342.3 \; \cancel{ g \; \ce{C12H22O11}}}{1 \; mol \; \ce{C12H22O11}} \\[4pt] &= \dfrac{-6.16 \times 10^3 \; kJ \;}{mol \; \ce{C12H22O11}} \end{align*}\]
«Крижаний калориметр»
Хоча калориметрія в принципі проста, її практика є дуже вимогливим мистецтвом, особливо коли застосовується до процесів, які відбуваються повільно або включають дуже невеликі зміни тепла, такі як проростання насіння. Калориметри можуть бути такими ж простими, як пінопластова кавова чашка, яка часто використовується в студентських лабораторіях. Калориметри дослідницького класу, здатні виявляти дрібні перепади температури, частіше займають стільниці або навіть цілі приміщення:
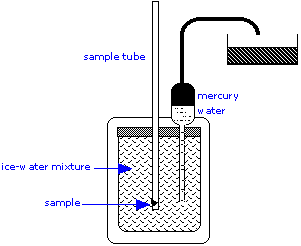
Калориметр льоду є важливим інструментом для вимірювання теплоємності рідин і твердих речовин, а також теплоти певних реакцій. Цей простий, але геніальний апарат по суті є приладом для вимірювання зміни об'єму внаслідок танення льоду. Для вимірювання теплоємності у внутрішній відсік поміщають теплий зразок, який оточений сумішшю льоду і води.
Тепло, що відводиться від зразка, коли він охолоджується, змушує частину льоду танути. Так як лід менш щільний, ніж вода, обсяг води в ізольованій камері зменшується. Це призводить до того, що еквівалентний обсяг ртуті всмоктується у внутрішній резервуар із зовнішнього контейнера. Втрата у вазі цієї ємності дає зменшення обсягу води, і, таким чином, маса льоду розтане. Це, у поєднанні з теплом плавлення льоду, дає кількість тепла, втраченого зразком, коли він охолоджується до 0° C.
