17.8: Термохімічні рівняння
- Page ID
- 19263
Опалення будинку стає все дорожче. Рішення використовувати газ, нафту, електрику або дрова може бути багатогранним. Частина рішення ґрунтується на тому, яке паливо забезпечить найбільший обсяг виділення енергії при згорянні. Дослідження термохімії можуть бути дуже корисними для отримання достовірної інформації для прийняття цих важливих виборів.
Термохімічне рівняння
При згорянні газу метану виділяється тепло, що робить реакцію екзотермічною. Зокрема, при\(1 \: \text{mol}\) згорянні метану виділяється 890,4 кілоджоуля теплової енергії. Цю інформацію можна показати як частину збалансованого рівняння:
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( l \right) + 890.4 \: \text{kJ}\nonumber \nonumber \]
Рівняння говорить нам, що\(1 \: \text{mol}\) метан поєднується\(2 \: \text{mol}\) з киснем для отримання\(1 \: \text{mol}\) вуглекислого газу та\(2 \: \text{mol}\) води. В процесі,\(890.4 \: \text{kJ}\) звільняється і так пишеться як продукт реакції. Термохімічне рівняння - це хімічне рівняння, яке включає в себе зміну ентальпії реакції. Процес в вищезгаданому термохімічному рівнянні можна наочно показати на малюнку нижче.
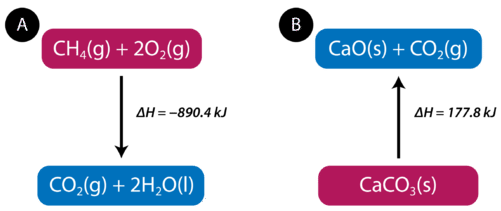
У прикладі спалювання метану зміна ентальпії є негативною, оскільки тепло виділяється системою. Тому загальна ентальпія системи знижується. Теплота реакції - це зміна ентальпії для хімічної реакції. У наведеному вище випадку теплота реакції є\(-890.4 \: \text{kJ}\). Термохімічна реакція також може бути записана таким чином:
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( l \right) \: \: \: \: \: \Delta H = -890.4 \: \text{kJ}\nonumber \nonumber \]
Теплоти реакції зазвичай вимірюються в кілоджоулі. Важливо включити фізичні стани реагентів і продуктів в термохімічне рівняння, так як величина їх\(\Delta H\) залежить від цих станів.
Ендотермічні реакції поглинають енергію з оточення в міру протікання реакції. Коли\(1 \: \text{mol}\) карбонат кальцію розкладається на\(1 \: \text{mol}\) оксид кальцію і\(1 \: \text{mol}\) вуглекислий газ, тепло\(177.8 \: \text{kJ}\) поглинається. Процес показаний наочно на малюнку вище (В). Термохімічна реакція показана нижче.
\[\ce{CaCO_3} \left( s \right) + 177.8 \: \text{kJ} \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\nonumber \nonumber \]
Оскільки тепло поглинається системою,\(177.8 \: \text{kJ}\) записується як реагент. Теплота реакції позитивна для ендотермічної реакції.
\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \: \: \: \Delta H = 177.8 \: \text{kJ}\nonumber \nonumber \]
Спосіб запису реакції впливає на значення зміни ентальпії для реакції. Багато реакцій є оборотними, що означає, що продукт (и) реакції здатний поєднувати та реформувати реагент (и). Якщо реакція пишеться в зворотному напрямку, то ознака\(\Delta H\) змін. Наприклад, можна написати рівняння реакції оксиду кальцію з вуглекислим газом з утворенням карбонату кальцію:
\[\ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \rightarrow \ce{CaCO_3} \left( s \right) + 177.8 \: \text{kJ}\nonumber \nonumber \]
Реакція екзотермічна і, таким чином, ознака зміни ентальпії негативна.
\[\ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \rightarrow \ce{CaCO_3} \left( s \right) \: \: \: \: \: \Delta H = -177.8 \: \text{kJ}\nonumber \nonumber \]
Резюме
- Термохімічне рівняння - це хімічне рівняння, яке включає в себе зміну ентальпії реакції.
- Теплота реакції - це зміна ентальпії для хімічної реакції.