14.4: Термохімія та калориметрія
- Page ID
- 19007
Переконайтеся, що ви добре розумієте наступні основні поняття:
- Напишіть збалансоване термохімічне рівняння, яке виражає зміну ентальпії для даної хімічної реакції. Обов'язково правильно конкретизуйте фізичний стан (а при необхідності і концентрацію) кожного компонента.
- Напишіть рівняння, яке визначає стандартну ентальпію утворення даного хімічного виду.
- Визначте стандартну зміну ентальпії хімічної реакції. Використовуйте таблицю стандартних ентальпій освіти для оцінки ΔH f°.
- Створіть принцип, від якого залежить закон Гесса, і поясніть, чому цей закон такий корисний.
- Опишіть простий калориметр і поясніть, як він використовується і як визначається його теплоємність.
Тепло, яке протікає через межі системи, що зазнає змін, є фундаментальною властивістю, яка характеризує процес. Він легко вимірюється, і якщо процес являє собою хімічну реакцію, що проводиться при постійному тиску, його також можна передбачити з різниці між ентальпіями продуктів і реагентів. Кількісне дослідження та вимірювання теплових та ентальпійних змін відоме як термохімія.
Термохімічні рівняння та стандартні стани
Для того, щоб визначити термохімічні властивості процесу, спочатку необхідно написати термохімічне рівняння, яке визначає фактичні зміни, що відбуваються, як з точки зору формул задіяних речовин, так і їх фізичних станів (температура, тиск, і тверде, рідке, або газоподібний.
Щоб взяти дуже простий приклад, ось повне термохімічне рівняння для випаровування води при її нормальній температурі кипіння:
\[\ce{H2O(\ell,\, 373 \,K, \,1 \,atm) → H2O(g, \,373 \,K, \,1 \,atm)} \,\,\,ΔH = 40.7\, kJ\, mol^{-1}\]
Кількість 40.7 відома як ентальпія випаровування (часто називають «теплотою випаровування») рідкої води. При написанні термохімічних рівнянь слід мати на увазі наступні моменти:
\(ΔH\)Будь-яка термодинамічна величина, така як ця, пов'язана з термохімічним рівнянням, завжди стосується кількості молів речовин, явно показаних у рівнянні. Таким чином, для синтезу води ми можемо написати
\[\ce{2 H2(g) + O2(g)→ 2 H2O(l) }\,\,\,ΔH = -572 \,kJ\]
або
\[\ce{H2(g) + 1/2 O2(g)→ H2O(l)} \,\,\, ΔH = -286 \,kJ\]
Термохімічні рівняння для реакцій, що відбуваються в розчині, також повинні вказувати концентрації розчинених видів. Наприклад, ентальпія нейтралізації сильної кислоти міцною основою дається
\[\ce{H^{+}(aq,\, 1M,\, 298\, K,\, 1\, atm) + OH^{-} (aq,\, 1M,\, 298 \,K,\, 1 \,atm) → H2O(\ell, 373\, K,\, 1 \,atm) } \,\,\, ΔH = -56.9\, kJ\, mol^{-1}\]
в якому абревіатура aq відноситься до гідратованих іонів, оскільки вони існують у водному розчині. Оскільки більшість термохімічних рівнянь записані для стандартних умов тиску 298 К і 1 атм, ми можемо залишити ці величини поза межами, якщо ці умови застосовуються як до, так і після реакції. Якщо при цих же умовах речовина знаходиться в своєму бажаному (найбільш стабільному) фізичному стані, то речовина, як кажуть, знаходиться в стандартному стані.
Таким чином, стандартний стан води при 1 атм є твердим речовиною нижче 0° C, а газ вище 100° C. термохімічна кількість, така як\(ΔH\) це відноситься до реагентів і продуктів у їх стандартних станах позначається\(ΔH^°\).
Концентрації проти ефективних концентрацій (діяльність)
У випадку розчинених речовин стандартним станом розчиненої речовини є те, в якому «ефективна концентрація», відома як активність, є єдністю. Для неіонних розчинених речовин активність та молярність зазвичай приблизно однакові для концентрацій приблизно до 1 М, але для іонного розчиненого речовини це наближення, як правило, справедливе лише для розчинів, більш розведених, ніж 0.001-0.01M, залежно від електричного заряду та розміру конкретного іона.
Стандартна ентальпія освіти
Зміна ентальпії для хімічної реакції - це різниця
\[ΔH = H_{products} - H_{reactants}\]
Якщо розглянута реакція являє собою утворення одного моля з'єднання з його елементів в їх стандартних станах, як в
\[\ce{H2(g) + 1/2O2(g) -> H2O(l)} \;\;\; ΔH = -286\; kJ\]
то ми можемо довільно встановити ентальпію елементів на нуль і записати
\[\begin{align*} H_f^o &= \sum H_f^o (products) - \sum H_f^o (reactants) \\[4pt] &= -286\; kJ - 0 \\[4pt] &= -268\; kJ \,mol^{-1} \end{align*}\]
що визначає стандартну ентальпію утворення води при 298 К. Значення H f° = -268 кДж говорить про те, що коли водень і кисень кожен при тиску 1 атм і при 298 К (25° С) реагують на утворення 1 моль рідкої води також при 25°C і тиску 1 атм, 268 кДж матиме передається з системи (реакційної суміші) в навколишнє середовище. Негативний знак говорить про те, що реакція екзотермічна: ентальпія продукту менше, ніж у реагентів. Стандартна ентальпія освіти - фундаментальна властивість будь-якого з'єднання. Таблиця T1 перераховує значення H f° (зазвичай поряд зі значеннями інших термодинамічних властивостей) в їх додатках.
Стандартна ентальпія утворення сполуки визначається як теплота, пов'язана з утворенням одного моля сполуки з його елементів в їх стандартних станах.
Загалом, стандартна зміна ентальпії для реакції задається виразом
\[ΔH_f^o= \sum H_f^o (products) - \sum H_f^o (reactants) \label{2-1}\]
в яких\(\sum H_f^o\) терміни вказують суми стандартних ентальпій утворень всіх продуктів і реагентів. Вищевказане визначення є одним з найважливіших у хімії, оскільки воно дозволяє прогнозувати зміну ентальпії будь-якої реакції, не знаючи більше, ніж стандартні ентальпії утворення продуктів та реагентів, які широко доступні в таблицях.
Наступні приклади ілюструють деякі важливі аспекти стандартної ентальпії утворення речовин.
Визначення термохімічного\(H_f^o\) рівняння завжди пишеться через один моль розглянутої речовини> Наприклад, термодинамічне рівняння реляванту для теплоти утворення аміаку (\(\ce{NH3}\)) становить:
\[\ce{ 1/2 N2(g) + 3/2 H2(g)→ NH3(g)}\,\,\, ΔH^o = -46.1\, kJ \,(\text{per mole of } \ce{NH3}) \nonumber\]
Стандартна теплота утворення з'єднання завжди приймається з урахуванням форм елементів, які найбільш стійкі при 25°C і тиску в 1 атм.
Ряд елементів, поширеними прикладами яких є сірка і вуглець, може існувати в більш ніж одній твердій кристалічній формі (званої аллотропами). Для діоксиду вуглецю (\(ce{CO2}\)можна побудувати два рівняння термодинаміки:
\[\ce{C(graphite) + O2(g) → CO2(g)}\,\,\, ΔH^o ≡ H_f^o = -393.5\, kJ\, mol^{-1} \nonumber\]
\[\ce{C(diamond) + O2(g) → CO2(g)}\,\,\, ΔH^{o} = -395.8\, kJ\, mol^{-1} \nonumber\]
Однак для вуглецю графітова форма є більш стійкою формою і правильними термодинамічними рівняннями для теплоти освіти.
Фізичний стан продукту реакції освіти має бути вказано явно, якщо він не є найбільш стабільним при 25°C і тиску 1 атм:
\[\ce{H2(g) + 1/2 O2(g) → H2O(aq)}\,\,\, ΔH^o ≡ H_f^o = -285.8\, kJ\, mol^{-1} \nonumber\]
\[\ce{H2(g) + 1/2 O2(g) → H2O(g)} \,\,\, ΔH^o = -241.8\, kJ\, mol^{-1} \nonumber\]
Зверніть увагу, що різниця між цими двома\(ΔH^o\) значеннями - це всього лише теплота випаровування води.
Хоча утворення більшості молекул з їх елементів є екзотермічним процесом, утворення деяких сполук носить м'який ендотермічний характер:
\[\ce{1/2 N2(g) + O2(g) -> NO2(g)}\,\,\, ΔH^o ≡ H_f^° = +33.2\, kJ\, mol^{-1} \nonumber\]
Позитивна теплота утворення часто пов'язана з нестабільністю - тенденцією молекули до розкладання на її елементи, хоча сама по собі це не є достатньою причиною. Однак у багатьох випадках швидкість цього розкладання по суті дорівнює нулю, тому речовина все ще можливо існувати. У зв'язку з цим варто відзначити, що всі молекули стануть нестабільними при більш високих температурах.
Термохімічні реакції, що визначають теплоту утворення більшості сполук, насправді не можуть відбуватися. Наприклад, безпосередній синтез метану з його елементів
\[\ce{C(graphite) + 2 H2(g) → CH4(g)} \nonumber\]
неможливо спостерігати безпосередньо через велику кількість інших можливих реакцій між цими двома елементами. Однак стандартні зміни ентальпії для такої реакції можна знайти побічно з інших даних, як пояснено в наступному розділі.
Стандартна ентальпія утворення газоподібних атомів з елемента відома як теплота розпилення.
Нагрівання атомізації завжди позитивні, і важливі при розрахунку енергій зв'язку.
\[\ce{Fe(s) → Fe(g)}\,\, ΔH° = 417 \,kJ\, mol^{-1} \nonumber\]
Стандартна ентальпія утворення іона, розчиненого у воді, виражається в окремій шкалі, в якій\(\ce{H^{+}(aq)}\) це визначається як нуль.
Стандартна теплота утворення розчиненого іона, такого як\(\ce{Cl^{-}(aq)}\) (тобто утворення іона з елемента) не може бути виміряна, оскільки неможливо мати розчин, що містить єдиний вид іона. З цієї причини іонні ентальпії виражаються в окремій шкалі, за якою\(\ce{H_f^o}\) з іонів водню при одиничній активності (ефективна концентрація 1 М) визначається як нуль:
\[\ce{1/2 H2(g) → H^{+}(aq)}\,\,\, ΔH^o ≡ H_f^o = 0\, kJ\, mol^{-1} \nonumber\]
Інші іонні ентальпії (як вони загальновідомі) знаходять шляхом поєднання відповідних термохімічних рівнянь (як пояснено в розділі 3 нижче). Наприклад, H f° HCl (aq) виявляється з ентальпій освіти і розчину HCl (g), що дає
\[\ce{1/2 H2(g) + 1/2 Cl2(g) → HCl(aq)}\,\,\,\ ΔH^o ≡ H_f^o = -167\, kJ\, mol^{-1} \nonumber\]
Оскільки H f° для H + (aq) дорівнює нулю, це значення встановлює стандартну ентальпію хлорид-іона. Стандартна ентальпія утворення Ca 2+ (aq), задана
\[\ce{Ca(s) + Cl2(g) -> CaCl2(aq)} \nonumber\]
потім можна було б обчислити, об'єднавши інші вимірні величини, такі як ентальпії утворення та рішення,\(\ce{CaCl2(s)}\) щоб знайти H f° для CaCl 2 (aq), з яких H f°\(\ce{Ca^{2+}(aq)}\) знаходиться за різницею від \(\ce{Cl^{-}(aq)}\). Таблиці одержуваних іонних ентальпій широко доступні (див. Тут).
Закон Гесса та термохімічні розрахунки
Два або більше хімічних рівнянь можуть бути об'єднані алгебраїчно, щоб дати нове рівняння. Ще до того, як наука про термодинаміку розвинулася в кінці дев'ятнадцятого століття, було помічено, що спеки, пов'язані з хімічними реакціями, можуть поєднуватися однаково для отримання тепла іншої реакції. Наприклад, стандартні зміни ентальпії для окислення графіту та алмазу можуть бути об'єднані для отримання ΔH° для перетворення між цими двома формами твердого вуглецю, реакцію, яку неможливо вивчити експериментально.
\[\ce{C(graphite) + O2(g)→ CO2(g)}\,\,\, ΔH^o = -393.51\, kJ\, mol^{-1}\]
\[\ce{C(diamond) + O2(g)→ CO2(g)} \,\,\, ΔH^o = -395.40\, kJ\, mol^{-1}\]
Віднімання другої реакції від першої (тобто запис другого рівняння в зворотному напрямку і додавання його до першої) дає
\[\ce{C(graphite) → C(diamond)}\,\,\, ΔH^{°} = 1.89\, kJ\, mol^{-1}\]
Цей принцип, відомий як закон Гесса незалежного підсумовування тепла, є прямим наслідком того, що ентальпія є функцією стану. Закон Гесса є одним з найпотужніших інструментів хімії, оскільки дозволяє прогнозувати зміну ентальпії (та інших термодинамічних функцій) величезної кількості хімічних реакцій на основі відносно невеликої бази експериментальних даних.
Жермен Анрі Гесс
Жермен Анрі Гесс (1802-1850) був швейцарським професором хімії в Санкт-Петербурзі, Росія. Він сформулював свій знаменитий закон, який відкрив емпіричним шляхом, в 1840 році. Дуже мало відомо про його іншу роботу в хімії.
Стандартні ентальпії горіння
Оскільки більшість речовин не можуть бути отримані безпосередньо з їх елементів, теплоти утворення сполук рідко визначаються прямим вимірюванням. Натомість закон Гесса застосовується для обчислення ентальпій формування з більш доступних даних. Найважливішими з них є стандартні ентальпії горіння. Більшість елементів і сполук поєднуються з киснем, і багато з цих окислень є дуже екзотермічними, що робить вимірювання їх нагрівання відносно легким. Наприклад, поєднуючи теплоти згоряння вуглецю, водню та метану, ми можемо отримати стандартну ентальпію утворення метану, яку, як ми зазначали вище, неможливо визначити безпосередньо (приклад\(\PageIndex{1}\)).
Використовуйте наступну теплоту інформації утворення/згоряння для оцінки стандартної теплоти утворення метану\(\ce{CH4}\).
\[\begin{aligned} \ce{C(graphite)} + \ce{O2(g)} &→ \ce{CO2(g)} \quad &ΔH° = -393\, kJ\, mol^{-1} \label{P1-1} \\[4pt] \ce{H2(g)} + \ce{1/2 O2(g)} &→ \ce{H2O(g)} \quad &ΔH° = -286 kJ mol^{-1} \label{P1-2} \\[4pt] \ce{CH4(g)} + \ce{2O2(g)} &→ \ce{CO2(g)} + \ce{2H2O(g)} \quad &ΔH^o = -890\, kJ\, mol^{-1} \label{P1-3} \end{aligned}\]
Рішення
Стандартна теплота утворення метану визначається реакцією
\[\ce{C(graphite) + 2H2(g) → CH4(g)} \quad ΔH^o = ? \label{P1-4}\]
Наше завдання полягає в тому, щоб об'єднати три верхніх рівняння таким чином, щоб вони складалися до (4).
Крок 1
Почніть з того, що (3), спалювання метану, є єдиним рівнянням, яке містить член СН 4, тому нам потрібно записати його в зворотному порядку (не забуваючи повернути знак Δ Н°!) так що CH 4 виступає як продукт.
\[\ce{CO2(g) + 2H2O(g) → CH4(g) + 2O2(g)} \quad ΔH^o = +890\, kJ\, mol^{-1} \label{P1-3Rev}\]
Крок 2
Оскільки H 2 O не з'являється в чистої реакції (4), додайте два рази (2), щоб скасувати їх. Зверніть увагу, що це також скасовує один з кисню в (3Rev):
СО 2 (г) + 2Н 2 О (г) → СН 4 (г) + 2 О 2 (г) Δ Н° = +890 кДж моль -1 (Р1-3об)
→ 2Н 2 О (г) Δ Н° = -484 кДж моль -1 (Р1-2)
Крок 3
Нарешті, позбудьтеся від решти O 2 і CO 2, додавши (1); це також додає необхідний C:
→ СН 4 (г) + 2О 2 (г) Δ Н° = +890 кДж моль -1 (Р1-3Об)→ 2Н 2 О (г) Δ Н° = -572 кДж моль -1 (Р1-2)
→ СО 2 (г) Δ Н° = -393 кДж моль -1 (Р1-1)
Крок 4
Тож наше творче скасування усунуло всі, крім речовин, які з'являються в (4). Просто складіть зміни ентальпії, і ми зробили:
\[\ce{C(graphite) + 2H2(g) → CH4(g)} \]
(Табличне значення -74,6 кДж моль -1)
Калориметрія: вимірювання Δ H в лабораторії
Як експериментально визначаються зміни ентальпії? По-перше, ви повинні розуміти, що єдиною тепловою величиною, яку можна спостерігати безпосередньо, є тепло q, яке надходить в реакційну посудину або з нього, і що q чисельно дорівнює Δ Н° тільки за особливої умови постійного тиску. Більше того, q дорівнює стандартній зміні ентальпії лише тоді, коли реагенти та продукти мають однакову температуру, зазвичай 25° C Вимірювання q, як правило, відоме як калориметрія.
Найбільш поширені типи калориметрів містять відому кількість води, яка поглинає тепло, що виділяється реакцією. Оскільки питома теплоємність води (4,184 Дж г -1 К -1) відома з високою точністю, вимірювання її підвищення температури за рахунок реакції дозволяє обчислити кількість виділеного тепла.
У всіх, крім найпростіших калориметрів, частина тепла, що виділяється реакцією, поглинається компонентами самого калориметра. Тому необхідно «калібрувати» калориметр, вимірюючи зміну температури, що виникає в результаті введення відомої кількості тепла. Отриману константу калориметра, виражену в J K -1, можна розцінювати як «теплоємність калориметра». Відомий джерело тепла зазвичай виробляється шляхом пропускання відомої кількості електричного струму через резистор всередині калориметра, але його можна виміряти іншими способами, як описано в наступному прикладі проблеми.
При визначенні теплоємності калориметра студент змішує 100,0 г води при 57,0 °С з 100,0 г води, вже в калориметрі, при 24,2°С. (питома теплоємність води 4,184 Дж г -1 К -1). Після змішування і теплового врівноваження за допомогою калориметра температура води стабілізується на рівні 38,7°С, розраховуємо теплоємність калориметра в Дж/К.
Рішення
Гаряча вода втрачає тепло, холодна вода отримує тепло, а сам калориметр отримує тепло, тому це, по суті, проблема теплового балансу. Збереження енергії вимагає, щоб
\[q_{hot} + q_{cold} + q_{cal} = 0 \nonumber\]
Перші два терміни ми можемо оцінити за спостережуваними перепадами температур:
\[q_{hot} = (100\; g) (38.7\;K - 57.0\;K) (4.184\; J \;g^{-1}K^{-1}) = -7,657\; J \nonumber\]
\[q_{cold} = (100\; g) (38.7 \;K - 24.2 \;K) (4.184\; J\; g^{-1} K^{-1}) = 6,067\; J \nonumber\]
Так
\[q_{cal} = 7,657 \;J - ,6067\; J = 1,590;\ J \nonumber\]
Постійна калориметра дорівнює
\[\dfrac{1590\; J}{38.7\; K - 24.2\; K} = 110\; J\; K^{-1} \nonumber\]
Примітка: Строго кажучи, існує четвертий термін теплового балансу, який необхідно враховувати в високоточному розрахунку: вода в калориметрі розширюється в міру нагрівання, виконуючи роботу над атмосферою.
Для реакцій, які можуть бути ініційовані об'єднанням двох розчинів, підвищення температури самого розчину може забезпечити приблизне значення ентальпії реакції, якщо припустити, що теплоємність розчину близька до теплоємності чистої води - що буде майже вірним, якщо розчини розбавлені.
Наприклад, дуже просте калориметричне визначення стандартної ентальпії реакції
\[\ce{H^{+}(aq) + OH^{-}(aq) → H2O(\ell)} \nonumber\]
може здійснюватися шляхом об'єднання рівних обсягів 0,1 М розчинів HCl і NaOH спочатку при 25°C, оскільки ця реакція є екзотермічною, то в розчин буде виділятися кількість тепла q. Від підвищення температури і питомої теплоти води отримуємо кількість джоулів тепла, що виділяється в кожен грам розчину, а q потім можна обчислити з маси розчину. Так як весь процес здійснюється при постійному тиску, то маємо Δ H° = q.
Для реакцій, які не можуть бути проведені в розведеному водному розчині, реакційний посудину зазвичай поміщають у більшу ізольовану ємність з водою. Під час реакції тепло проходить між внутрішньою і зовнішньою ємностями, поки їх температури не стануть ідентичними. Знову ж таки, спостерігається зміна температури води, але в цьому випадку нам потрібно знати величину константи калориметра, описану вище.
Калориметр бомби
\(\Delta H_{combustion}\), оскільки вони мають важливе значення для визначення стандартних ентальпій утворення тисяч нових сполук, які готуються та характеризуються щомісяця. У калориметрі постійного обсягу система герметична або ізольована від оточення, і це пояснює, чому її обсяг фіксований і не проводиться робота об'ємно-тиску. Структура калориметра бомби складається з наступного:- Сталева бомба, яка містить реагенти
- Водяна баня, в яку занурена бомба
- Термометр
- Моторизована мішалка
- Провід для розпалювання
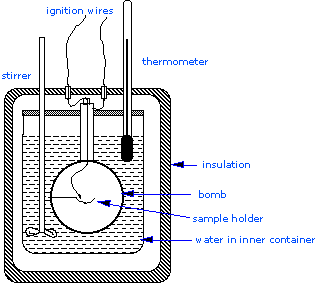
Оскільки процес відбувається в постійному обсязі, реакційний резервуар повинен бути побудований, щоб витримати високий тиск, що виникає в результаті процесу горіння, що становить обмежений вибух. Посудина зазвичай називають «бомбою», а методика відома як бомба калориметрія. Реакція ініціюється розрядженням конденсатора через тонкий провід, який запалює суміш.
Іншим наслідком умови постійного об'єму є те, що виділяється тепло відповідає q v, і, таким чином, зміні внутрішньої енергії Δ U, а не Δ H. Зміна ентальпії розраховується за формулою
\[ΔH = q_v + Δn_gRT\]
- \(Δn_g\)це зміна кількості молів газів в реакції.
Пробу дифенілу (С 6 Н 5) 2 масою 0,526 г запалювали в калориметрі бомби спочатку при 25°C, виробляючи підвищення температури 1,91 К. В окремому калібрувальному експерименті була запалена проба бензойної кислоти С 6 Н 5 СООН масою 0,825 г при однакових умовах і виробляється підвищення температури 1,94 К. Для бензойної кислоти теплота згоряння при постійному тиску, як відомо, дорівнює 3226 кДж моль -1 (тобто Δ U = -3226 кДж моль -1.) Використовуйте цю інформацію для визначення стандартної ентальпії горіння біфенілу.
Рішення
Почніть з відпрацювання константи калориметра:
- Кроти бензойної кислоти:
\[\dfrac{(0.825 g}{122.1 \;g/mol} = 0.00676\; mol\]
- Тепло, що виділяється на калориметр:
\[(0.00676\; mol) \times (3226\; kJ/mol) = 21.80\; kJ\]
- Постійна калориметра:
\[\dfrac{21.80\; kJ}{1.94\; K} = 11.24\; kJ/K\]
Тепер\(ΔU_{combustion}\) визначаємо дифеніл («АТ»):
- родимки дифенілу:
\[\dfrac{0.526\; g}{154.12\; g/mol} = 0.00341 \; mol\]
- тепло, що виділяється на калориметр:
\[(1.91\; K) \times (11.24\; kJ/K) = 21.46\; kJ\]
- тепло, що виділяється на моль дифенілу:
\[\dfrac{21.46\; kJ}{0.00341\; mol} = 6,293\; kJ/mol\]
\[ΔU_{combustion} (BP) = -6,293\; kJ/mol\]
(Це зміна тепла при постійному обсязі,\(q_v\) негативний знак вказує на те, що реакція екзотермічна, як і всі реакції горіння.)
З рівняння реакції
\[(C_6H_5)_{2(s)} + \frac{19}{2} O_{2(g)} \rightarrow 12 CO_{2(g)} + 5 H_2O_{(l)}\]
у нас є
\[Δn_g = 12 - \frac{19}{2} = \frac{-5}{2}\]
Таким чином обсяг системи зменшується, коли відбувається реакція. Перетворивши в Δ H, ми можемо записати наступне рівняння. Додатково нагадаємо, що при постійній гучності,\(ΔU = q_V\).
\[ΔH = q_V + Δn_gRT \]
\[ΔH = ΔU -\left( \dfrac{5}{2}\right) (8.314\; J\; mol^{-1}\; K^{-1}) (298 \;K)= \]
\[ ΔH=(-6,293 \; kJ/mol)-(6,194\; J/mol)=(-6,293-6.2)\;kJ/mol= -6299 \; kJ/mol\]
Поширеною помилкою тут є забуття, що віднімається термін знаходиться в J, а не kJ. Зверніть увагу, що додаткові 6,2 кДж у\(ΔH\) порівнянні з\(ΔU\) відображає роботу, яку оточення виконують над системою, оскільки обсяг газів зменшується відповідно до рівняння реакції.
Визначення теплоти реакції
Кількість тепла, яке система віддає своєму оточенню, щоб вона могла повернутися до початкової температури, є теплотою реакції. Теплота реакції - це всього лише негатив теплової енергії, отриманої калориметром і його вмісту (\(q_{calorimeter}\)) через реакцію горіння.
\[q_{rxn} = -q_{calorimeter} \label{2A}\]
де
\[q_{calorimeter} = q_{bomb} + q_{water} \label{3A}\]
Якщо калориметр постійного обсягу налаштований так само, як і раніше, (та ж сталева бомба, однакова кількість води і т.д.), То теплоємність калориметра можна виміряти за такою формулою:
\[q_{calorimeter} = \text{( heat capacity of calorimeter)} \times \Delta{T} \label{4A}\]
Теплоємність визначається як кількість теплоти, необхідної для підвищення температури всього калориметра на 1 °С. Вищевказане рівняння також може бути використано для обчислення\(q_{rxn}\) за\(q_{calorimeter}\) рівнянням 2. Теплоємність калориметра можна визначити, провівши експеримент.
1,150 г сахарози проходить через горіння в калориметрі бомби. Якщо температура піднялася з 23,42°С до 27,64°С, а теплоємність калориметра становить 4,90 кДж/°С, то визначають теплоту згоряння сахарози\(C_{12}H_{22}O_{11}\), в кДж на моль\(C_{12}H_{22}O_{11}\).
Дано:
- маса\(C_{12}H_{22}O_{11}\): 1.150 г
- \(T_{initial}\): 23.42 °C
- \(T_{final}\): 27.64 °C
- Теплоємність калориметра: 4,90 кДж/° C
Рішення
Використання рівняння 4 для обчислення\(q_{calorimeter}\):
\[q_{calorimeter} = (4.90\; kJ/°C) \times (27.64 - 23.42)°C = (4.90 \times 4.22) \;kJ = 20.7\; kJ \]
Підключіть до рівняння 2:
\(q_{rxn} = -q_{calorimeter} = -20.7 \; kJ \;\)
Але питання задається кДж/моль\(C_{12}H_{22}O_{11}\), тому це потрібно перетворити:
\(q_{rxn} = \dfrac{-20.7 \; kJ}{1.150 \; g \; C_{12}H_{22}O_{11}} = \dfrac{-18.0 \; kJ}{g\; C_{12}H_{22}O_{11}}\)
За моль\(C_{12}H_{22}O_{11}\):
\(q_{rxn} = \dfrac{-18.0 \; kJ}{g \; C_{12}H_{22}O_{11}} \times \dfrac{342.3 \; g \; C_{12}H_{22}O_{11}}{1 \; mol \; C_{12}H_{22}O_{11}} = \dfrac{-6.16 \times 10^3 \; kJ \;}{mol \; C_{12}H_{22}O_{11}}\)
калориметри
Хоча калориметрія в принципі проста, її практика є дуже вимогливим мистецтвом, особливо коли застосовується до процесів, які відбуваються повільно або включають дуже невеликі зміни тепла, такі як проростання насіння. Калориметри можуть бути такими ж простими, як пінопластова кавова чашка, яка часто використовується в студентських лабораторіях. Калориметри дослідницького класу, здатні виявляти дрібні перепади температури, частіше займають стільниці або навіть цілі приміщення:
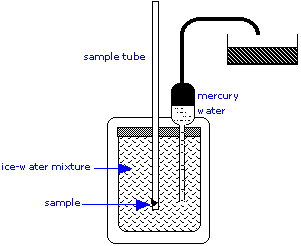
Калориметр льоду є важливим інструментом для вимірювання теплоємності рідин і твердих речовин, а також теплоти певних реакцій. Цей простий, але геніальний апарат по суті є приладом для вимірювання зміни об'єму внаслідок танення льоду. Для вимірювання теплоємності у внутрішній відсік поміщають теплий зразок, який оточений сумішшю льоду і води.
Тепло, що відводиться від зразка, коли він охолоджується, змушує частину льоду танути. Так як лід менш щільний, ніж вода, обсяг води в ізольованій камері зменшується. Це призводить до того, що еквівалентний обсяг ртуті всмоктується у внутрішній резервуар із зовнішнього контейнера. Втрата у вазі цієї ємності дає зменшення обсягу води, і, таким чином, маса льоду розтане. Це, у поєднанні з теплом плавлення льоду, дає кількість тепла, втраченого зразком, коли він охолоджується до 0° C.
