17.3: Стандартні потенціали скорочення
- Page ID
- 22465
- Визначення стандартних потенціалів клітин для окислювально-відновних реакцій
- Використовуйте стандартні потенціали відновлення для визначення кращого окислювача або відновника з декількох можливих варіантів
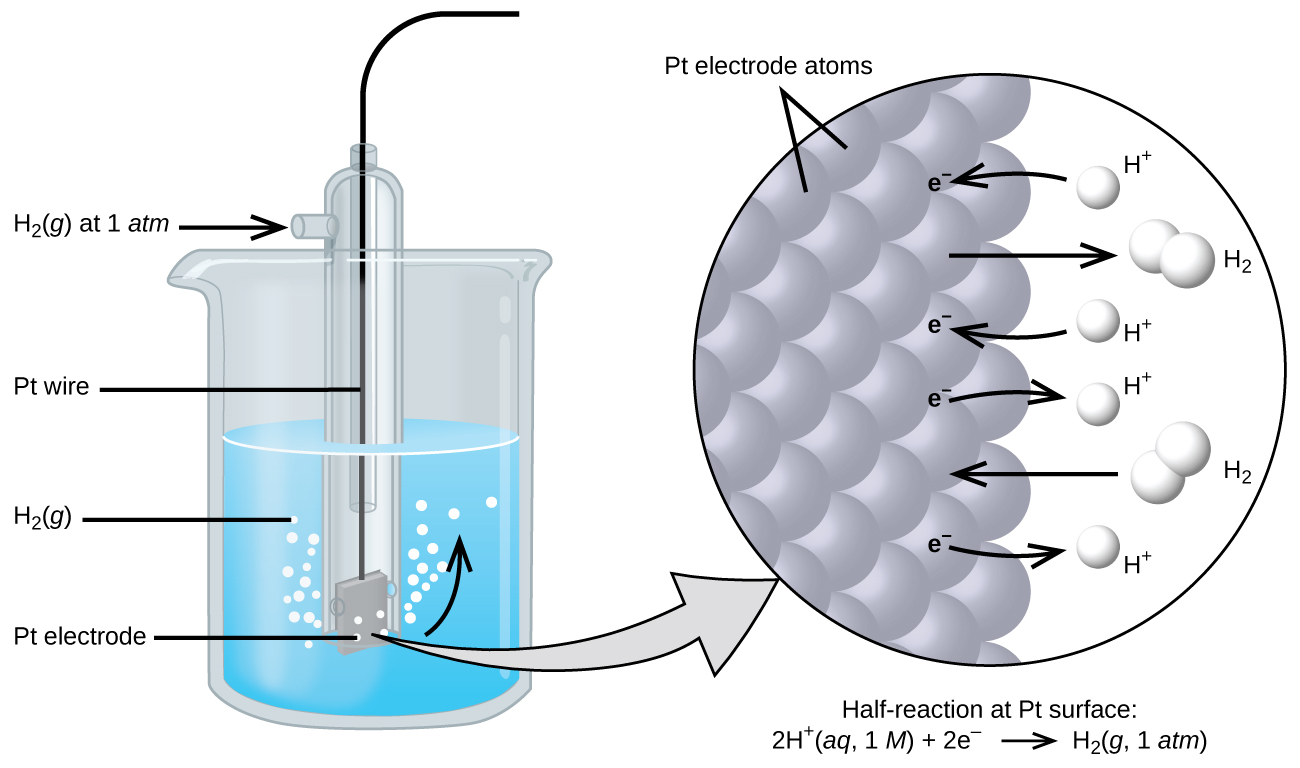
Потенціал клітини є результатом різниці електричних потенціалів для кожного електрода. Поки неможливо визначити електричний потенціал одного електрода, ми можемо призначити електроду значення нуля і потім використовувати його в якості орієнтиру. Електрод, обраний в якості нуля, показаний на малюнку 17.4.1 і називається стандартним водневим електродом (SHE). SHE складається з 1 атм водневого газу, бульбашкового через 1 М розчину HCl, зазвичай при кімнатній температурі. В якості електрода використовується платина, яка хімічно інертна. Редукційна напівреакція, обрана як еталонна
\[\ce{2H+}(aq,\: 1\:M)+\ce{2e-}⇌\ce{H2}(g,\:1\: \ce{atm}) \hspace{20px} E°=\mathrm{0\: V} \nonumber \]
E° - стандартний потенціал зниження. Верхній індекс «°» на Е позначає стандартні умови (1 бар або 1 атм для газів, 1 М для розчинених речовин). Напруга визначається як нуль для всіх температур.
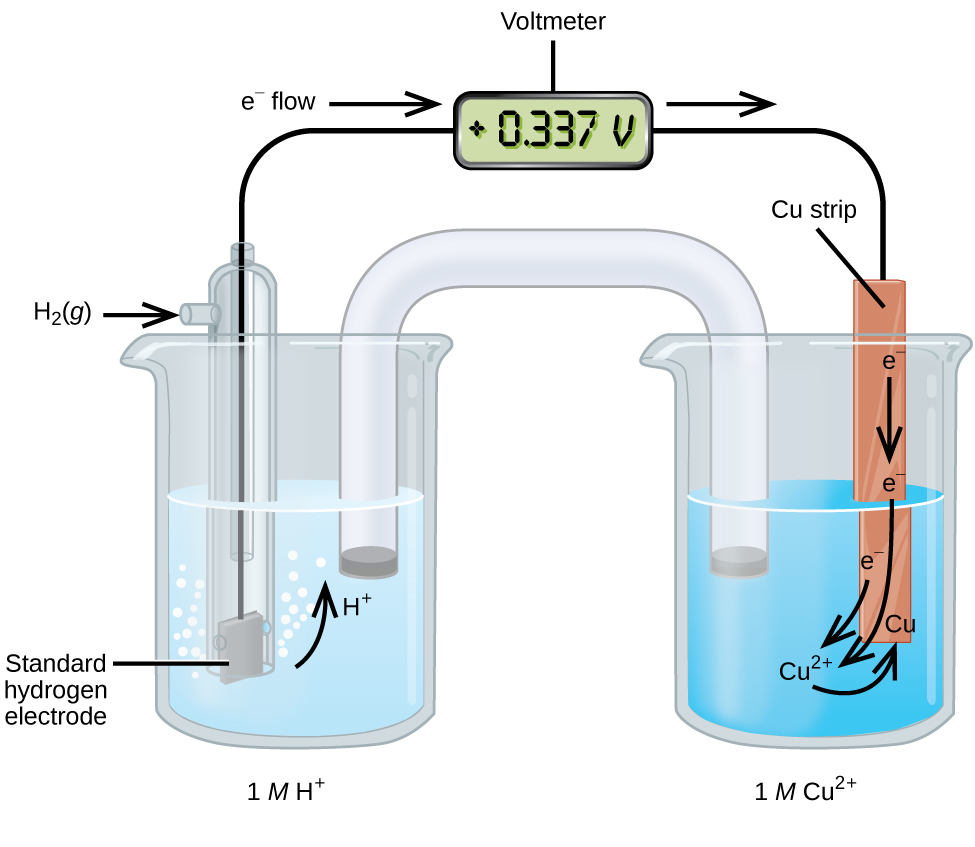
Гальванічний елемент, що складається з напівелемента SHE і Cu 2 + /Cu, може бути використаний для визначення стандартного потенціалу відновлення для Cu 2 + (рис.\(\PageIndex{2}\)). У клітинних позначеннях реакція
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\:1\:M)║\ce{Cu^2+}(aq,\:1\:M)│\ce{Cu}(s) \nonumber \]
Електрони надходять від анода до катода. Реакції, які є оборотними, є
\ [\ почати {вирівнювати*}
&\ textrm {Анод (окислення):}\ ce {H2} (г) ⟶\ ce {2H+} (aq) +\ ce {2e-}\\
&\ textrm {Катод (зменшення):}\ ce {Cu^2+} (aq) +\ ce {2e-} ⟶\ ce {Cu} (с)\\
оверлайн {\ textrm {Загальний:}\ ce {Cu^2+} (aq) +\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {Cu} (s)}
\ кінець {вирівнювати* }\ номер\]
Стандартний потенціал відновлення можна визначити, віднімаючи стандартний потенціал відновлення реакції, що протікає на аноді, із стандартного потенціалу відновлення реакції, що протікає на катоді. Знак мінус необхідний тому, що окислення є зворотним відновленням.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.34\: V}=E^\circ_{\ce{Cu^2+/Cu}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Cu^2+/Cu}}−0=E^\circ_{\ce{Cu^2+/Cu}} \nonumber \]
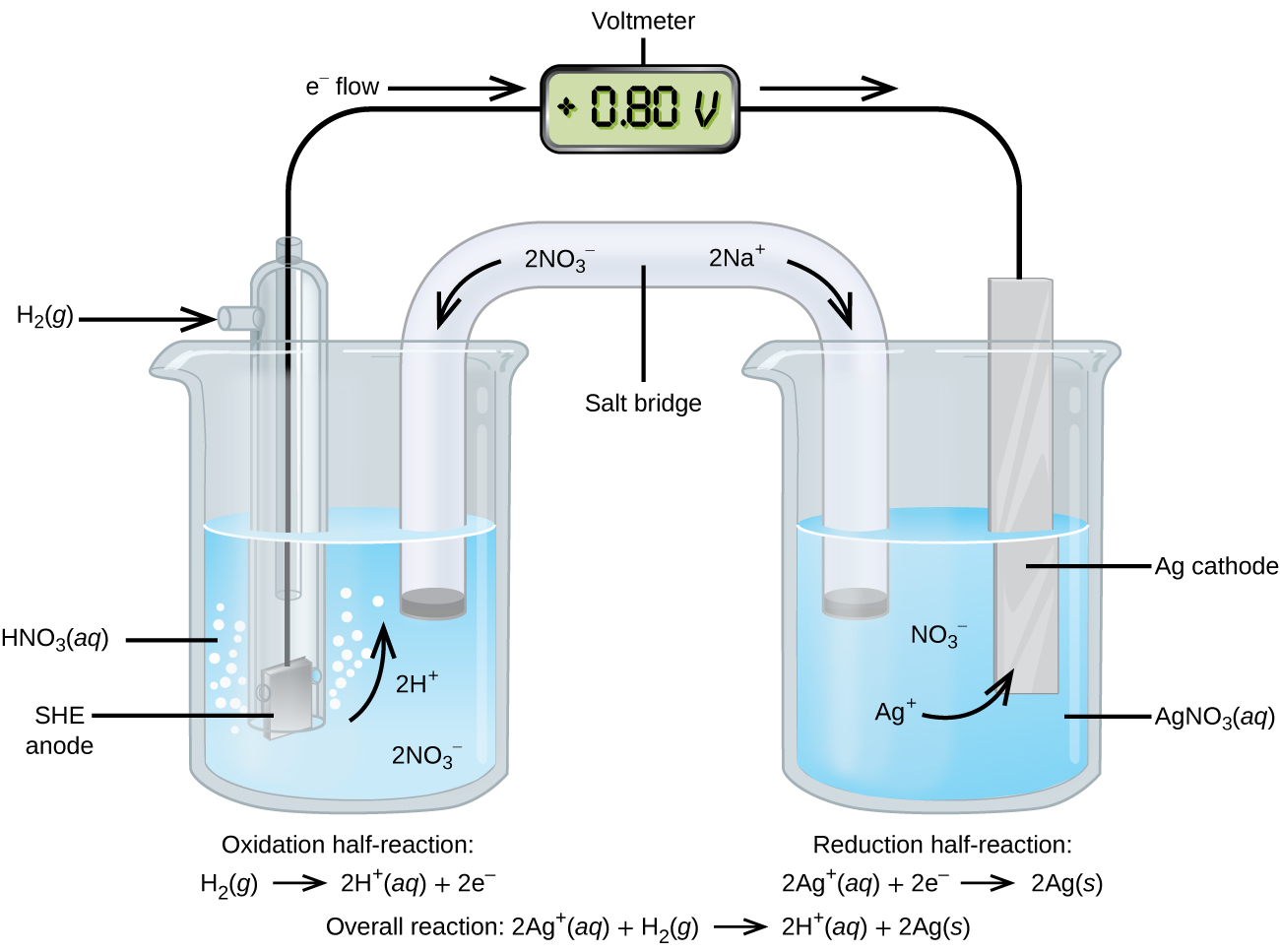
Використовуючи SHE як еталон, можна визначити інші стандартні потенціали відновлення. Розглянемо осередок, зображену на малюнку\(\PageIndex{2}\), де
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Електрони течуть зліва направо, а реакції
\ [\ почати {вирівнювати*}
&\ textrm {анод (окислення):}\ ce {H2} (г) ⟶\ ce {2H+} (aq) +\ ce {2e-}\\
&\ textrm {катод (зменшення):}\ ce {2Ag+} (q) +\ ce {2e-} ⟶\ ce {2Ag} (s)\\
оверлайн {\ textrm {загальний:}\ ce {2Ag+} (q) +\ ce {H2} (g) ⟶\ ce {2H+} (aq) +\ ce {2Ag} (s)}
\ кінець {вирівнювати*} \ номер\]
Стандартний потенціал відновлення можна визначити, віднімаючи стандартний потенціал відновлення реакції, що протікає на аноді, із стандартного потенціалу відновлення реакції, що протікає на катоді. Знак мінус потрібен тому, що окислення є зворотним відновленням.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.80\: V}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Ag+/Ag}}−0=E^\circ_{\ce{Ag+/Ag}} \nonumber \]
Важливо відзначити, що потенціал не подвоюється для реакції катода.
Вона досить небезпечна і рідко використовується в лабораторії. Його основне значення полягає в тому, що він встановив нуль для стандартних відновних потенціалів. Після визначення стандартних потенціалів відновлення можна використовувати для визначення стандартного потенціалу клітини для будь-якої клітини.\(E^\circ_\ce{cell}\) Наприклад, для наступної осередку:
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\:1\:M)║\ce{Ag+}(aq,\:1\:M)│\ce{Ag}(s) \nonumber \]
\ [\ почати {вирівнювати*}
&\ textrm {анод (окислення):}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ textrm {катод (зменшення):}\ ce {2Ag+} (q) +\ ce {2e-} ⟶\ ce {2Ag} (s)\
&\ оверлайн {\ textrm {загальний:}\ ce {Cu} (и) +\ ce {2Ag+} (aq) ⟶\ ce {Cu^2+} (aq) +\ ce {2Ag} (s)}
\ кінець { вирівнювати*}\ nonumber\]
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{Cu^2+/Cu}}=\mathrm{0.80\: V−0.34\: V=0.46\: V} \nonumber \]
Знову ж таки, зверніть увагу\(E^\circ_\ce{cell}\), що при розрахунку стандартні відновні потенціали завжди залишаються незмінними навіть тоді, коли напівреакція множиться на коефіцієнт. Стандартні відновні потенціали для обраних реакцій відновлення наведені в табл\(\PageIndex{1}\). Більш повний список наведено в таблицях P1 або P2.
| Половинна реакція | Е° (V) |
|---|---|
| \(\ce{F2}(g)+\ce{2e-}⟶\ce{2F-}(aq)\) | +2.866 |
| \(\ce{PbO2}(s)+\ce{SO4^2-}(aq)+\ce{4H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)\) | +1.69 |
| \(\ce{MnO4-}(aq)+\ce{8H+}(aq)+\ce{5e-}⟶\ce{Mn^2+}(aq)+\ce{4H2O}(l)\) | +1.507 |
| \(\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s)\) | +1.498 |
| \(\ce{Cl2}(g)+\ce{2e-}⟶\ce{2Cl-}(aq)\) | +1.35827 |
| \(\ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-}⟶\ce{2H2O}(l)\) | +1.229 |
| \(\ce{Pt^2+}(aq)+\ce{2e-}⟶\ce{Pt}(s)\) | +1.20 |
| \(\ce{Br2}(aq)+\ce{2e-}⟶\ce{2Br-}(aq)\) | +1.0873 |
| \(\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)\) | +0,7996 |
| \(\ce{Hg2^2+}(aq)+\ce{2e-}⟶\ce{2Hg}(l)\) | +0.7973 |
| \(\ce{Fe^3+}(aq)+\ce{e-}⟶\ce{Fe^2+}(aq)\) | +0.771 |
| \(\ce{MnO4-}(aq)+\ce{2H2O}(l)+\ce{3e-}⟶\ce{MnO2}(s)+\ce{4OH-}(aq)\) | +0.558 |
| \(\ce{I2}(s)+\ce{2e-}⟶\ce{2I-}(aq)\) | +0.535 |
| \(\ce{NiO2}(s)+\ce{2H2O}(l)+\ce{2e-}⟶\ce{Ni(OH)2}(s)+\ce{2OH-}(aq)\) | +0.49 |
| \(\ce{Cu^2+}(aq)+\ce{2e-}⟶\ce{Cu}(s)\) | +0.34 |
| \(\ce{Hg2Cl2}(s)+\ce{2e-}⟶\ce{2Hg}(l)+\ce{2Cl-}(aq)\) | +0,26808 |
| \(\ce{AgCl}(s)+\ce{e-}⟶\ce{Ag}(s)+\ce{Cl-}(aq)\) | +0,22233 |
| \(\ce{Sn^4+}(aq)+\ce{2e-}⟶\ce{Sn^2+}(aq)\) | +0.151 |
| \(\ce{2H+}(aq)+\ce{2e-}⟶\ce{H2}(g)\) | 0.00 |
| \(\ce{Pb^2+}(aq)+\ce{2e-}⟶\ce{Pb}(s)\) | −0,162 |
| \(\ce{Sn^2+}(aq)+\ce{2e-}⟶\ce{Sn}(s)\) | −0,1375 |
| \(\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s)\) | −0,257 |
| \(\ce{Co^2+}(aq)+\ce{2e-}⟶\ce{Co}(s)\) | −0.28 |
| \(\ce{PbSO4}(s)+\ce{2e-}⟶\ce{Pb}(s)+\ce{SO4^2-}(aq)\) | −0,3505 |
| \(\ce{Cd^2+}(aq)+\ce{2e-}⟶\ce{Cd}(s)\) | −0.4030 |
| \(\ce{Fe^2+}(aq)+\ce{2e-}⟶\ce{Fe}(s)\) | −0,447 |
| \(\ce{Cr^3+}(aq)+\ce{3e-}⟶\ce{Cr}(s)\) | −0.744 |
| \(\ce{Mn^2+}(aq)+\ce{2e-}⟶\ce{Mn}(s)\) | −1.185 |
| \(\ce{Zn(OH)2}(s)+\ce{2e-}⟶\ce{Zn}(s)+\ce{2OH-}(aq)\) | −1,245 |
| \(\ce{Zn^2+}(aq)+\ce{2e-}⟶\ce{Zn}(s)\) | −0.7618 |
| \(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\) | −1,662 |
| \(\ce{Mg^2+}(aq)+\ce{2e-}⟶\ce{Mg}(s)\) | −2.372 |
| \(\ce{Na+}(aq)+\ce{e-}⟶\ce{Na}(s)\) | −2.71 |
| \(\ce{Ca^2+}(aq)+\ce{2e-}⟶\ce{Ca}(s)\) | −2.868 |
| \(\ce{Ba^2+}(aq)+\ce{2e-}⟶\ce{Ba}(s)\) | −2.912 |
| \(\ce{K+}(aq)+\ce{e-}⟶\ce{K}(s)\) | −2.931 |
| \(\ce{Li+}(aq)+\ce{e-}⟶\ce{Li}(s)\) | −3.04 |
Подібні таблиці дозволяють визначити стандартний потенціал клітини для багатьох окислювально-відновних реакцій.
Який стандартний потенціал комірки для гальванічного елемента, який складається з півкомірок Au 3 + /Au і Ni 2 + /Ni? Визначте окислювачі та відновники.
Рішення
Використовуючи таблицю\(\PageIndex{1}\), реакції, що беруть участь в гальванічному елементі, обидва написані як скорочення, є
\[\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s) \hspace{20px} E^\circ_{\ce{Au^3+/Au}}=\mathrm{+1.498\: V} \nonumber \]
\[\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s) \hspace{20px} E^\circ_{\ce{Ni^2+/Ni}}=\mathrm{−0.257\: V} \nonumber \]
Гальванічні елементи мають позитивні потенціали клітин, і всі реакції відновлення оборотні. Реакція на аноді буде напівреакцією з меншим або більш негативним стандартним потенціалом відновлення. Реверсування реакції на аноді (щоб показати окислення), але не його стандартний відновний потенціал дає:
\ [\ почати {вирівнювати*}
&\ textrm {Анод (окислення):}\ ce {Ni} (s) ⟶\ ce {Ni ^ 2+} (aq) +\ ce {2e-}\ hspace {20px} E^\ circ_ {\ circ_ {Ni ^2+/Ni}} =\ mathrm {−0.257\: V}\\
&\ textrm {Катод (зменшення):}\ ce {Au ^ 3+} (aq) +\ ce {3e-} ⟶\ ce {Au} (s)\ hspace {20px} E^\ circ_\ ce {катод} = E^\ circ_ {\ ce {Au ^3+/Au}} =\ математика {+1.498\: V}
\ кінець {вирівнювати*}\ номер\]
Найменш поширеним фактором є шість, тому загальна реакція
Редукційні потенціали не масштабуються стехіометричними коефіцієнтами при розрахунку потенціалу клітини, і необхідно використовувати немодифіковані стандартні відновні потенціали.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=\mathrm{1.498\: V−(−0.257\: V)=1.755\: V} \nonumber \]
Від напівреакцій Ni окислюється, тому він є відновником, а Au 3 + відновлюється, тому він є окислювачем.
Гальванічний елемент складається з електрода Mg в розчині 1 M Mg (NO 3) 2 і електрода Ag в 1 M розчині AgNO 3. Обчисліть стандартний потенціал клітини при 25° C.
- Відповідь
-
\[\ce{Mg}(s)+\ce{2Ag+}(aq)⟶\ce{Mg^2+}(aq)+\ce{2Ag}(s) \hspace{20px} E^\circ_\ce{cell}=\mathrm{0.7996\: V−(−2.372\: V)=3.172\: V} \nonumber \]
Резюме
Призначення потенціалу стандартного водневого електрода (SHE) як нульових вольт дозволяє визначити стандартні потенціали відновлення, Е°, для напівреакцій в електрохімічних комірках. Як випливає з назви, стандартні потенціали відновлення використовують стандартні стани (1 бар або 1 атм для газів; 1 М для розчинених речовин, часто при 298,15 К) і записуються як скорочення (де електрони з'являються в лівій частині рівняння). Реакції відновлення оборотні, тому стандартні потенціали клітин можна обчислити, віднімаючи стандартний потенціал відновлення для реакції на аноді від стандартного відновлення для реакції на катоді. При розрахунку потенціалу стандартного осередку стандартні відновні потенціали не масштабуються стехіометричними коефіцієнтами в збалансованому загальному рівнянні.
Ключові рівняння
- \(E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}\)
Глосарій
- стандартний клітинний потенціал\( (E^\circ_\ce{cell})\)
- потенціал клітини, коли всі реагенти і продукти знаходяться в їх стандартних станах (1 бар або 1 атм або гази; 1 М для розчинених речовин), як правило, при 298,15 К; може бути розрахований шляхом віднімання стандартного потенціалу відновлення для напівреакції на аноді зі стандартного потенціалу відновлення для половини- реакція, що відбувається на катоді
- стандартний водневий електрод (SHE)
- електрод складається з газу водню, що барботируется через соляну кислоту над інертним платиновим електродом, відновленню якого в стандартних умовах присвоюється значення 0 В; орієнтир для стандартних потенціалів відновлення
- стандартний потенціал зниження (E°)
- значення зниження при стандартних умовах (1 бар або 1 атм для газів; 1 М для розчинених речовин) зазвичай на рівні 298,15 К; табличні значення використовуються для розрахунку стандартних потенціалів осередків
