13.1: Хімічні рівноваги
- Page ID
- 22703
- Опишіть природу систем рівноваги
- Поясніть динамічну природу хімічної рівноваги
Хімічна реакція зазвичай пишеться таким чином, який передбачає, що вона протікає в одному напрямку, напрямку, в якому ми читаємо, але всі хімічні реакції оборотні, і пряма і зворотна реакції відбуваються в тій чи іншій мірі залежно від умов. У хімічній рівновазі пряма і зворотна реакції відбуваються з однаковою швидкістю, а концентрації продуктів і реагентів залишаються постійними. Якщо ми запускаємо реакцію в закритій системі, щоб продукти не могли вийти, ми часто виявляємо, що реакція не дає 100% виходу продуктів. Натомість деякі реагенти залишаються після того, як концентрації припиняють змінюватися. У цей момент, коли немає подальшої зміни концентрацій реагентів і продуктів, ми говоримо, що реакція знаходиться в рівновазі. Суміш реагентів і продуктів знаходиться в рівновазі.
Наприклад, коли ми поміщаємо зразок тетроксиду азоту (\(N_2O_4\)безбарвного газу) у скляну трубку, він утворює діоксид азоту (\(\ce{NO2}\)коричневий газ) шляхом реакції
\[\ce{ N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.1} \]
Колір стає темнішим, коли\(\ce{N2O4}\) перетворюється на\(\ce{NO2}\). Коли система досягає рівноваги, обидва\(\ce{N2O4}\) і\(\ce{NO2}\) присутні (рис.\(\PageIndex{1}\)).
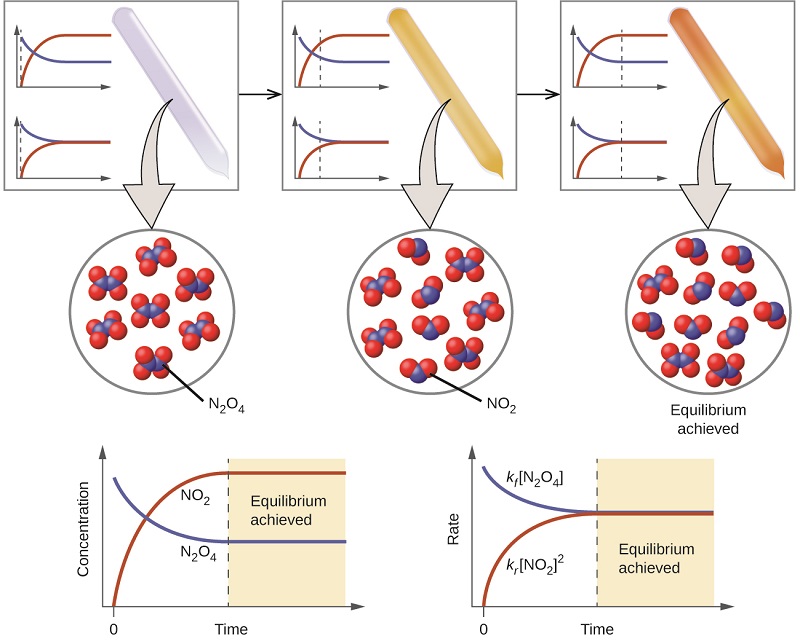
Освіта\(\ce{NO2}\) від\(\ce{N2O4}\) - оборотна реакція, яка ідентифікується стрілкою рівноваги (\(\rightleftharpoons\)). Всі реакції оборотні, але багато реакцій, для всіх практичних цілей, протікають в одному напрямку, поки реагенти не будуть вичерпані і будуть зворотними лише за певних умов. Такі реакції часто зображують односторонньою стрілкою від реагентів до продуктів. Багато інших реакцій, таких як утворення\(\ce{NO2}\) з\(\ce{N2O4}\), є оборотними в більш легкодоступних умовах і, отже, називаються такими. У оборотній реакції реагенти можуть поєднуватися, утворюючи продукти, і продукти можуть реагувати з утворенням реагентів. Таким чином, не тільки може\(\ce{N2O4}\) розкладатися до форми\(\ce{NO2}\), але і\(\ce{NO2}\) вироблене може реагувати на форму\(\ce{N2O4}\). Як тільки пряма реакція виробляє будь-яку\(\ce{NO2}\), починається зворотна реакція і\(\ce{NO2}\) починає реагувати на форму\(\ce{N2O4}\). При рівновазі концентрації\(\ce{N2O4}\) і\(\ce{NO2}\) більше не змінюються, оскільки швидкість утворення в точності\(\ce{NO2}\) дорівнює нормі споживання\(\ce{NO2}\), а швидкість утворення в точності\(\ce{N2O4}\) дорівнює нормі споживання\(\ce{N2O4}\). Хімічна рівновага - це динамічний процес: Як і у плавців і любителів засмаги, числа кожного залишаються постійними, але між ними існує потік вперед і назад (рис.\(\PageIndex{2}\)).

У хімічній рівновазі пряма і зворотна реакції не припиняються, скоріше вони продовжують відбуватися з однаковою швидкістю, що призводить до постійних концентрацій реагентів і продуктів. Графіки, що показують, як змінюються швидкості реакції та концентрації щодо часу, показані на малюнку\(\PageIndex{1}\).
Ми можемо виявити стан рівноваги, оскільки концентрації реагентів та продуктів, здається, не змінюються. Однак важливо, щоб ми переконалися, що відсутність змін обумовлена рівновагою, а не швидкістю реакції, яка настільки повільна, що зміни концентрації важко виявити.
Використовуємо подвійну стрілку при написанні рівняння для оборотної реакції. Така реакція може бути, а може і не бути в рівновазі. Наприклад, на малюнку\(\PageIndex{1}\) показана реакція:
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.2} \]
Коли ми хочемо говорити про один конкретний компонент оборотної реакції, ми використовуємо єдину стрілку. Наприклад, в рівновазі, показаному на малюнку\(\PageIndex{1}\), швидкість прямої реакції
\[\ce{2NO2(g) \rightarrow N2O4(g)} \label{13.2.3} \]
дорівнює швидкості зворотної реакції
\[\ce{N2O4(g) \rightarrow 2NO2(g)} \label{13.2.4} \]
Зв'язок між хімією та газованими безалкогольними напоями сягає 1767 року, коли Джозеф Прістлі (1733—1804; в основному відомий сьогодні своєю роллю у відкритті та ідентифікації кисню) відкрив метод вливання води вуглекислим газованим газованим газованим газом. У 1772 році священик опублікував статтю під назвою «Просочення води нерухомим повітрям». У роботі описано капання олії купоросу (сьогодні ми називаємо цю сірчану кислоту, але який відмінний спосіб описати сірчану кислоту: «масло купоросу» буквально означає «рідка гидота») на крейда (карбонат кальцію). Отриманий\(CO_2\) потрапляє в ємність з водою під посудиною, в якій відбувається початкова реакція; перемішування допомагає газоподібної\(CO_2\) суміші в рідку воду.
\[\ce{H2SO4(l) + CaCO3(s) \rightarrow CO2(g) + H2O (l) + CaSO4 (aq)} \nonumber \]
Вуглекислий газ мало розчинний у воді. Існує реакція рівноваги, яка відбувається, коли вуглекислий газ реагує з водою з утворенням вугільної кислоти (\(H_2CO_3\)). Оскільки вугільна кислота є слабкою кислотою, вона може дисоціювати на протони (\(H^+\)) і іони гідрокарбонату (\(HCO_3^−\)).
\[\ce{ CO2 (aq) + H2O(l) \rightleftharpoons H2CO3 (aq) \rightleftharpoons HCO3^{-} (aq) + H^{+} (aq)} \nonumber \]
Сьогодні\(\ce{CO_2}\) можна нагнітати під тиском безалкогольні напої, встановивши рівновагу, показану вище. Однак, як тільки ви відкриєте ємність для напою, відбувається каскад зсувів рівноваги. По-перше,\(\ce{CO_2}\) газ у повітряному просторі зверху пляшки виходить, викликаючи зміщення рівноваги між газовою фазою\(\ce{CO_2}\) та розчиненою або\(\ce{CO_2}\) водною водою, знижуючи концентрацію\(\ce{CO_2}\) в безалкогольному напої. Менше\(\ce{CO_2}\) розчинена в рідині призводить до розкладання вугільної кислоти до розчиненої\(\ce{CO_2}\) і Н 2 О. Знижена концентрація вугільної кислоти викликає зсув остаточного рівноваги. Поки безалкогольний напій знаходиться у відкритій ємності,\(\ce{CO_2}\) бульбашки піднімаються з напою, випускаючи газ в повітря (рис.\(\PageIndex{3}\)). З кришкою від пляшки\(\ce{CO_2}\) реакції більше не знаходяться в рівновазі і триватимуть до тих пір, поки не залишиться більше реагентів. В результаті виходить безалкогольний напій зі значно зниженою\(\ce{CO_2}\) концентрацією, який часто називають «плоским».

Розглянемо випаровування брому як другий приклад системи при рівновазі.
\[\ce{Br2(l) \rightleftharpoons Br2(g)} \nonumber \]
Рівновага може бути встановлена для фізичної зміни - як цей перехід рідини до газу, а також для хімічної реакції. \(\PageIndex{4}\)На малюнку показана проба рідкого брому при рівновазі з парами брому в закритій ємності. Коли ми наливаємо рідкий бром в порожню пляшку, в якій немає парів брому, частина рідини випаровується, кількість рідини зменшується, а кількість парів збільшується. Якщо ми закриваємо пляшку, щоб пар не виходив, кількість рідини та пари з часом перестане змінюватися, і буде встановлено рівновагу між рідиною та парою. Якби пляшка не була закрита, пари брому втекли б і ніякої рівноваги не було б досягнуто.

Резюме
Реакція знаходиться в рівновазі, коли кількість реагентів або продуктів більше не змінюється. Хімічна рівновага - це динамічний процес, тобто швидкість утворення продуктів шляхом прямої реакції дорівнює швидкості, з якою продукти повторно утворюють реагенти зворотною реакцією.
Глосарій
- рівноваги
- в хімічних реакціях стан, при якому перетворення реагентів в продукти і перетворення продуктів назад в реагенти відбуваються одночасно з однаковою швидкістю; стан рівноваги
- оборотна реакція
- хімічна реакція, яка може протікати як в прямому, так і в зворотному напрямку при заданих умовах
