13.6: Застосування кислотно-лужних рівноваг
- Page ID
- 19082
Переконайтеся, що ви добре розумієте наступні основні поняття:
- Опишіть основні особливості глобального вуглецевого циклу та окреслите роль кислотно-лужних процесів як у повільній, так і в швидкій частині циклу.
- Охарактеризуйте основні кислотно-лужні реакції при аеробному диханні.
- Визначте кислотний дощ і поясніть його походження. Окреслити його основні наслідки для навколишнього середовища.
Кислотно-лужні реакції пронизують кожен аспект промислової, фізіологічної та екологічної хімії. У цьому підрозділі ми торкаємося декількох основних моментів, про які повинен знати кожен, хто вивчає або практикує хімічну науку.
Деякі програми буферів
Буферні розчини та буферний ефект, який вони виробляють, надзвичайно важливі у багатьох практичних застосуваннях хімії. Причина цього полягає в тому, що багато хімічних процесів досить чутливі до рН; ступінь реакції, її швидкість і навіть характер продуктів можуть бути змінені, якщо рН дозволено змінюватися. Така зміна буде, як правило, відбуватися, наприклад, коли розглянута реакція або непов'язана паралельна реакція споживає або виділяє іони водню або гідроксиду.
Буфери в біохімії та фізіології
Багато реакцій, які відбуваються в живих організмах, потрапляють в цю категорію. Більшість біохімічних процесів каталізуються ферментами, діяльність яких сильно залежить від рН; якщо місцевий рН відхиляється занадто далеко від оптимального значення, фермент може стати постійно деактивованим.
- Наприклад, окислення глюкози до вуглекислого газу, а вода - основний енергогенеруючий процес аеробного обміну - вивільняє іони Н +. Множинні етапи цього процесу каталізуються ферментами, на активність яких сильно впливає рН. Якби область клітини, де відбуваються ці реакції, не була буферизована, сам акт життя незабаром зменшив би місцевий рН нижче діапазону, в якому ферменти активні, зупиняючи вироблення енергії і вбиваючи клітину.
- Кров сильно буферується (головним чином бікарбонатом) для підтримки її рН на рівні 7,4 ± 0,3; значення рН нижче 7,0 або вище 7,8 викликають смерть протягом декількох хвилин.
- Інтер'єри більшості клітин буферизовані поблизу рН 7,0 (фосфатами та білками)
Буфери в промисловості
Буфери використовуються в найрізноманітніших лабораторних процедурах та промислових процесах:
- розчини для калібрування рН-метрів
- зростання бактерій в культуральних середовищах
- процеси бродіння, включаючи виноробство та пивоваріння
- контроль кольорів барвників, що використовуються при фарбуванні тканин
- шампуні (підтримуючи рН на рівні або нижче 7 для протидії лужності мила, що може викликати роздратування)
- інші засоби особистої гігієни, такі як дитячі лосьйони (зберігаючи рН близько 6, щоб пригнічувати ріст бактерій)
- Контроль рН у друкарських фарбах для забезпечення їх належного проникнення в папір
Буфери в навколишньому середовищі
- Природні води (озера та струмки), здатні підтримувати водне життя, буферуються відкладеннями, з якими вони контактують. Ця буферизація не завжди здатна компенсувати наслідки кислотних дощів.
- Морська вода буферується в основному бікарбонатом і боратами. Це дозволяє океанам поглинати близько половини CO 2, що викидається в атмосферу людською діяльністю.
- Грунти, щоб залишатися продуктивними, повинні підтримувати майже нейтральний рН не тільки для рослин, але і для мікроорганізмів, які фіксують та переробляють азот. Грунти, надані кислотними дощами, можуть зберігати необхідні поживні речовини, такі як фосфати, у таких формах, як нерозчинний Ca 3 (PO 4) 2, що запобігає їх поглинанню рослинами.
Кислотно-лужна хімія в фізіології
Кислотно-лужна хімія відіграє вирішальну роль у фізіології, як на рівні окремої клітини, так і всього організму. Причини цього двоякі:
- Багато з основних хімічних компонентів організму можуть самі виступати в якості кислот та/або підстав. Таким чином, білки містять як кислі, так і основні групи, так що їх форми та їх функціональна активність сильно залежать від рН.
- Практично всі важливі обмінні процеси припускають поглинання або вивільнення іонів водню. Сам акт буття живим має тенденцію до зміни навколишнього рН (зазвичай його зниження); це врешті-решт вб'є організм за відсутності механізмів Budering.
Близько двох третин ваги дорослої людини складається з води. Близько двох третин цієї води знаходиться всередині клітин, тоді як решта третина складається з позаклітинної води, в основному інтерстиальної рідини, яка купає клітини, і плазми крові. Останній, що становить близько 5% маси тіла (близько 5 л у дорослої людини), служить підтримуючою рідиною для клітин крові і діє як засіб транспортування хімічних речовин між клітинами і зовнішнім середовищем. В основному це 0,15 М розчин NaCl, що містить меншу кількість інших електролітів, найважливішими з яких є HCO 3 - і білкові аніони.
Дихання, найважливіша фізіологічна діяльність клітини, є кислотоутворюючим процесом. Вуглеводні речовини розщеплюються на вуглекислий газ, а значить і вугільну кислоту:
\[C(H_2O)_{n} + O_2 → CO_2 + n H_2O\]
Підтримка кислотно-лужного балансу
Примітно, що рН більшості клітинних рідин може утримуватися в такому вузькому діапазоні, враховуючи велику кількість процесів, які схильні його засмучувати. Це пов'язано з вишуканим балансом між великою кількістю взаємопов'язаних процесів, що працюють на самих різних рівнях. Кислотно-лужний баланс в організмі підтримується двома загальними механізмами: селективним виведенням кислот або підстав, і буферним дією слабких кислотно-лужних систем в рідинях організму.
- За 24-годинний період доросла людина усуває еквівалент близько 20-40 родимок Н + шляхом легких у вигляді СО 2. Крім того, нирки виділяють можливо 5% цієї кількості кислоти, в основному у вигляді Н 2 РО 4 - і
NH 4 +. Завдяки своїм електричним зарядам ці два види тісно пов'язані з сольовим балансом з іонами, такими як Na + або K + та Cl -. - Основною системою буферизації в організмі є карбонатна система, яка існує переважно у вигляді HCO 3 — при нормальному фізіологічному рН. Вторинна буферна дія відбувається від фосфатів, білків та інших слабких органічних кислот, а також (всередині клітин крові) гемоглобіну.
Існує величезна промисловість, спрямована на горезвісно викликаний наукою ринок «альтернативного здоров'я», який просуває нікчемні ніздри, такі як «іонізована вода», які, як стверджується, відновлюють або зберігають «кислотно-лужний баланс організму». Вони зазвичай вказують на те, що більшість продуктів є «кислими», (тобто вони метаболізуються до Н 2 СО 3), але ніколи не пояснюють, що більша частина цієї кислоти майже відразу видихається у вигляді СО 2. Мається на увазі, що наше здоров'я руйнується внаслідок «підкислення» організму; деякі далі припускають, що це може бути причиною раку та інших різноманітних недуг.
Люди, які потрапляють на ці дорогі шахрайства, фактично платять податок на наукове незнання. Тим, хто, як і ви, вивчав хімію, повинні врахувати, що у них є соціальний обов'язок протистояти подібному роду хижої і оманливої лженауки.
Порушення кислотно-лужного балансу
Відхилення рН плазми крові від її нормального значення 7,4 на більш ніж приблизно ± 1 можуть бути дуже серйозними. Ці стани відомі медично як ацидоз і алкалоз. Вони можуть бути викликані порушеннями обміну речовин, такими як діабет, і нирковою недостатністю, при якій екскреція H 2 PO 4 — наприклад, пригнічується.
Численні інші процеси призводять до тимчасових дисбалансів. Таким чином, гіпервентиляція, яка може виникнути внаслідок емоційного розладу, призводить до наднормальної втрати СО 2, а отже, до алкалозу. Аналогічно гіповентиляція може виступати в ролі компенсаторного механізму при ацидозі. З іншого боку, затримка CO 2, спричинена бронхопневмонією, наприклад, може спричинити ацидоз. Ацидоз також може бути наслідком діареї (втрати лужної рідини з кишечника), тоді як втрата шлункового вмісту блювотою сприяє алкалозу.
Кислотний дощ
Атмосфера природно кисла
Природна, незабруднена атмосфера отримує кислі, основні та нейтральні речовини з природних джерел (вулканічні викиди, сольовий спрей, вітродувний пил та мікробний метаболізм), а також від забруднення (рис. 11.6.X). Вони реагують у своєрідному гігантському кислотно-лужному титруванні, щоб отримати розчин, в якому іони водню повинні переважати для підтримки балансу заряду (позначені однаковими ширинами гістограм внизу з позначкою «аніони» та «катіони»).
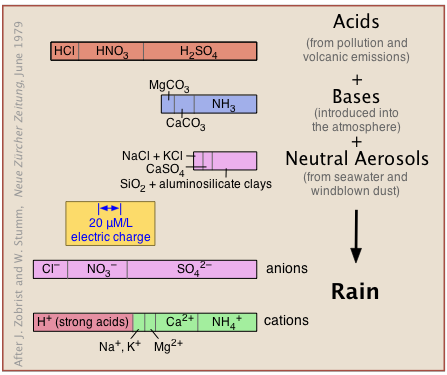
Вуглекислий газ, однак, є основним джерелом кислотності в незабрудненій атмосфері. Як буде пояснено далі, СО 2 становить 0,032 об.% сухого повітря і розчиняється у воді з утворенням вугільної кислоти:
\[CO_{2(g) }+ H_2O(l) \rightleftharpoons H_2CO_{3(aq)}\]
Таким чином, весь дощ є «кислим» в тому сенсі, що він містить розчинений СО 2, що зменшить його рН до 5,7. Тому термін кислотний дощ означає дощ, рН якого контролюється забруднюючими речовинами, які можуть знизити рН в діапазоні 3-4, що призводить до серйозної шкоди навколишньому середовищу.
Походження кислотних дощів
Кислотні дощі походять від викидів SO 2 і різних оксидів азоту (відомого в сукупності як «NO x «), які утворюються в процесі горіння, особливо тих, що пов'язані зі спалюванням вугілля. Спалювання відходів, промислові операції, такі як виплавка та лісові пожежі, є іншими джерелами, пов'язаними зі спалюванням; вони також виділяють тверді частинки в атмосферу, що відіграє важливу роль у концентрації та розподілі цих кислотоутворюючих речовин.
Витоки NO x
Оксиди азоту утворюються природним шляхом ґрунтовими бактеріями, що діють на нітратні іони, необхідну поживну речовину рослин і сам продукт природної фіксації азоту. Аміак, продукт бактеріального розпаду органіки, з часом перетворюється в NO 3 - бактеріями в оксиди азоту.
Кількість фіксованого азоту, виробленого промисловим шляхом для підтримки інтенсивного сільського господарства, зараз перевищує кількість утвореного природним шляхом, і стала основним джерелом антропогенних оксидів азоту.
- Атмосферний азот може бути термічно розкладений на різні його оксиди NO x під впливом високих температур; одним незначним природним джерелом є блискавка. Що ще важливіше, ці оксиди утворюються і при спалюванні на повітрі «чистого» палива, такого як природний газ (переважно метан, CH 4).
- NO x також може реагувати з іншими атмосферними забруднювачами для отримання фотохімічного смогу.
утворення кислот
Зазначені вище гази реагують з киснем атмосфери, один з одним, і з твердими частинами з утворенням сірчаної, азотної та соляної кислот.
- Велика частина H 2 SO 4 походить від фотоокислення SO 2, що виділяється при спалюванні викопного палива та від промислових операцій, таких як виплавка.
- Азотна кислота аналогічно виникає в результаті фотоокислення оксидів азоту. Велика кількість цих оксидів утворюється в високотемпературних процесах згоряння в бензино- і реактивних двигунів, а також в турбінних двигунів електростанцій, що працюють на викопному паливі.
- Соляна кислота утворюється природним шляхом в результаті реакції аерозолів морської солі з атмосферними H 2 SO 4 і HNO 3. Частинки солі утворюються, коли океанські хвилі розбивають поверхню і частина води випаровується до того, як спрей осідає назад на поверхню. У набагато менших масштабах спалювання викопного палива та спалювання відходів вважаються основними джерелами HCl, спричиненими людиною.
Вологе і сухе осадження
Існує два основних механізми, за допомогою яких кислотний матеріал транспортується через навколишнє середовище. Кислота, яка розчиняється в краплях води, що утворюють хмари та опади, і врешті-решт включається в туман і сніжинки, піддається мокрому відкладенню; це, як правило, те, що називається «кислотним дощем». Оскільки він широко розсіяний, часто високий в атмосфері, він може подорожувати дуже великі відстані від першоджерела.
Близько 40% кислих речовин, що вводяться в атмосферу, адсорбуються на твердих частинок, які можуть бути сажею, димом, дутим вітром пилом та частинками солі, що утворюються природним шляхом з морських бризок. Це поширюється менш широко (як правило, близько 30 км від джерела) і потрапляє на поверхні шляхом "сухого осадження». Після того, як частинки, завантажені кислотою, приземляються на поверхні, звичайний дощ, туман та роса виділяють кислі компоненти, часто в значно більш концентрованій формі, ніж відбувається лише через сухе осадження.
Вплив на ґрунти
Оскільки ґрунти підтримують ріст рослин та ґрунтових мікроорганізмів, які є необхідними агентами при переробці мертвих рослинних матеріалів, кислотні дощі мають непрямий, але глибокий вплив на здоров'я ґрунту та ріст рослин.
↓ Натисніть на картинку, щоб збільшити
Регіони погано буферизованого грунту в США
↓ Натисніть на зображення, щоб збільшити
Регіони погано буферизованого грунту в Канаді
Грунти, що містять лужні компоненти (найчастіше вапняк СаСО 3 та інші нерозчинні карбонати) можуть нейтралізувати додану кислоту і пом'якшувати її вплив. Але ґрунти у високогірних регіонах, як правило, тонкі і не здатні забезпечити належну буферну здатність. Те ж саме стосується майже половини Канади, в якій гранітна порода Канадського щита знаходиться дуже близько до поверхні; східні провінції країни сильно піддаються впливу кислотних дощів.
- Більшість ґрунтів також містять глину та гумінові речовини, які зв'язують та утримують іони, такі як Ca 2+, Mg 2+ та K +, які є необхідними поживними речовинами рослин. Доданий Н + зв'язується ще сильніше з цими речовинами, витісняючи живильні іони з верхніх шарів. Загальний ефект полягає в тому, щоб вилуговувати ці іони на більшу глибину, де вони можуть бути недоступними для рослин, або змивати їх у ґрунтові води.
- SO 4 2— компонент кислотних дощів перетворює деякі поживні катіони в нерозчинні сульфати, знижуючи їх доступність для рослин.
- Глини, що представляють собою складні алюмосилікати, поступово руйнуються, виділяючи іони алюмінію, які в нормі утворюють нерозчинний Al (OH) 3. Додавання Н + розчиняє цей гідроксид, підвищуючи концентрацію Al (H 2 O) 6 3+ до рівнів, які можуть бути токсичними для рослин.
- Багато токсичних важких металів, таких як Pb, Cd і Cr, присутні в слідових кількостях у ґрунтах, але пов'язані у вигляді нерозчинних солей. Кислотні дощі можуть мобілізувати іони цих металів, так само, як це відбувається з алюмінієм.
Вплив на рослини
↓ Натисніть на зображення, щоб збільшити
Лист пошкоджений кислотним дощем
↓ Натисніть на зображення, щоб збільшити
Ліс в США Andirondacks пошкоджений кислотним дощем
Вплив на грунти, зазначені вище, впливають на рослини найбільш сильно. Однак пряме вплив кислотного дощу та туману на листя має інші ефекти, які можуть бути особливо серйозними, коли присутні забруднювачі повітря, такі як SO 2.
- Кислотне відкладення на листках і хвої має тенденцію послаблювати їх, розмиваючи їх захисні воскові покриття. Це часто призводить до розвитку коричневих плям, які заважають фотосинтезу.
- Ліси в гірських регіонах часто купаються хмарами та туманом, які можуть бути навіть більш кислими, ніж звичайні опади, посилюючи вищезазначену проблему. Крім того, листя та голки, як правило, накопичують аерозоль туману на більші краплі. Вони з часом падають на лісову підстилку, збільшуючи вплив на ґрунти, описані в попередньому розділі.
- Харчові культури, як правило, менше страждають від кислотних дощів, де належні методи ведення сільського господарства, такі як додавання добрив для заміни виснажених поживних речовин та додавання вапняку для підвищення рН ґрунту.
Вплив на озера та водні екосистеми
Озера схильні не тільки вологому і сухому кислотному відкладенню, але і водою, яку вони отримують від струмків і поверхневого стоку. Таким чином, будь-які токсичні елементи, що виділяються під дією кислотних дощів на ґрунтах та відкладах, можуть передаватися та концентруватися в озерах та потоках, які їх спорожнюють.
↓ Натисніть на картинку, щоб збільшити
Регіони погано буферизованих озер Північної Америки в 1980 році
↓ Натисніть на картинку, щоб збільшити
Травневе озеро в Каліфорнії Сьєррас - типове альпійське озеро
Озера в погано буферизованих районах, таких як зустрічаються в альпійських регіонах (Західна Північна Америка, Колорадо та більша частина Швейцарії) або на Канадському щиті та в Адірондаках та Аппалачах), дуже чутливі до кислотного осадження.
Сильно підкислені озера (такі, як зображені вгорі праворуч) можуть бути настільки позбавлені життя, включаючи водорості, що вода здається абсолютно чистою і яскраво-синього кольору.
↓ Натисніть на зображення, щоб збільшити
Допуски рН деяких водних організмів
Водні організми, як правило, пристосовані до «звичайних» умов рН 6-8, але сильно відрізняються своєю переносимістю низького рН. Оскільки рН знижується нижче 6, різноманітність водних тварин, рослин та мікроорганізмів зменшується.
- Деякі види рослин, такі як сфагнумові мохи та певні нитчасті водорості, які процвітають при дуже низькому рН, можуть розмножуватися в підкислених озерах, утворюючи товсті мати, які герметизують кисень і тим самим гальмують гниття сміття на дні озера.
- Кислота, що осідає на зимовий сніг, виділяється під час весняного танення і може спричинити швидке падіння рН у погано буферизованих озерах, які отримують води з цих джерел. Цей «весняний кислотний шок» може серйозно вплинути на життєздатність таких організмів, як риби, земноводні та комахи, які відкладають свої ікри у воді, яка вилуплюється навесні. Птенята часто не в змозі пристосуватися до швидких змін і в кінцевому підсумку деформуються або гинуть.
-
Навіть ті водні види, здатні виживати у водах з низьким рівнем рН, можуть бути опосередковано вплинуті, якщо їх запас їжі обмежений pH. Наприклад, метелики та деякі інші комахи, які є важливими джерелами їжі для жаб, не можуть вижити нижче рН 5,5.
↓ Натисніть на зображення, щоб збільшити

Риба, пошкоджена кислотним відкладенням
- Риби сильно уражаються алюмінієм, який виділяється від дії кислоти на опади; він викликає утворення нальоту слизу на зябрах, що перешкоджає всмоктуванню кисню. Це призвело до вимирання деяких видів з уражених озер.
- Низький рН збільшує розчинність солей кальцію, ускладнюючи формування кісток при розвитку ембріонів риб і земноводних.
- Низький рН також може зробити яйцеклітини водного організму густішими та важчими для проникнення ембріонів, тим самим затримуючи вилуплення. Коли ембріони продовжують рости в обмеженому просторі яйцеклітини, їх шипи можуть деформуватися, заважаючи їх життєздатності, коли вони остаточно вилуплюються.
Вплив на будівлі та статуї
Кислотні дощі - це не нова!
«Часто спостерігалося, що камені і цегла будівель, особливо під виступаючими частинами, охоче кришаться у великих містах, де спалюється вугілля... Мене змусили приписувати цей ефект повільному, але постійному дії кислотних дощів». Роберт Ангус Сміт, 1856
Кислотне осадження найсильніше впливає на спадщину будівель, виготовлених з вапняку та подібних карбонатно-містять кам'яних матеріалів.
Основний хімічний процес передбачає реакцію сірчаної кислоти з карбонатом кальцію:
\[\ce{CO3(s) + H2SO4 → CaSO4(s) + CO2}.\]
Кислота спочатку розмиває і розбиває поверхню каменю. У міру утворення гідратного сульфату кальцію (гіпсу) він підхоплює залізо та інші компоненти каменю і утворює непривабливий чорний наліт. Деякі з цього поступово здуваються, оголюючи ще більше кам'яної поверхні. Кристали гіпсу іноді можуть вростати в камінь, ще більше підриваючи поверхню.
Дуже старі споруди, такі як Тадж-Махал, Нотр-Дам, Колізей та Вестмінстерське абатство, постраждали.
↓ Натисніть на зображення, щоб збільшити
Кам'яні будівлі та пам'ятники швидко пошкоджуються кислотними дощами

Оголені верхні поверхні горгулії починають псуватися.
Статуї та пам'ятники, в тому числі виготовлені з мармуру, також схильні до ерозії і пошкоджень від кислотного осадження.
Сучасні будівлі страждають менше, хоча кислотні дощі можуть розмивати деякі пофарбовані поверхні.
Геохімічна карбонатна система
Карбонатна система, що складається, як це робить з розчинного газу СО 2, розчинних іонів HCO 3 - і CO 3 2-, і помірно розчинних карбонатних солей, охоплює всі чотири сфери природи: атмосферу, гідросферу (головним чином океани), літосферу і біосфера. І завдяки кислотно-лужним рівновагам, які регулюють перетворення між цими карбонатними видами, вуглець легко транспортується між цими геохімічними резервуарами. У цьому розділі представлений огляд геохімії вуглецю.
Розподіл вуглецю на Землі
Вуглець - четвертий найпоширеніший елемент у Всесвіті. У земній корі він займає 15-е місце, переважно у вигляді карбонатів у вапняках та доломітах. Керогени, які є скам'янілим вуглецем рослинного походження в основному у вигляді нафтових сланців, складають ще одне велике сховище наземного вуглецю.
| Джерело | щодо атмосфери | |
|---|---|---|
|
карбонатна порода
|
карбонатна порода
|
28 500
|
|
викопний вуглець
|
572
|
10 600
|
|
земля - органічний вуглець
|
0.065
|
1.22
|
|
океан
|
3.2
|
61.8
|
|
Атмосферний СО 2
|
0.0535
|
1.0
|
Геохімічний вуглецевий цикл
Карбонатна система охоплює практично всі екологічні відсіки - атмосферу, гідросферу, біосферу та основні частини літосфери. Додаткові процеси фотосинтезу та дихання керують глобальним циклом, в якому вуглець повільно проходить між атмосферою та літосферою і швидше між атмосферою та океанами. Таким чином, «вуглецевий цикл» можна розділити на «швидкі» та «повільні» частини, що працюють приблизно на річних та геологічних часових масштабах.
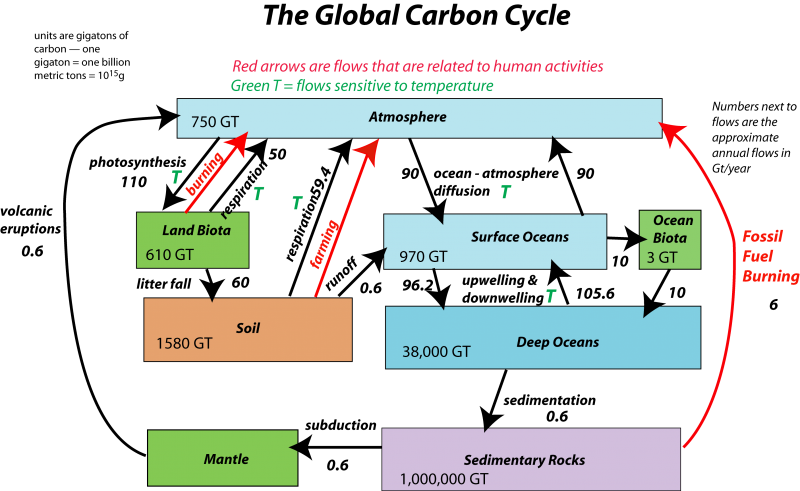
Рисунок (\ pageIndex {2}\): Зображення Девіда Байза, Університет штату Пенсільванія; дивіться тут для повного обговорення цієї діаграми.
Ще одне чудове зображення вуглецевого циклу, від Департаменту енергетики США. (Див. Опис):
Вуглецевий цикл
Вуглекислий газ в атмосфері
CO 2, ймовірно, завжди був присутній в атмосфері у відносно невеликих абсолютних кількостях, які зараз спостерігаються. докембрійські вапняки, можливо, утворені реакціями з породоутворюючими силікатами, наприклад
\[\ce{CaSiO_3 + CO_2 → CaCO_3 + SiO_2} \label{4-1}\]
ймовірно, мали помірний вплив на чисельність CO 2 протягом геологічного часу.
Обсяг-відсоток СО 2 в сухому повітрі становить 0,032%, що призводить до парціального тиску 3 × 10 -4 (10 3,5) атм. У переповненому і погано провітрюваному приміщенні P CO2 може досягати 100 × 10 -4 атм. Близько 54 × 10 14 молів на рік СО 2 береться з атмосфери шляхом фотосинтезу, розділеного приблизно порівну між сушею і морем. З цього все, крім 0,05%, повертається диханням (в основному мікроорганізмами); решта просочується в повільну, осадову частину геохімічного циклу, де вона може залишатися протягом тисячо-мільйонів років. Тенденції зростання атмосферного CO 2 за останні п'ять років можна побачити на цій сторінці NOAA США.
З настанням масштабної індустріалізації близько 1860 року кількість CO 2 в атмосфері збільшується. Більша частина цього була обумовлена спалюванням викопного палива; в 1966 році в атмосферу було випущено близько 3,6 × 10 15 г С; це приблизно в 12 разів більше, ніж передбачуване природне видалення вуглецю в відкладення. Вважається, що масштабне знищення тропічних лісів, яке значно прискорилося в останні роки, посилює цей ефект шляхом видалення тимчасової раковини для СО 2.
Там залишається близько 30-50% CO 2, що виділяється в атмосферу при згорянні; решта потрапляє в гідросферу і біосферу. Океани мають велику поглинаючу здатність CO 2 в силу його перетворення в бікарбонат і карбонат в слаболужному водному середовищі, і вони містять приблизно в 60 разів більше неорганічного вуглецю, ніж в атмосфері. Однак ефективне перенесення відбувається тільки в самий верхній
(100 м) змішаний вітром шар, який містить лише близько одного атмосферного еквівалента CO 2; час змішування в глибші частини океану становить близько 1000 років. З цієї причини лише близько десяти відсотків доданого CO 2 засвоюється океанами.
Велика частина вуглецю в океанах знаходиться у вигляді бікарбонату, як і слід було очікувати від рН, який коливається між 7,8 і 8,2. Крім атмосферного CO 2, є вуглекислий вхід в океан з потоків. Це здебільшого у формі HCO 3 - який походить від вивітрювання гірських порід та наземних карбонатних відкладень та кислотно-лужної реакції.
\[H_2CO_3 + CO_3^{2–} → 2 HCO_3^– \label{4-2}\]
який можна вважати джерелом бікарбонату в морській воді. У цьому сенсі океан можна вважати місцем гігантського кислотно-лужного титрування, при якому атмосферні кислоти (переважно CO 2, але також SO 2, HCl та інші кислоти вулканічного походження) реагують з підставами, що походять з гірських порід і вводяться через карбонатні потоки або в обдувається вітром пил.
Вуглець у гідросфері
Розчинення СО 2 у воді
Вуглекислий газ мало розчинний у воді:
| ° C |
0
|
4
|
10
|
20
|
|---|---|---|---|---|
| моль L -1 |
0,077
|
0.066
|
0,054
|
0.039
|
Закон Генрі дотримується до тиску CO 2 близько 5 атм:
\[[\ce{CO2 (aq)}] = 0.032 P_{\ce{CO_2}} \label{4-3}\]
«Розчинений вуглекислий газ» складається здебільшого з гідратованого оксиду CO2 (aq) разом з невеликою часткою вугільної кислоти:
\[[\ce{CO2 (aq)}] = 650 [\ce{H2CO3}] \label{4-4}\]
Константа дисоціації кислоти\(K_{a1}\), яка зазвичай цитується для «H 2 CO 3», дійсно є складовою постійною рівноваги, яка включає вищевказану рівновагу. Це означає, що «чистий» H 2 CO 3 (який неможливо виділити) є значно сильнішою кислотою, ніж зазвичай цінується.
Розподіл карбонатних видів у водних розчині
Вода, що потрапляє в атмосферу з P CO2 = 10 3,5 атм, буде приймати вуглекислий газ, який розподіляється між трьома карбонатними видами CO 2, HCO 3 - і CO 3 2— в пропорціях, які залежать від К 1 і К 2 і на рН. «Загальний розчинений вуглець» задається балансом маси
\[C_t = [H_2CO_3] + [HCO_3^–] + [CO_3^{2–}] \label{4-5}\]
Розподіл цих видів в залежності від рН найкраще можна побачити, побудувавши діаграму журналу C -pH для C t = 10 —5 М.
Ця ділянка Сіллена намальована для двох різних концентрацій карбонатної системи. Нижній, у більш важких лініях, призначений для розчину 10 —5 М, що приблизно відповідає атмосферному CO 2 в рівновазі з чистою водою. Верхня ділянка, для розчину 10 —3 М, є репрезентативною для багатьох природних вод, таких як озера та струмки, де вода контактує з відкладеннями.
Важливо відзначити, що дана діаграма відноситься тільки до системи, в якій C t постійна. У розчині, відкритому для атмосфери, цього не буде при високих значеннях рН, де концентрація СО 2 помітна. У цих умовах цей іон вступить в реакцію з Н 2 СО 3 і розчин поглине СО 2 з атмосфери, в результаті чого утворюється твердий карбонатний осад.
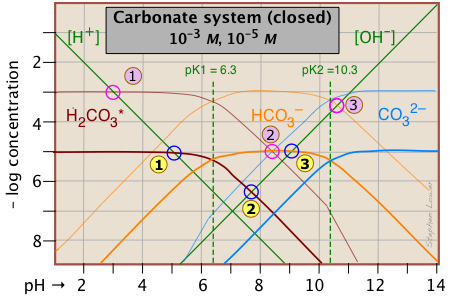
Нижній з двох перерахованих вище ділянок може бути використаний для прогнозування рН 10^ {5} М розчинів вуглекислого газу, бікарбонату натрію та карбонату натрію в чистій воді. Значення рН оцінюються за допомогою умов балансу маси та заряду для кожного розчину, як зазначено нижче.
Міркування, що призводять до цих розрахунків, пояснюється в обговоренні системи карбонату 10 —3 М в попередньому розділі.
- Розчин СО 2 або Н 2 СО 3
- [Н +] = [ОН -] + [ГСО 3 -] + 2 [СО 3 2—] (4-6)
- які, так як розчин буде кислим, можна спростити до
- [H +] = [HCO 3 -] (точка
) (4-7)
- Розчин НаХСО 3
- [Н +] + [Н 2 СО 3] = [СО 3 2—] + [ОН] (4-8)
- або
- [H +] = [HCO 3 —] (точка
) (4-9)
- Розчин Na 2 СО 3
- [Н +] + 2 [Н 2 СО 3] + [СО 3 2—] = [ОН —] (4-10)
- або
- [HCO 3 -] = [ОН -] (точка
) (4-11)
Вуглець в океанах
Природні води отримують вуглець з опадів, з якими вони контактують, і, звичайно, також з атмосфери. Тут важливим фактором є рН; CO 2 і тверді карбонати більш розчинні при високому рН, а рН також контролює розподіл видів вуглецю, як видно на графіку трохи вище.
| дощ | річка/озерна вода | морська вода | |
|---|---|---|---|
| проміле вуглецю |
1.2
|
35
|
140
|
| рН (незабруднений) |
5.6
|
6,5 - 8,5
|
7,5 - 8,4
|
При слаболужному рН більшості водойм (з яких океани складають 97% поверхневих вод землі) бікарбонат є основним розчиненим видом вуглецю. Кількість органічного вуглецю досить невелика.
| СО 2 (aq) | НСО 3 — | СО 3 2— | мертвий орг. | живий орг. |
|---|---|---|---|---|
|
0,18
|
2.6
|
0,33
|
0,23
|
0,05
|
