13.5: Титування кислоти/основи
- Page ID
- 19072
Переконайтеся, що ви добре розумієте наступні основні поняття:
- Намалюйте сюжет, що представляє титрування сильної монопротової кислоти сильною основою або сильної основи, титрованої сильною кислотою. Визначте точку еквівалентності і поясніть її значення.
- На сюжеті, про який говорилося вище, намалюйте подібний сюжет, який би відповідав одній системі при більшій або меншій концентрації.
- Намалюйте сюжет, що представляє титрування слабкої монопротової кислоти сильною основою, або слабкої основи, титрованої сильною кислотою. Визначте точки еквівалентності та точки напівеквівалентності.
- Поясніть, що таке кислотно-лужний показник, і як він працює.
- При титруванні розчинів деяких поліпротових кислот з міцною основою можна спостерігати не всі точки еквівалентності. Поясніть найпоширеніші причини цього.
- Обчисліть молярність ГК монопротової кислоти, кінцева точка титрування якої настає після додавання V мл міцної основи заданої концентрації.
Метою кислотно-лужного титрування є визначення\(C_a\) номінальної концентрації кислоти в розчині. У найпростішому вигляді титрування проводять шляхом вимірювання обсягу розчину міцної основи, необхідного для завершення реакції.
\[\ce{H_nA + n OH- → n A- + n H_2O} \label{0-1}\]
в якому\(n\) знаходиться кількість замінних воднів в кислоті. Точка, в якій ця реакція просто завершена, відома як точка еквівалентності. Це слід відрізняти від кінцевої точки, яка є значенням, яке ми спостерігаємо експериментально. Замінний атом водню (іноді його називають «кислим» воднем) - це той, який можна пожертвувати на міцну основу - тобто на OH - іон. Таким чином, в оцтовій кислоті HCOO H «замінним» вважається тільки водень карбоксильної групи.
Те, що ми насправді вимірюємо, звичайно, - це обсяг титранту, який доставляє бюретка. Навчання правильному керуванню запірним краном внизу бюретки зазвичай вимагає певної інструкції і практики, як і читання гучності. Для високоточної роботи концентрація самого титранту повинна бути визначена в окремому експерименті, відомому як «стандартизація».
Розуміння кривих титрування
Графік, що показує рН розчину як функцію кількості доданої основи, відомий як крива титрування. Ці ділянки можуть бути побудовані шляхом побудови pH як функції або обсягу доданої основи, або еквівалентної фракції,\(ƒ\) яка є просто кількістю молів основи, доданої на моль кислоти, присутньої в розчині. У більшості кривих титрування, проілюстрованих у цьому розділі, ми будуємо pH як функцію\(ƒ\). Варто приділити деякий час, щоб ретельно ознайомитися із загальною формою кривої титрування, такою як показана нижче, в якій слабку кислотну ГК титрують сильною основою, як правило, гідроксидом натрію.

Точка еквівалентності відбувається при рН, при якому еквівалентна частка ƒ основи додана одиниця. У цей момент реакція
\[HA + OH^– → AB^– + H_2O \label{1-1}\]
є стехіометрично повним; розчин, спочатку містить n молей ГК монопротової кислоти, тепер буде ідентичний тому, що містить таку ж кількість молей кон'югатної основи A —. У точці напівеквівалентності ƒ = 0,5 концентрації сполучених видів ідентичні: [HA] = [A —]. Це, звичайно, відповідає буферному розчину (звідси відносно плоска частина кривої), рН якого такий же, як pK a.
Оскільки база додається понад ƒ = 1, рН починає вирівнюватися, припускаючи, що інша буферизована система вступила в гру. У цьому випадку в ньому беруть участь розчинник (вода) і гідроксид-іон: {H 2 O} ≈ {OH-}.
Подібний ефект спостерігається на стороні кривої з низьким рН, коли титрується сильна кислота, як на графіку для титрування HCl нижче. У цьому випадку буферизація обумовлена {H 3 O +) ≈ {H2O}.
Як це може бути? Звичайно, концентрація ОН — навіть коли рН наближається до 14, не може бути чимось подібним до [H 2 O], яка буде близько 55,5 М у більшості розчинів! Ця тонка точка (поряд зі згадкою H 2 O/OH — буферизація) рідко згадується в елементарних курсах, оскільки теорія, що стоїть за нею, включає деякі досить езотеричні елементи термодинаміки розчину. Однак, якщо вам цікаво, зверніть увагу, що фігурні дужки в {H 2 O} ≈ {OH —} позначають діяльність, а не концентрації. А за умовністю активність чистої рідини (Н 2 О в даному випадку) - єдність. При рН близько 12 pH = 2, [ОН -] = .01. При цій досить високій концентрації іонів {OH —} буде дещо меншою, ніж ця, але дві дії будуть достатньо схожими, щоб створити ефект буферизації, який ми спостерігаємо.
РН розчину в точці його еквівалентності складе 7, якщо ми титруємо сильну кислоту з сильною основою, як у HCl+ NaOH → H 2 O + NaCl. Однак якщо кислота слабка, як на наведеному вище ділянці, розчин буде лужним. Цей рН можна розрахувати з C b і K b способом точно аналогічним тому, який використовується для розрахунку рН розчину слабкої кислоти у воді.

Важливо розуміти, що еквівалентна фракція ƒ основи, яку необхідно додати, щоб досягти точки еквівалентності, не залежить від сили кислоти та її концентрації в розчині. Вся корисність титрування як засобу кількісного аналізу спирається на цю незалежність; ми у всіх випадках вимірюємо лише загальну кількість молів «кислих» воднів у зразку, що піддається титруванню.
Кислотні і базові сили визначають форму кривої
Хоча сила кислоти не впливає на розташування точки еквівалентності, вона впливає на форму кривої титрування і може бути оцінена на графіку кривої.


Чим слабкіше титрується кислота, тим вище початковий рН (при ƒ=0), і тим меншою буде вертикальна висота ділянки поблизу точки еквівалентності. Як ми побачимо пізніше, це може ускладнити пошук точки еквівалентності, якщо кислота надзвичайно слабка.
Оцінка кислотної сили
Як показано на графіку вище, pK a слабкої кислоти можна оцінити, зазначивши рН, який відповідає точці напівтитрування ƒ = 0,5. Нагадуючи, що рН контролюється співвідношенням концентрацій кон'югатних видів
вище, pK a слабкої кислоти можна оцінити, зазначивши рН, який відповідає точці напівтитрування ƒ = 0,5. Нагадуючи, що рН контролюється співвідношенням концентрацій кон'югатних видів
\[pH = pK_a + \log \dfrac{[A^]}{[HA]} \label{1-2}\]
буде очевидно, що це рівняння знижується до рН = pK a, коли титрування наполовину завершено (тобто коли [ГА] = [А —]), рН розчину буде ідентичний pK a кислоти. Це рівняння не працює для сильних кислот через сильну буферизацію, яка виникає при дуже низькому рН, при якому ƒ = 0,5.

Як зазначено тут, буферизація не має нічого спільного з самою кислотою HCl (яка не існує як такої у воді), а скоріше з продуктами її дисоціації H 3 O + та OH - «найсильнішою кислотою та основою, яка може існувати у воді».
Криві монопротичного титрування
Детальну форму кривої титрування регулюють наступні два принципи:
- Чим сильніше кислота або основа, тим більше буде нахил кривої біля точки еквівалентності;
- Чим слабкіше кислота або основа, тим більше буде відхилення рН від нейтральності в точці еквівалентності.
Важливо розібратися з причинами цих двох відносин. Другий - найпростіший для пояснення. Титрування кислотної ГК з основою, такою як NaOH, призводить до отримання розчину NaA; тобто розчину кон'югатної основи А —. Будучи основою, він буде реагувати з водою з отриманням надлишку гідроксидних іонів, залишаючи слаболужний розчин. Титрування слабкої основи кислотою надасть зворотний ефект.
Ступінь стрибка рН в точці еквівалентності визначається сукупністю факторів. Наприклад, у випадку зі слабкою кислотою початковий рН, швидше за все, буде вище, тому крива титрування починається вище. Далі, чим слабкіше кислота, тим міцніше буде її кон'югатна основа, тим вище буде рН в точці еквівалентності. Ці два фактори піднімають нижню частину кривої титрування. Верхня ступінь кривої, звичайно, обмежена концентрацією та силою титранту.

Ці принципи чітко простежуються в наведених вище сюжетах для титрування кислот і підстав, що мають різну силу. Зверніть увагу на сині криві, які представляють титрування чистої води (дуже слабкої кислоти) з сильною кислотою або основою.
Галерея монопротичних кривих титрування

Коли і титрант і зразок «сильні», ми отримуємо довгі вертикальні ділянки при ƒ = 1. Додавання навіть половини краплі титранту може прийняти нас через точку еквівалентності!

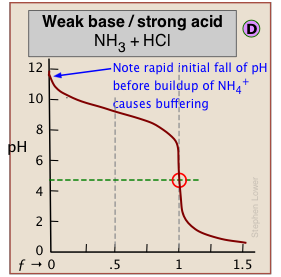
Коли один з реагентів слабкий, рН спочатку швидко змінюється, поки не настане буферизація.
← В (C) початок H 2 O/OH- буферизації поблизу ƒ=1 робить точку еквівалентності важче знайти.
«Слабкі/слабкі» титрування, як правило, є проблематичними, оскільки буферизовані області наближаються до ƒ=1. Точка еквівалентності рН 7 в цих прикладах відображає близьку рівність pK a і pK b реагентів.

Робота з дуже слабкими кислотами
Достовірно виявити точку еквівалентності в титруванні борної кислоти (pK a = 9.3) або інших аналогічно слабких кислот за формою кривої титрування* може бути важко. * Цікавий студентський лабораторний експеримент, який використовує допоміжний реагент (манітол), щоб зробити борну кислоту сильнішою і, таким чином, більш легко титруемой, був описаний в J. Chem Ed. 2012, 89, 767-770.

Проблема тут полягає в тому, що водні розчини буферизовані проти зміни рН при дуже низьких і дуже високих діапазонах рН. Крайній приклад трапляється при титруванні чистої води сильною кислотою або основою. При цих крайніх значеннях рН концентрації H 3 O + і OH - досить великі, що конкуруюча буферна система (або H 3 O +/H 2 O або H 2 O/OH - залежно від того, чи є розчин висококислим або сильно лужна) вступає в гру.
Чому ми зазвичай використовуємо «сильний» титрант
Наведені вище графіки чітко показують, що найбільш легко виявляються точки еквівалентності виникають, коли кислота з титрується сильною основою, такою як гідроксид натрію (або основа титрується сильною кислотою.)
На практиці багато титрування, що проводяться в дослідженнях, промисловості та клінічній практиці, включають суміші більше однієї кислоти. Приклади включають природні води, фізіологічні рідини, фруктові соки, виноробство, пивоваріння та промислові стоки. Для титрування подібних зразків використання чогось іншого, крім сильного титранту, представляє можливість того, що титрант може бути слабшим, ніж один або кілька «сильніших» компонентів у зразку, і в цьому випадку він буде нездатний титрувати ці компоненти до завершення.
Що стосується енергій, вільних від протонів, джерело протонів (кислий титрант) не зможе доставити еквівалентну кількість протонів до (сильнішого) компонента суміші.
поліпронові кислоти
Там буде стільки точок еквівалентності, скільки в кислоті є замінні водні. Таким чином, у надзвичайно важливій карбонатній системі точки еквівалентності спостерігаються як у ƒ=1, так і ƒ=2:


Загалом, існує дві вимоги, щоб чітко помітний стрибок рН відбувався при поліпротному титруванні:
- Послідовні K a повинні відрізнятися на кілька порядків;
- РН точки еквівалентності не повинен бути дуже високим або дуже низьким.
Поділ послідовних констант рівноваги
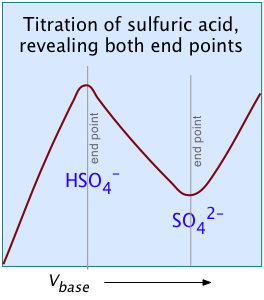
Ефект першої точки видно при порівнянні кривих титрування двох діпротових кислот, сірчистої і бурштинової. Поява тільки однієї точки еквівалентності в останній є наслідком близькості першої і другої констант дисоціації кислоти. pK a сірчистої кислоти (внизу, зліва) досить далеко один від одного, що її крива титрування може розглядатися як суперпозиція двох незалежних монопротичних кислот, що мають відповідні K a. кислотні групи OH з'єднані з одним і тим же центральним атомом, так що локальний негативний заряд, який залишається, коли утворюється HSO 3 - діє на придушення другої стадії дисоціації.
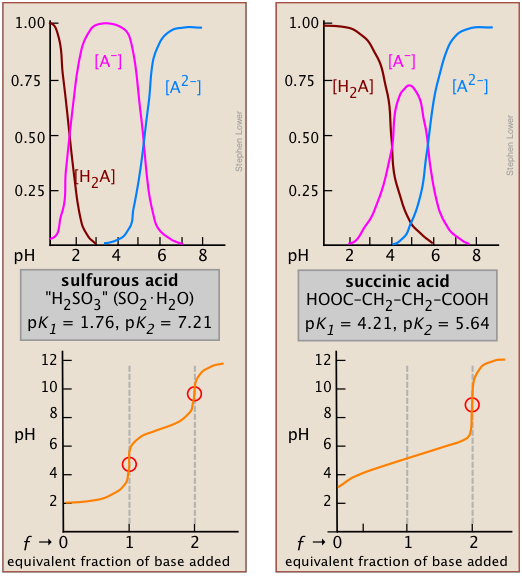
*Можна показати, що в межі великого n співвідношення K 1 /K 2 для симетричної дикарбонової кислоти HOOC- (CH 2) n - СООН сходиться до значення 4.
У бурштинової кислоти дві групи —COOH фізично більш відокремлені і, таким чином, мають тенденцію дисоціюватися самостійно*. Огляд кривих розподілу видів бурштинової кислоти (вгорі, праворуч) показує, що частка амфоліту ГК ніколи не може перевищувати 75 відсотків. Тобто немає рН, при якому реакція H 2 A → HA — + H + можна сказати «повною», тоді як в той же час друга стадія HA — → A 2— + H + відбулася лише в незначній мірі. Таким чином, підвищення рН, яке, як правило, очікується, коли виробляється ГК, буде перешкоджати споживанню OH - на другому етапі, який буде добре просуватися в цей момент; тільки коли всі кроки будуть завершені і гідроксид-іон більше не споживається, рН зросте.
Два інших приклади поліпротових кислот, криві титрування яких не виявляють всіх точок еквівалентності, - це сірчана та фосфорна кислоти. Завдяки ефекту вирівнювання, видимий K a1 H 2 SO 4 настільки близький до K a2 = 0,01, що ефект такий же, як у бурштинової кислоти, тому виявляється лише друга точка еквівалентності.

У фосфорній кислоті третя точка еквівалентності (для HPO 4 2—) затьмарюється H 2 O-OH - буферизація, як пояснювалося раніше.
Виявлення точки еквівалентності
Незалежно від того, чи виявлена точка еквівалентності чітким «розривом» у кривій титрування, вона буде відповідати унікальній концентрації іонів водню, яку можна обчислити заздалегідь. Існує безліч способів визначення точки еквівалентності кислотно-лужного титрування.
Показники

Не перевищуйте точку еквівалента!
Традиційним методом виявлення точки еквівалентності було використання індикаторного барвника, який є другою кислотно-лужною системою, в якій протоновані та депротоновані форми відрізняються за кольором, і pK a якого близький до рН, очікуваного в точці еквівалентності. Якщо титрується кислота не є сильною, важливо тримати концентрацію індикатора якомога нижче, щоб запобігти спотворенню кривої титрування власного споживання ОН.
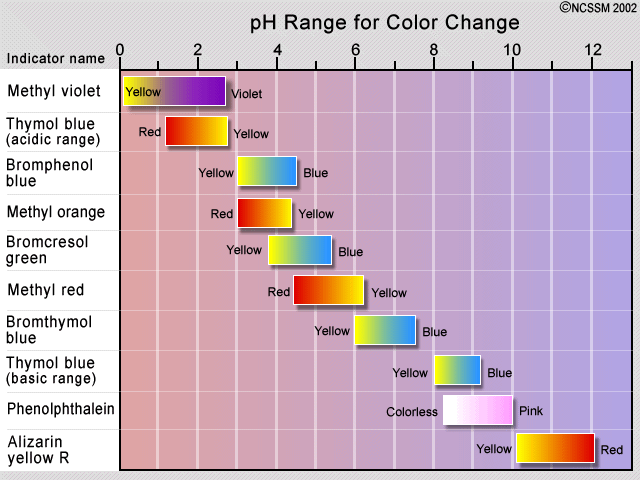
Спостережувана зміна кольору індикатора не відбувається різко, а відбувається в діапазоні приблизно від 1,5 до 2 одиниць рН. Тому показники корисні лише для титрування кислот та підстав, які є достатньо сильними, щоб показати певний розрив кривої титрування. Деякі рослини містять барвники, які можуть виступати в якості природних показників рН. До них відносяться капуста (показана), буряк, квіти гортензії.

Для сильнокислотного - сильного базового титрування можна використовувати практично будь-який показник, хоча найчастіше застосовується фенолфталеїн. Для титрування за участю слабких кислот або підстав, як при кислотному титруванні розчину карбонату натрію, показаного тут, показник повинен мати рК, близький до показаного речовини, що титрується.
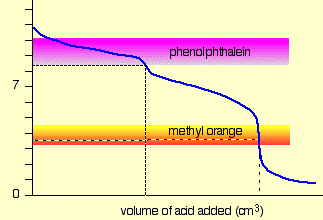
При титруванні поліпротової кислоти або основи потрібні кілька показників, якщо потрібно побачити більше однієї точки еквівалентності. PK a s фенолфталеїну і метилового апельсина складають 9,3 і 3,7 відповідно.
Потенціометрія: Використовуйте рН-метр
РН-метр виявляє напругу, що утворюється, коли іони Н + в розчині витісняють іони Na + з тонкої скляної мембрани, яка занурюється в розчин.

Більш сучасним способом знаходження точки еквівалентності є проходження титрування за допомогою рН-метра. Оскільки він передбачає вимірювання різниці електричних потенціалів між двома електродами, цей метод відомий як потенціометрія. До 1980 року рН-метри були занадто дорогими для регулярного використання в студентських лабораторіях, але це змінилося; потенціометрія зараз є стандартним інструментом для визначення точок еквівалентності.
Покращені методи побудови графіків
Побудова рН після кожного збільшення об'єму титранту може дати криву титрування настільки докладно, як потрібно, але є кращі способи визначення точки еквівалентності. Найбільш поширеним з них є прийняття першого або другого похідних графіка: d (pH) /d V або d 2 (рН) /d V 2 (звичайно, для кінцевих приростів рН та об'єму ці терміни будуть виражені як Δ (рН) /Δ V і Δ 2 (рН) /Δ V 2.)
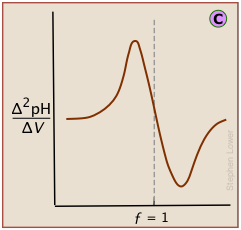
Друга похідна крива знаходить точку перегину, знаходячи, де швидкість зміни рН дорівнює нулю.

Диференціальний графік, що показує швидкість зміни рН щодо об'єму титранту, визначає точку перегину, яка також є точкою еквівалентності

У стандартному графіку pH-VS-об'єму доданого титранту точка перегину розташована візуально як півдорозі уздовж найкрутішої частини кривої.
Ідеалізовані сюжети, показані вище, навряд чи можна побачити на практиці. Коли титрування проводиться вручну, титрант додається з кроком, тому навіть проста крива титрування![]() повинна бути побудована з точок, схильних до невизначеності вимірювання об'єму та рН (особливо якщо остання візуально оцінюється зміною кольору індикатора).
повинна бути побудована з точок, схильних до невизначеності вимірювання об'єму та рН (особливо якщо остання візуально оцінюється зміною кольору індикатора).
Якщо ці дані потім перетворюються в диференціальну форму, ці невизначеності додають певну кількість «шуму» до даних.
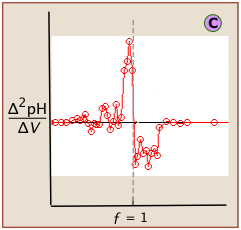
Друга похідна графік використовує показання рН по обидва боки точки еквівалентності, що полегшує пошук при наявності шуму.

Розташування точки еквівалентності дуже сильно залежить від правильного читання лише одного або двох показань рН у верхній частині ділянки.

Проста крива, побудована з невеликої кількості показань рН, не завжди однозначно знайде точку еквівалентності.
«Шум» на диференціальних ділянках зазвичай можна мінімізувати, підтримуючи концентрації титранту та аналіту вище 10 —3 М.
Деякі інші способи дотримання титрування
Моніторинг рН за допомогою індикатора або за допомогою потенціометрії, як описано вище, є стандартними способами виявлення точки еквівалентності титрування. Однак ми вже бачили, що в певних випадках, пов'язаних з поліпротовими кислотами або основами, деякі точки еквівалентності затьмарюються їх безпосередньою близькістю до інших або буферизацією, яка відбувається поблизу крайніх значень діапазону рН. Подібні проблеми можуть виникнути, коли розчин, що підлягає титруванню, містить кілька різних кислот, як це часто буває, коли необхідно контролювати рідини, пов'язані з промисловими процесами.
Візьміть температуру!
Реакції кислотно-лужної нейтралізації HA+ B → A — + BH + завжди екзотермічні; коли протони падають від їх рівня в кислоті до рівня в основі, велика частина краплі вільної енергії виділяється у вигляді тепла. Якщо кислота і основа обидва сильні (тобто повністю дисоційовані), ентальпія нейтралізації для реакції
\[\ce{H3O+ + OH- → 2 H2O}\]
становить -68 кДж моль —1.
Дивіться цю сторінку Вікіпедії, щоб дізнатися більше про термометричні титрування, включаючи багато прикладів. Зверніть увагу також на відео на цю тему в розділі «Відео» в кінці цієї сторінки.
- Термометричні титрування не обмежуються кислотно-лужними визначеннями; вони також можуть бути використані для спостереження за реакціями осадження, складного формування та окислювально-відновних реакцій.
- Їх можна використовувати як з поліпротовими кислотами або підставами, так і з сумішами, що містять більше однієї кислоти або основи.
- Вони здатні слідувати кислотно-лужним титруванням, які повинні проводитися в неводних розчинниках, де інші методи титрування неможливі.
Типова термометрична крива титрування складається з двох гілок, починаючи з крутого підвищення температури, коли додається титрант реагує з аналітом, виділяючи тепло. Після досягнення точки еквівалентності підйом швидко зменшується, оскільки виробництво тепла зупиняється. Потім, у міру того, як суміш починає охолоджуватися, сюжет передбачає негативний ухил.

Хоча грубе вказівку точки еквівалентності можна оцінити шляхом екстраполяції лінійних частин кривої (сині пунктирні лінії), диференціальні методи, описані вище, як правило, є кращими.
Слідкуйте за електролітичною провідністю
Кислоти і основи є електролітами, що означає, що їх розчини проводять електричний струм. Провідність таких розчинів залежить від концентрацій іонів, а в меншій мірі - від характеру конкретних іонів. Будь-яка хімічна реакція, при якій відбувається зміна загальної кількості іонів в розчині, зазвичай може супроводжуватися контролем провідності. До цієї категорії відносяться кислотно-лужні титрування. Розглянемо, наприклад, титрування соляної кислоти гідроксидом натрію. Це можна описати рівнянням
\[\ce{H^{+} + Cl^{–} + Na^{+} + OH^{–} → H2O + Na^{+} + Cl^{–}} \label{2-1}\]
що показує, що два з чотирьох видів об'єднаних іонів зникають в точці еквівалентності. Під час титрування провідність розчину падає при витраті H + і Cl — іонів. У точці еквівалентності провідність проходить мінімум, а потім підвищується, оскільки тривале додавання титранту додає більше Na + та OH — іонів до розчину.

Кожен вид іонів вносить свій внесок у провідність розчину. Якби ми могли спостерігати внесок кожного іона окремо, побачимо, що нахили для H + і OH — набагато більше. Це відображає набагато більшу провідність цих іонів завдяки їх унікальному швидкому переміщенню через розчин, перестрибуючи через молекули води.

Однак, оскільки провідність окремих іонів не може спостерігатися безпосередньо, вимірювання провідності завжди реєструють загальну провідність усіх іонів у розчині. Зміна провідності, яка фактично спостерігається під час титрування HCl гідроксидом натрію, є сумою іонних провідностей, показаних вище.
Для більшості звичайних кислотно-лужних титрувань кондуктометрія рідко пропонує якусь особливу перевагу перед регулярним об'ємним аналізом за допомогою індикаторів або потенціометрії. Це особливо вірно, якщо титрується кислота слабка; якщо pK a набагато нижче 2, зростаюча сольова лінія (Na + при титруванні з NaOH) переповнює падіння внеску невелику кількість Н + робить до провідності, тим самим запобігаючи будь-якому мінімум у кривій загальної провідності від того, що видно.
Однак у деяких особливих випадках, таких як наведені нижче, кондуктиметрія є єдиним методом, здатним дати корисні результати.

Ці приклади ілюструють дві унікальні можливості кондуктометричного титрування: (ліворуч) титрування суміші двох кислот і (праворуч) титрування сильної поліпротової кислоти →
Оскільки чистий H 2 SO 2 є нейтральною молекулою, він не вносить ніякого внеску в провідність, яка підвищується до максимуму в точці еквівалентності.
Автоматизація процесу
За чотири роки лабораторних сесій коледжу багато спеціальностей хімії, швидше за все, здійснять менше десятка титрувань. Однак у реальному світі час - це гроші, і давно минули часи, коли техніків працювали повний робочий день лише для титрування декількох зразків на таких підприємствах, як пивоварні, харчова промисловість (наприклад, змішування консервованого апельсинового соку), клінічні лабораторії та біохімічні дослідження.
Розрахунки титрування
Титрування проводять шляхом додавання достатнього обсягу\ Vo розчину титранту до відомого обсягу\ Vt титруваного розчину. Це додавання триває до тих пір, поки не буде досягнута кінцева точка. Кінцевою точкою є наше експериментальне наближення точки еквівалентності, в якій кислотно-лужна реакція стехіометрично завершена (ƒ = 1). Кількість, яку ми фактично вимірюємо в кінцевій точці, - це об'єм V_eP титранту, що доставляється до розчину, що проходить титрування.
Розчин, що титрується, часто називають аналітом (речовина, що «аналізується») або, рідше, як титранд. Останній термін ми будемо використовувати в наступному.
При простому титруванні ГК монопротової кислоти основою В точка еквівалентності відповідає завершенню реакції
\[\ce{HA + B → A^{–} + BH^{+} }\label{3-1}\]
де були об'єднані еквівалентні кількості ГК і В; тобто
M HA = M B (де M представляє кількість родимок.)
Нагадаємо, що кількість молів задається добутком обсягу і концентрації:
L × моль L —1 = моль,
мл х ммоль мл -1 = ммоль.
Оскільки ми вимірюємо обсяг титранту, а не кількість родимок, нам потрібно використовувати його концентрацію, щоб зв'язати дві величини. Отже, якщо ми титруємо основу B кислотою ГК, кінцева точка досягається при додаванні об'єму V HA. Кількість доданих нами молів ГК в кінцевій точці задається добутком його обсягу і концентрації.
\[M_{HA} = V_{HA} \times C_{HA} \label{3-2}\]
І оскільки реакція\ ref {3-1} тепер завершена, M HA = M B; таким чином, в кінцевій точці будь-якого монопротичного титрування,
\[V_{HA} C_{HA} = V_B C_B \label{3-3}\]
Важливим є рівняння\ ref {3-3}! При будь-якому титруванні відомі як обсяг, так і концентрація титранта, тому невідома концентрація легко обчислюється.
При титруванні, проведених в лабораторії, титрант доставляється бюреткою, яка зазвичай калібрується в мілілітрах, тому зручніше експресувати M HA в мілімолі і C HA в мілімоль/мл (ммоль мл —1); зверніть увагу, що останній чисельно такий же, як моль/л.
50,0 мл 0,100 М соляної кислоти титрують 0,200 М гідроксидом натрію. Який обсяг розчину NaOH буде додано в точці еквівалентності?
Рішення
Спочатку знайдіть кількість родимок HCl в титранді:
\[\begin{align*} M_{\ce{HCl}} &= C_{\ce{HCl}} \times V_{\ce{HCl}} \\[4pt] &= (0.100\, mMol\, mL^{–1}) \times (50.0\, mL) \\[4pt] &= 5.0 \,mMol\,\ce{HCl} \end{align*}\]
Ця ж кількість родимок NaOH повинна бути доставлена бюреткою, щоб досягти точки еквівалентності (тобто M NaOH = 5,0 ммоль.)
Обсяг розчину NaOH M NaOH, необхідний
V NaOH = (М NaOH/C NaOH) = (5,0 ммоль)/(0,200 ммоль/мл) = 25 мл
