11.1: Введення в хімічну рівновагу
- Page ID
- 19126
- Визначте «рівноважний стан хімічної реакційної системи». У чому його практичне значення?
- Створіть значення і значення наступних термінів:
- оборотна реакція
- кількісна реакція
- кінетично гальмована реакція
- Поясніть значення твердження «рівновага макроскопічно статична, але мікроскопічно динамічна». Дуже важливо!
- Поясніть, як відносні величини прямої та зворотної констант швидкості реакції у вираженні Mass Action впливають на рівноважний склад реакційної системи.
- Опишіть кілька речей, які ви могли б шукати під час експерименту, які допоможуть визначити, чи реакційна система знаходиться в її рівноважному стані.
Хімічні зміни є однією з двох центральних концепцій хімічної науки, інша - структура. Самі витоки самої хімії кореняться в спостереженнях таких перетворень, як спалювання деревини, замерзання води і виграш металів з їх руд, які завжди були частиною людського досвіду. Зрештою, саме прагнення до певної постійності, що лежить в основі змін, призвело грецьких мислителів близько 200 до н.е. До н.е. до ідеї елементів, а пізніше до атома. Для наукового вивчення матерії знадобиться майже 2000 років, щоб підібрати ці поняття та включити їх у те, що виникло б у другій частині 19 століття як сучасний погляд на хімічні зміни.
Хімічна зміна: як далеко, як швидко?
Хімічна зміна відбувається, коли атоми, що входять до складу однієї або декількох речовин, переставляються таким чином, що утворюються нові речовини. Ці речовини є складовими хімічної реакційної системи; ті компоненти, які зменшуються в кількості, називаються реагентами, а ті, що збільшуються, - продуктами. Дана хімічна реакційна система визначається збалансованим чистим хімічним рівнянням, яке умовно записується як
\[\text{reactants} \rightarrow \text{products}\]
Перше, що нам потрібно знати про хімічну реакцію, представлену збалансованим рівнянням, - чи може вона насправді відбутися. Якщо реагенти і продукти - це всі речовини, здатні до самостійного існування, то в принципі відповідь завжди «так». Ця відповідь повинна бути кваліфікована, однак, з наступних міркувань:
- Наскільки повна реакція?
- Тобто, яка частка реагентів перетворюється в продукти? Деякі реакції перетворюють по суті 100% реагентів у продукти, тоді як для інших кількість продуктів може бути непомітним. Багато хто знаходиться десь посередині, а це означає, що значні кількості всіх компонентів залишаються в кінці. Пізніше, в іншій частині курсу, ви дізнаєтеся, що тенденцію реакції до виникнення можна передбачити повністю з властивостей реагентів і продуктів через закони термодинаміки.
- Як швидко відбувається реакція?
- Деякі реакції закінчилися в мікросекундах; інші займають роки. Швидкість будь-якої однієї реакції може варіюватися у величезному діапазоні в залежності від температури, стану речовини (газу, рідини, твердої речовини) і наявності каталізатора. На відміну від питання повноти, не існує простого способу прогнозування швидкості реакції.
- Який механізм реакції?
- Що відбувається на атомному або молекулярному рівні, коли реагенти перетворюються в продукти? Які проміжні види (ті, які виробляються, але пізніше споживаються, щоб вони не відображалися в рівнянні чистої реакції) беруть участь? Це мікроскопічний, або кінетичний погляд на хімічні зміни, і його неможливо передбачити теорією, оскільки вона зараз розроблена і повинна бути виведена з результатів експериментів.
Реакція, яка термодинамічно можлива, але для якої немає достатньо швидкого механізму, вважається кінетично обмеженою. І навпаки, той, який відбувається швидко, але лише в невеликій мірі, термодинамічно обмежений. Як ви побачите пізніше, часто існують способи обійти обидва види обмежень, і їх відкриття та практичне застосування складають важливу область промислової хімії.
Що таке рівновага?
В основному цей термін відноситься до того, що ми могли б назвати «балансом сил». У випадку з механічною рівновагою це його буквальне визначення. Книга, що сидить на стільниці, залишається в стані спокою, оскільки сила вниз, що чиниться земною гравітацією, що діє на масу книги (саме це мається на увазі під «вагою» книги) точно врівноважується силою відштовхування між атомами, яка заважає двом об'єктам одночасно займати один і той же простір, діючи в цьому випадку між поверхнею столу і книгою. Якщо взяти в руки книгу і підняти її над стільницею, додаткова висхідна сила, що чиниться вашою рукою, руйнує стан рівноваги, коли книга рухається вгору. Якщо ви хочете тримати книгу в стані спокою над столом, ви регулюєте висхідну силу, щоб точно врівноважити вагу книги, тим самим відновлюючи рівновагу.

Об'єкт знаходиться в стані механічної рівноваги, коли він або статичний (нерухомий), або в стані незмінного руху. З відношення f = ma видно, що якщо чиста сила на об'єкт дорівнює нулю, його прискорення також повинно бути нулем, тому, якщо ми бачимо, що об'єкт не зазнає змін у своєму русі, ми знаємо, що він знаходиться в механічній рівновазі.
Теплова рівновага
Інший вид рівноваги, яку ми всі відчуваємо, - це теплова рівновага Коли два об'єкти контактують, тепло буде надходити від більш теплого предмета до більш холодного, поки їх температури не стануть однаковими. Теплова рівновага виникає через тенденцію теплової енергії ставати максимально розсіяною або «розрідженою».
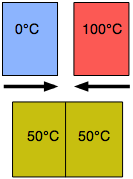
Металевий предмет при кімнатній температурі буде відчувати себе прохолодно до вашої руки, коли ви вперше піднімаєте його, тому що теплові датчики у вашій шкірі виявляють потік тепла від вашої руки в метал, але коли метал наближається до температури вашої руки, це відчуття зменшується. Час, необхідний для досягнення теплової рівноваги, залежить від того, наскільки легко тепло проводиться всередині і між об'єктами; таким чином, дерев'яний предмет буде відчувати себе тепліше, ніж металевий предмет, навіть якщо обидва знаходяться при кімнатній температурі, оскільки деревина є відносно поганим тепловим провідником і, отже, буде видаляти тепло з вашого рука повільніше.
Теплова рівновага - це те, чого ми часто хочемо уникнути або, принаймні, відкласти; саме тому ми утеплюємо будівлі, потіємо влітку і носимо важчий одяг взимку.
Хімічна рівновага
Коли хімічна реакція відбувається в контейнері, яка перешкоджає потраплянню або виходу будь-якого з речовин, що беруть участь у реакції, кількість цих компонентів змінюється, коли деякі споживаються, а інші утворюються. З часом ця зміна прийде до кінця, після чого склад залишиться незмінним до тих пір, поки система залишається непорушеною. Тоді система, як кажуть, знаходиться в рівноважному стані, або простіше кажучи, «в рівновазі».
Чому реакції йдуть до рівноваги
Яка природа «балансу сил», що рухає реакцію на хімічну рівновагу? Це, по суті, баланс між тенденцією енергії проживати в хімічних зв'язках стабільних молекул, і її тенденцією до розсіювання і розрідження. Екзотермічні реакції особливо ефективні в цьому, оскільки виділяється тепло розсіюється в нескінченно ширшому світі оточення.
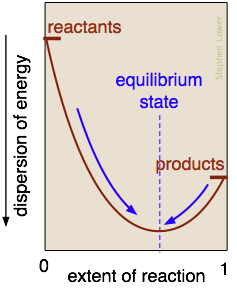
У представленій тут реакції ця точка балансу виникає, коли близько 60% реагентів були перетворені в продукти. Після того, як цей стан рівноваги буде досягнуто, подальших чистих змін не відбудеться. Єдині спонтанні зміни, які допускаються слідом за стрілками, що вказують на максимальний розгін енергії.
Рівновага - це смерть!
Хімічна рівновага - це те, чого ви обов'язково хочете уникнути для себе якомога довше. Безліч хімічних реакцій в живих організмах постійно рухаються до рівноваги, але не дозволяють потрапити туди шляхом введення реагентів і видалення продуктів. Тому замість того, щоб бути в рівновазі, ми намагаємося підтримувати «сталий» стан, який фізіологи називають гомеостазом — підтримкою постійного внутрішнього середовища. Рівновага - це смерть!
На даний момент дуже важливо, щоб ви знали таке визначення:
Напрямок, в якому пишеться хімічна реакція (і, таким чином, які компоненти вважаються реагентами, а які є продуктами), є довільним. Розглянемо наступні дві реакції:
\[\underset{\text{synthesis of hydrogen iodide}}{H_2 + I_2 \rightarrow 2 HI} \label{10.1}\]
\[\underset{\text{dissociation of hydrogen iodide}}{2 HI \rightarrow H_2 + I_2} \label{10.2}\]
Рівняння\(\ref{10.1}\) і\(\ref{10.2}\) являють собою ту саму систему хімічних реакцій, в якій ролі компонентів змінюються, і обидва дають однакову суміш компонентів, коли зміна завершена. Це займає центральне місце в концепції хімічної рівноваги. Немає різниці, чи ми починаємо з двох родимок HI або по одному молю кожен з H 2 і I 2; як тільки реакція закінчиться, кількість цих двох компонентів буде однаковою. Загалом, тоді можна сказати, що склад хімічної реакційної системи буде прагнути змінюватися в напрямку, що наближає її до її рівноважного складу. Після того, як цей рівноважний склад буде досягнутий, подальша зміна кількості компонентів не відбудеться до тих пір, поки система залишається непорушеною.
Склад хімічної реакційної системи буде прагнути змінюватися в напрямку, що наближає її до рівноважного складу.
Дві діаграми нижче показують, як концентрації трьох компонентів цієї хімічної реакції змінюються з часом. Ретельно вивчіть два набори ділянок, зазначивши, які речовини мають нульові початкові концентрації, і, таким чином, є «продуктами» показаних рівнянь реакції. Задовольніть себе, що ці два набори являють собою одну і ту ж систему хімічних реакцій, але з реакціями, що відбуваються в протилежних напрямках. Найголовніше, зверніть увагу, як кінцеві (рівноважні) концентрації компонентів однакові в двох випадках.
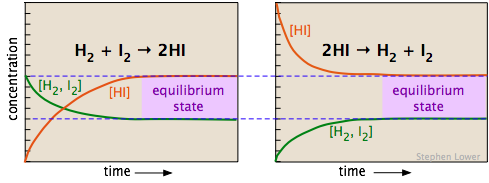
Чи починаємо ми з еквимолярної суміші H 2 і I 2 (зліва) або чистого зразка йодистого водню (показано праворуч, використовуючи подвійну початкову концентрацію HI, щоб зберегти кількість атомів однаковим), склад після рівноваги досягається (затінені області на право) буде однаковим.
Рівноважний склад не залежить від напрямку, з якого він наближається (тобто початкових умов).
Хімічне рівняння форми A → B являє собою перетворення A в B, але це не означає, що всі реагенти будуть перетворені в продукти, або що зворотна реакція B → A також не може відбутися. Загалом, можна очікувати, що обидва процеси (прямий і зворотний), в результаті чого вийде рівноважна суміш, що містить кінцеві кількості всіх компонентів реакційної системи. (Ми використовуємо слово компоненти, коли не хочемо розрізняти реагенти та продукти.)
Якщо рівноважний стан таке, в якому присутні значні кількості як реагентів, так і продуктів (як у прикладі йодиду водню, наведеному вище), то реакція говорять про неповну або оборотну. Останній термін є кращим, оскільки він уникає плутанини з «повним» в іншому сенсі завершення або завершення, маючи на увазі, що реакція пройшла свій курс і зараз знаходиться в рівновазі.
Зауважте, що немає принципової різниці між значеннями A → B і A B. Деякі старі підручники просто використовують A = B.
- Якщо потрібно підкреслити оборотність реакції, єдина стрілка в рівнянні замінюється парою зачеплених ліній, що вказують в протилежні сторони, як в A
B.
- Кажуть, що реакція є повною або кількісною, коли рівноважний склад не містить значної кількості реагентів. Однак реакція, яка є повною, коли написана в одному напрямку, кажуть «не відбуватися», коли написана в зворотному напрямку.
В принципі, всі хімічні реакції оборотні, але ця оборотність може не спостерігатися, якщо частка продуктів в рівноважної суміші дуже мала, або якщо зворотна реакція дуже повільна (хімічний термін - "кінетично гальмується «)
Як Наполеон Бонапарт допоміг виявити оборотні реакції?
Ми можемо подякувати Наполеону за те, що він довів концепцію оборотності реакції до хімії. Наполеон завербував видатного французького хіміка Клода Луї Бертоле (1748-1822), щоб супроводжувати його як науковий радник у найвіддаленіших його походах, експедиції в Єгипті в 1798 році. Одного разу в Єгипті Бертолет помітив відкладення карбонату натрію по краях деяких знайдених там солоних озер. Він вже був знайомий з реакцією.
\[Na_2CO_3 + CaCl_2 \rightarrow CaCO_3 + 2 NaCl \label{10.3}\]
який, як відомо, приступає до завершення в лабораторії. Він відразу зрозумів, що Na 2 CO 3, мабуть, був утворений зворотним процесом, викликаним дуже високою концентрацією солі у водах, що повільно випаровуються. Це змусило Бертолле поставити під сумнів віру того часу, що реакція може протікати лише в одному напрямку. Його знаменитий підручник Essai de statique chimique (1803) представив свої припущення про хімічну спорідненість і його відкриття, що надлишок продукту реакції може привести його в зворотному напрямку.
На жаль, Бертолле трохи захопився ідеєю про те, що на реакцію може впливати кількість присутніх речовин, і стверджував, що те ж саме повинно бути вірно і для композицій окремих сполук. Це призвело його до конфлікту з нещодавно прийнятим Законом певних пропорцій (що сполука складається з фіксованих чисел складових атомів), тому його ідеї (хороші разом з поганими) були швидко дискредитували і залишалися значною мірою забутими протягом 50 років. (За іронією долі, зараз відомо, що певні класи сполук насправді демонструють змінний склад такого роду, який передбачав Бертолет.)
Що таке закон масової дії?
Ідеї Бертолле про оборотні реакції були остаточно виправдані експериментами, проведеними іншими, особливо норвезькими хіміками (і зятями) Като Гульдберг і Пітер Ваге. У період 1864-1879 років вони показали, що до рівноваги можна наблизитися з будь-якого напрямку (див. Ілюстрацію йодиду водню вище), маючи на увазі, що будь-яка реакція
\[aA + bB \rightarrow cC + dD\]
це дійсно конкуренція між «вперед» і «зворотною» реакцією. Коли реакція знаходиться в рівновазі, швидкості цих двох реакцій ідентичні, тому ніяких чистих (макроскопічних) змін не спостерігається, хоча окремі компоненти активно трансформуються на мікроскопічному рівні.
Хімічна рівновага динамічна!
Гульдберг і Вааге показали, що за реакцію
\[aA + bB \rightarrow cC + dD\]
швидкість (швидкість) реакції в будь-якому напрямку пропорційна тому, що вони називали «активними масами» різних компонентів:
- швидкість прямої реакції = k f [A] a [B] b
- швидкість зворотної реакції = k r [C] c [D] d
в якому константи пропорційності k називаються константами швидкості, а величини в квадратних дужках представляють концентрації. Якщо ми об'єднаємо два реагенти A і B, пряма реакція починається негайно; потім, коли продукти C і D починають накопичуватися, відбувається зворотний процес. У міру протікання реакції швидкість прямої реакції зменшується, тоді як швидкість зворотної реакції збільшується. Зрештою два процеси протікають з однаковою швидкістю, і реакція знаходиться в рівновазі:
швидкість прямої реакції = швидкість зворотної реакції
\[k_f [A]^a [B]^b = k_r [C]^c [D]^d\]
Дуже важливо, щоб ви розуміли значення цього відношення. Рівноважний стан - це таке, при якому немає чистої зміни кількостей реагентів і продуктів. Але не плутайте це зі станом «без змін»; при рівновазі пряма і зворотна реакції тривають, але однаковими темпами, по суті скасовуючи один одного.
Рівновага макроскопічно статична, але мікроскопічно динамічна! Щоб ще більше проілюструвати динамічний характер хімічної рівноваги, припустимо, що тепер ми змінюємо склад системи раніше в рівновазі, додаючи деяку С або виводячи деяку А (таким чином змінюючи їх «активні маси»). Зворотна швидкість тимчасово перевищить форвардну швидкість і буде відбуватися зміна складу («зсув в рівновазі») до досягнення нового рівноважного складу.Склад стану рівноваги Залежить від співвідношення прямих і зворотних констант швидкості.
Будьте впевнені, що ви розумієте різницю між швидкістю реакції та постійною швидкістю. Остання, зазвичай позначається k, пов'язує швидкість реакції з концентрацією одного або декількох компонентів реакції — наприклад, швидкість = k [A]. При рівновазі швидкості прямого і зворотного процесів ідентичні, але константи швидкості взагалі різні. Щоб побачити, як це працює, розглянемо спрощену реакцію A → B у наступних трьох сценаріях.
- к ф >> к р
- Якщо константи швидкості сильно відрізняються (на багато порядків), то для цього потрібно, щоб рівноважні концентрації продуктів перевищували концентрації реагентів за однаковим співвідношенням. Таким чином, рівноважний склад буде сильно лежати на «правому»; реакція можна сказати «повна» або «кількісна».

- k f << к р
- Норми можуть бути ідентичними (рівновага досягається) тільки в тому випадку, якщо концентрації продуктів дуже малі. Описуємо отримане рівновагу як сильно сприяє лівому; утворюється дуже мало продукту. У самих крайніх випадках можна навіть сказати, що «реакція не відбувається».

- к ф ≈ к р
- Якщо k f і k r мають зіставні значення (в межах, скажімо, декількох порядків), то значні концентрації продуктів і реагентів присутні при рівновазі; ми говоримо, що реакція «неповна» і «оборотна».
Зображення, показані нижче, пропонують ще один спосіб розгляду цих трьох випадків. На сюжетах показано, як змінюються відносні концентрації реагенту і продукту в ході реакції. Ділянки відрізняються припущеннями, які ми робимо про відношення k f до k r. Рівноважний склад системи ілюструється пропорціями A і B в горизонтальних частинок кожної ділянки, де композиція залишається незмінною. У кожному випадку дві константи швидкості досить близькі за величиною, щоб кожну реакцію можна вважати «неповною».
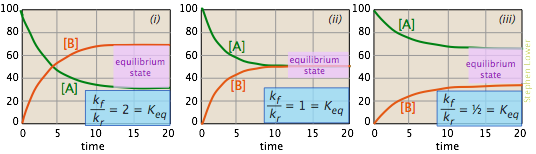
- У сюжеті (i) постійна швидкості вперед вдвічі більша за постійну зворотної швидкості, тому продукт (B) є сприятливим, але існує достатня зворотна реакція для підтримки значної кількості А.
- У (ii) константи прямої та зворотної швидкості мають однакові величини. Не дивно, що так само і рівноважні значення [A] і [B].
- У (iii) постійна зворотної швидкості перевищує постійну прямої швидкості, тому рівноважний склад, безумовно, «зліва».
Таким чином, Закон масової дії - це, по суті, твердження про те, що рівноважний склад реакційної суміші може змінюватися залежно від кількості присутніх компонентів. Це, звичайно, саме те, що Бертолле спостерігав у своїх єгипетських соляних ставках, але тепер ми розуміємо, що це наслідок динамічного характеру хімічної рівноваги.
Коли реакція на рівновагу?
Зрозуміло, що якщо ми спостерігаємо деякі зміни, що відбуваються - зміна кольору, виділення бульбашок газу, поява осаду або виділення тепла, ми знаємо, що реакція ще не знаходиться в рівновазі. Однак відсутність будь-яких видимих змін само по собі не встановлює, що реакція знаходиться в рівновазі. Рівноважний стан - це той стан, при якому не тільки не відбувається зміни складу, але і таке, при якому немає енергетичної тенденції до подальших змін. На жаль, «тенденція» - це не властивість, яка безпосередньо спостерігається! Розглянемо, наприклад, реакцію, що представляє собою синтез води з її елементів:
\[2 H_{2(g)} + O_{2(g)} \rightarrow 2 H_2O_{(g)} \label{10.5}\]
Ви можете зберігати два газоподібні реагенти в одному контейнері на невизначений термін без будь-яких помітних змін. Але якщо ви створите електричну іскру в ємності або введете полум'я, тріщіть! Після того, як ви заберете себе з підлоги і видалите шрапнель з того, що залишилося від вашого тіла, ви будете дуже добре знати, що система спочатку не була в рівновазі! Буває, що ця конкретна реакція має величезну тенденцію до виникнення, але з причин, про які ми обговоримо в наступному розділі, нічого не може статися, поки ми якимось чином не «відключимо її» - в цьому випадку піддаючи суміш полум'я або іскри, або (більш щадним способом) шляхом введення платинового дроту, який виступає каталізатором.
Реакція такого роду, як кажуть, дуже сприятлива термодинамічно, але інгібується кінетично. Аналогічна реакція водню і йоду
\[H_{2(g)} + I_{2(g)} \rightarrow 2 HI_{(g)} \label{10.6}\]
навпаки, лише помірно сприятливий термодинамічно (і, таким чином, є неповним), але його кінетика є одночасно невражаючою і досить легкою.
Деякі прості тести для стану рівноваги
- Як ми пояснили вище в контексті закону масової дії, додавання або видалення одного компонента реакції вплине на суми всіх інших. Наприклад, якщо ми додамо більше реагенту, ми очікуємо, що концентрація продукту зміниться. Якщо цього не відбувається, то цілком ймовірно, що реакція кінетично гальмується і що система не в змозі досягти рівноваги.
- Однак майже завжди так, що як тільки реакція дійсно почнеться, вона триватиме сама по собі, поки не досягне рівноваги, тому якщо ми зможемо спостерігати за зміною, як вона відбувається, і побачити, як вона сповільнюється і зупиняється, ми можемо бути досить впевнені, що система знаходиться в рівновазі. Це, безумовно, найпоширеніший критерій хіміка.
- Існує ще один експериментальний тест на рівновагу в хімічній реакції, хоча він дійсно застосовується лише до тих реакцій, які ми описали вище як оборотні. Як ми побачимо пізніше, стан рівноваги системи завжди чутливий до температури, а часто і до тиску, тому будь-які зміни цих змінних, однак, невеликі, тимчасово порушать рівновагу, що призведе до помітної зміни складу системи, коли вона рухається до своєї нової стан рівноваги.
Резюме
Переконайтеся, що ви добре розумієте наступні основні ідеї, які були представлені вище.
- Будь-яка реакція, яка може бути представлена збалансованим хімічним рівнянням, може мати місце, принаймні в принципі. Однак є дві важливі кваліфікації:
- Тенденція до змін може бути настільки маленькою, що кількість продуктів, що утворюються, може бути дуже низьким, а можливо і незначним.
Реакція такого роду, як кажуть, термодинамічно гальмується. Тенденція до хімічних змін регулюється виключно властивостями реагентів і продуктів, і її можна передбачити, застосовуючи закони термодинаміки. - Швидкість, з якою протікає реакція, може бути дуже маленькою, або навіть нульовою, в цьому випадку ми говоримо, що реакція кінетично гальмується. Швидкість реакції залежить від механізму реакції— тобто від того, що насправді відбувається з атомами, коли реагенти перетворюються на продукти. Механізми реакції взагалі неможливо передбачити, і їх потрібно розробити експериментально. Також одна і та ж реакція може мати різні механізми при різних умовах.
- Тенденція до змін може бути настільки маленькою, що кількість продуктів, що утворюються, може бути дуже низьким, а можливо і незначним.
- У міру хімічної зміни кількості компонентів з одного боку рівняння реакції зменшуватимуться, а ті, що знаходяться на іншій стороні, збільшуватимуться. З часом реакція сповільнюється і склад системи перестає змінюватися. У цей момент реакція знаходиться в рівноважному стані, і ніяких подальших змін складу не відбудеться до тих пір, поки система залишиться непорушеною.
- Для багатьох реакцій рівноважний стан - це таке, при якому компоненти по обидва боки рівняння (тобто і реагенти, і продукти) присутні в значних кількостях. Така реакція, як кажуть, неповна або оборотна.
- Рівноважний склад не залежить від напрямку, з якого він наближається; маркування речовин як «реагентів» або «продуктів» цілком справа зручності. (Див. Графіки реакції йодиду водню вище.)
- Закон масової дії стверджує, що будь-яка хімічна зміна - це конкуренція між прямою реакцією (зліва направо в хімічному рівнянні) і зворотною реакцією. Швидкість кожного з цих процесів регулюється концентраціями речовин, що реагують; у міру протікання реакції ці швидкості наближаються один до одного і при рівновазі стають ідентичними.
- З вищесказаного випливає, що рівновага - це динамічний процес, при якому мікроскопічні зміни (пряма і зворотна реакції) продовжують відбуватися, але макроскопічні зміни (зміни кількостей речовин) відсутні.
- Коли хімічна реакція знаходиться в рівновазі, будь-яке порушення системи, таке як зміна температури, або додавання або видалення одного з компонентів реакції, «змістить» склад в новий рівноважний стан. Це єдиний однозначний спосіб перевірки того, що реакція знаходиться в рівновазі. Той факт, що склад залишається статичним, сам по собі не доводить, що реакція знаходиться в рівновазі, тому що зміна може бути кінетично гальмована.
