20.5: Флуоресцентні методи авто-антитіл
- Page ID
- 3976
Цілі навчання
- Опишіть переваги імунофлюоресцентних аналізів на антитіла порівняно з нетлуоресцентними аналізами
- Порівняйте прямі та непрямі флуоресцентні антитіла
- Поясніть, як проточний цитометр можна використовувати для кількісної оцінки конкретних підмножин клітин, присутніх у складній суміші типів клітин
- Поясніть, як сортувальник клітин, активований флуоресценцією, може бути використаний для поділу унікальних типів клітин
Швидка візуалізація бактерій з клінічного зразка, такого як мазок з горла або мокрота, може бути досягнута за допомогою методів флуоресцентних антитіл (ФА), які прикріплюють флуоресцентний маркер (фтороген) до постійної області антитіла, що призводить до репортерної молекули, яка швидко використовується, легко побачити або виміряти, і здатний прив'язуватися до цільових маркерів з високою специфічністю. Ми також можемо позначити клітини, що дозволяє нам точно кількісно визначити певні підмножини клітин або навіть очистити ці підмножини для подальших досліджень.
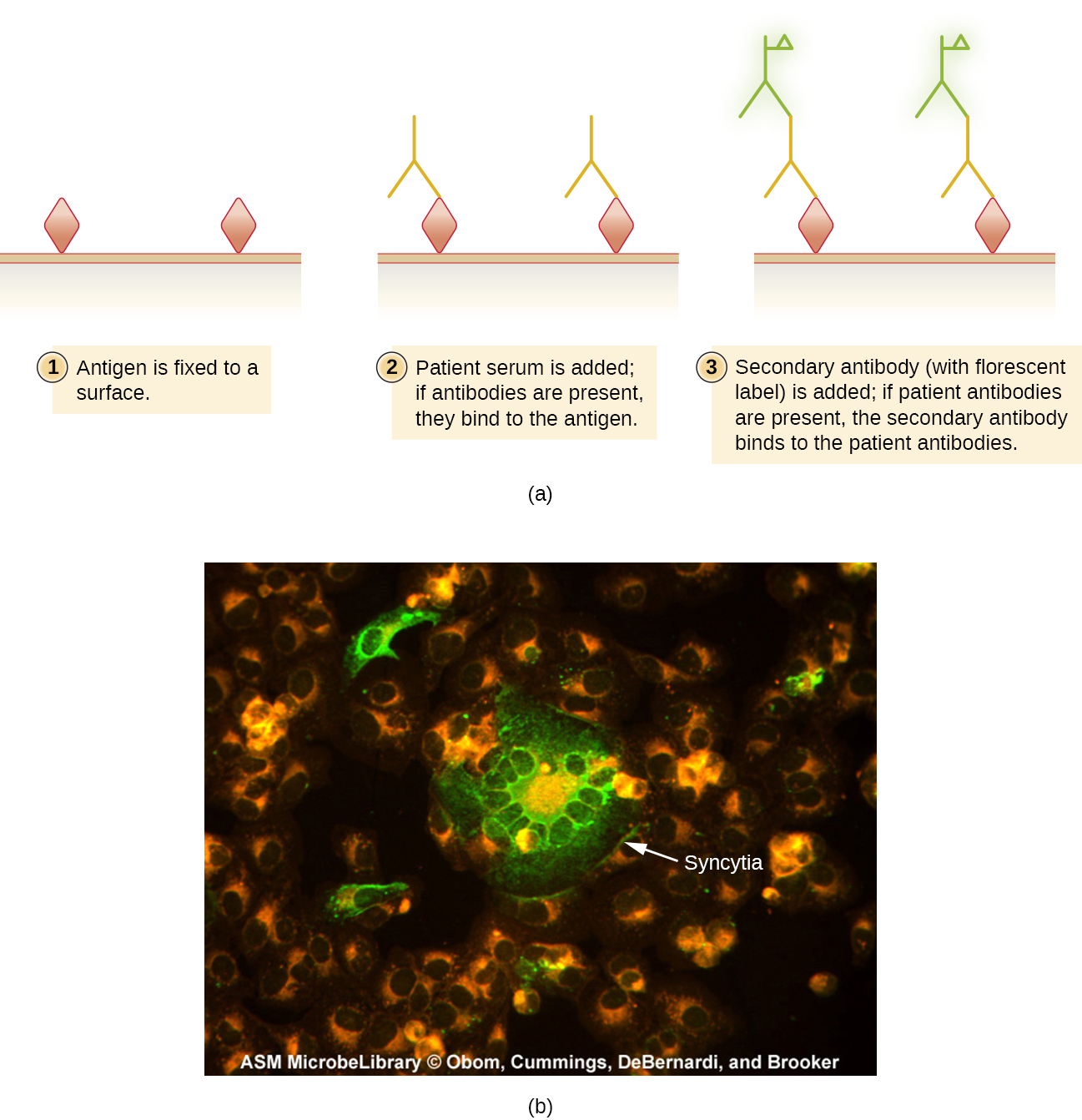
Як і у випадку з ферментними аналізами, методи FA можуть бути прямими, при яких мічений MaB зв'язує антиген, або непрямим, при якому вторинні поліклональні антитіла зв'язують антитіла пацієнта, які реагують на підготовлений антиген. Застосування цих двох методів було продемонстровано на малюнку 2.3.8. Методи FA також використовуються в автоматизованих системах підрахунку та сортування клітин для перерахування або відокремлення мічених субпопуляцій клітин у зразку.
Прямі флуоресцентні антитіла
Прямі флуоресцентні антитіла (DFA) тести використовують флуоресцентно позначений MaB для зв'язування та освітлення цільового антигену. Тести DFA особливо корисні для швидкої діагностики бактеріальних захворювань. Наприклад, мічені флуоресценцією антитіла проти Streptococcus pyogenes (стрептокок групи А) можуть бути використані для отримання діагнозу стрептокок горла з мазка з горла. Діагноз готовий за лічені хвилини, і пацієнту можна починати прийом антибіотиків ще до виходу з клініки. Методи ДФА також можуть використовуватися для діагностики пневмонії, спричиненої Mycoplasma pneumoniae або Legionella pneumophila з зразків мокротиння (рис.\(\PageIndex{1}\)). Флуоресцентні антитіла зв'язуються з бактеріями на слайді мікроскопа, дозволяючи готове виявлення бактерій за допомогою флуоресцентного мікроскопа. Таким чином, методика DFA цінна для візуалізації певних бактерій, які важко ізолювати або культивувати із зразків пацієнтів.
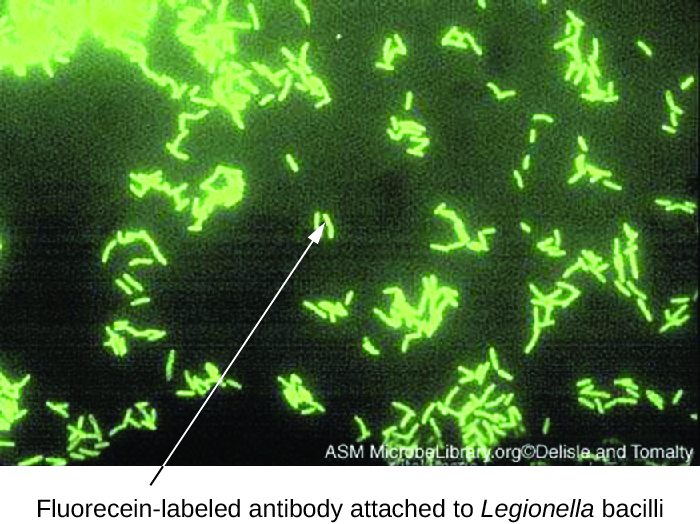
Вправа\(\PageIndex{1}\)
У прямому тесті на флуоресцентні антитіла, з чим зв'язується флуоресцентне антитіло?
Непрямі флуоресцентні антитіла
Непрямі флуоресцентні антитіла (IFA) тести (рис.\(\PageIndex{2}\)) використовуються для пошуку антитіл у сироватці пацієнта. Наприклад, тест IFA для діагностики сифілісу використовує клітини T. pallidum, ізольовані від лабораторної тварини (бактерії не можна вирощувати на лабораторних середовищах) та мазок, підготовлений на скляній гірці. Хвору сироватку розподіляють по мазку і допускають зв'язування антитрепонемних антитіл, якщо вони присутні. Змивають сироватку і додають вторинне антитіло. Вторинне антитіло - це протилюдський імуноглобулін, кон'югований з фтором. При огляді бактерії T. pallidum будуть видні лише в тому випадку, якщо вони були пов'язані антитілами з сироватки пацієнта.
Тест IFA на сифіліс є важливим доповненням до тесту VDRL, обговорюваного в Виявленні комплексів антиген-антитіла. VDRL частіше генерує хибно-позитивні реакції, ніж тест IFA; однак VDRL є кращим тестом для визначення того, чи активна інфекція в даний час.
Тести IFA також корисні для діагностики аутоімунних захворювань. Наприклад, системний червоний вовчак (СЧВ) (див. Аутоімунні розлади) характеризується підвищеним рівнем експресії антинуклеарних антитіл (АНА). Ці аутоантитіла можуть бути виражені проти різних ДНК-зв'язуючих білків і навіть проти самої ДНК. Оскільки аутоімунітет часто важко діагностувати, особливо на початку прогресування захворювання, тестування на АНА може бути цінною підказкою при постановці діагнозу та початку відповідного лікування.
IFA для ANA починається з фіксації клітин, вирощених в культурі, до скляної гірки і робить їх проникними для антитіл. Потім слайди інкубують з серійними розведеннями сироватки від пацієнта. Після інкубації гірку промивають для видалення незв'язаних білків, і додають флуоресцентне антитіло (антилюдське IgG, кон'юговане з фтором). Після інкубації та промивання клітини можуть бути досліджені на наявність флуоресценції, очевидної навколо ядра (рис.\(\PageIndex{3}\)). Титр АНА в сироватці крові визначається найвищим розведенням, що показує флуоресценцію. Оскільки багато здорових людей висловлюють ANA, Американський коледж ревматології рекомендує, щоб титр повинен бути не менше 1:40 за наявності симптомів, що стосуються двох або більше систем органів, щоб вважатися свідченням СЧВ. 1
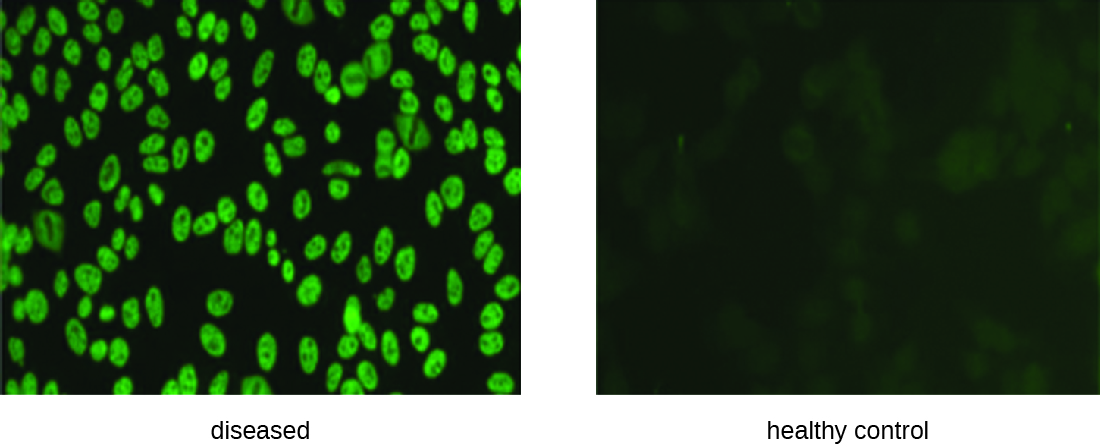
Вправа\(\PageIndex{2}\)
- У непрямому тесті флуоресцентних антитіл, з чим зв'язується флуоресцентне антитіло?
- Що шукає тест ANA?
Проточна цитометрія
Флуоресцентно мічені антитіла можуть бути використані для кількісної оцінки клітин певного типу в складній суміші за допомогою проточної цитометрії (рис.\(\PageIndex{4}\)), автоматизованої системи підрахунку клітин, яка виявляє флуоресцентні клітини, коли вони проходять через вузьку трубку по одній клітині за раз. Наприклад, при ВІЛ-інфекціях важливо знати рівень CD4 Т-клітин в крові пацієнта; якщо цифри опускаються нижче 500 на мкл крові, пацієнт стає більш схильним до придбання опортуністичних інфекцій; нижче 200 на мкл хворий вже не може змонтувати корисну адаптивну імунну відповідь взагалі. Аналіз починається з інкубації змішаних клітин (наприклад, лейкоцитів від донора) з флуоресцентно маркованим MaB, специфічним для субпопуляції клітин (наприклад, анти-CD4). Деякі експерименти розглядають два клітинні маркери одночасно, додаючи різний фтороген до відповідного MaB. Потім клітини вводяться в проточний цитометр через вузький капіляр, який змушує клітини проходити одним файлом. Для активації фторогену використовується лазер. Флуоресцентне світло випромінює у всіх напрямках, тому детектор флуоресценції може бути розташований під кутом від падаючого лазерного світла.
\(\PageIndex{4}\)На малюнку показана смуга затемнення перед детектором прямого розсіювання, яка запобігає потраплянню лазерного світла на детектор. Коли клітина проходить через лазерну смугу, детектор прямого розсіювання виявляє світло, розсіяне навколо смуги затемнення. Розсіяне світло перетворюється в імпульс напруги, а цитометр підраховує клітину. Флуоресценція з міченої клітини виявляється детекторами бічного розсіювання. Світло проходить через різні дихроїчні дзеркала таким чином, що світло, що випромінюється від флюорофора, приймається правильним детектором.
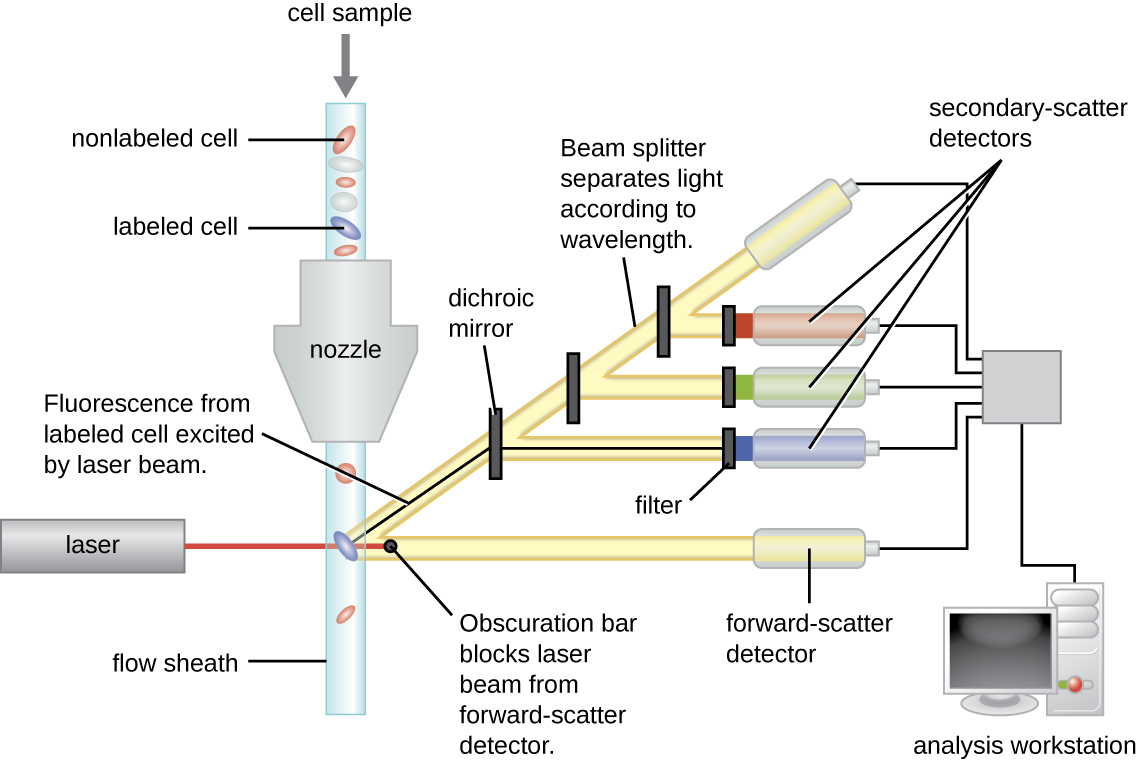
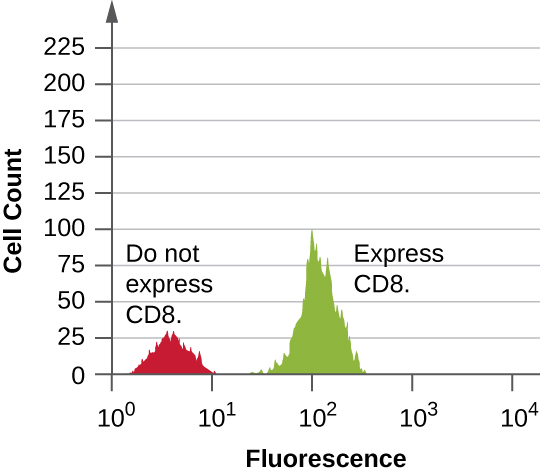
Дані збираються як з прямих, так і з бічних детекторів розсіювання. Одним із способів ці дані можуть бути представлені у вигляді гістограми. Передній розкид розміщується на осі y (щоб представити кількість комірок), а бічний розкид розміщений на осі x (для представлення флуоресценції кожної клітинки). Масштабування для осі x є логарифмічним, тому інтенсивність флуоресценції збільшується в 10 разів з кожним збільшенням одиниці вздовж осі. \(\PageIndex{5}\)На малюнку зображений приклад, в якому культура клітин поєднується з антитілом, прикріпленим до флюорофору для виявлення клітин CD8, а потім аналізується проточною цитометрією. Гістограма має два піки. Пік зліва має нижчі показання флуоресценції, представляючи підмножину клітинної популяції (приблизно 30 клітин), яка не флуоресценція; отже, вони не пов'язані антитілами і тому не виражають CD8. Пік праворуч має вищі показники флуоресценції, представляючи підмножину клітинної популяції (приблизно 100 клітин), які показують флуоресценцію; отже, вони пов'язані антитілом і, отже, експрес CD8.
Вправа\(\PageIndex{3}\)
- Яке призначення лазера в проточному цитометрі?
- На виході з проточного цитометра площа під гістограмою еквівалентна чому?
Клінічна спрямованість: Дозвіл
Після повідомлення всіх 1300 пацієнтів лікарня починає планувати скринінг на ВІЛ. Призначення було призначено мінімум через 3 тижні після останнього візиту пацієнта в лікарню, щоб мінімізувати ризик помилкових негативів. Оскільки передбачалися деякі помилкові спрацьовування, лікар охорони здоров'я створив протокол консультування для будь-якого пацієнта, чий непрямий ІФА повернувся позитивним.
З 1300 пацієнтів вісім дали позитивний результат з використанням ІФА. П'ять з цих тестів були визнані недійсними негативними тестами Western blot, але один західний блот повернувся позитивним, підтвердивши, що пацієнт дійсно заразився ВІЛ. Два залишилися західні плями повернулися невизначені. Цим особам довелося здати третій тест - ПЛР, щоб підтвердити наявність або відсутність послідовностей ВІЛ. На щастя, обидва пацієнти тестували негативно.
Що стосується самотнього пацієнта, який підтвердив наявність ВІЛ, тести не можуть довести або спростувати зв'язок із шприцами, скомпрометованими колишнім працівником лікарні. Незважаючи на це, страховка лікарні повністю покриє лікування пацієнта, яке розпочалося негайно.
Хоча зараз у нас є препарати, які, як правило, ефективні для контролю прогресування ВІЛ та СНІДу, все ще немає ліків. Якщо не лікувати, або якщо медикаментозний режим не вдається, у пацієнта буде спостерігатися поступове зниження кількості Т-клітин CD4-хелпера, що призводить до серйозного порушення всіх адаптаційних імунних функцій. Навіть помірне зниження кількості допоміжних Т-клітин може призвести до імунодефіциту, залишаючи пацієнта сприйнятливим до опортуністичних інфекцій. Для контролю стану Т-клітин помічників пацієнта лікарня буде використовувати проточну цитометрію. Цей чутливий тест дозволяє лікарям точно визначити кількість допоміжних Т-клітин, щоб вони могли коригувати лікування, якщо кількість падає нижче 500 клітин/мкл.
Сортування клітин за допомогою імунофлюоресценції
Проточний цитометр та імунофлюоресценція також можуть бути модифіковані для сортування клітин з одного зразка в очищені субпопуляції клітин для дослідницьких цілей. Ця модифікація проточного цитометра називається флуоресцентним активованим сортувальником клітин (FACS). У FACS флуоресценція клітиною спонукає пристрій поставити заряд на крапельку транспортуючої рідини, що містить цю клітину. Заряд специфічний для довжини хвилі флуоресцентного світла, що дозволяє диференціально сортувати ці різні заряди. Сортування здійснюється електростатичним дефлектором, який переміщує заряджену крапельку, що містить комірку, в ту чи іншу збірну ємність. Результатом цього процесу є високоочищені субпопуляції клітин.
Одне з обмежень FACS полягає в тому, що він працює лише на ізольовані клітини. Таким чином, метод працював би при сортуванні лейкоцитів, оскільки вони існують як ізольовані клітини. Але для клітин тканини проточна цитометрія може бути застосована лише в тому випадку, якщо ми зможемо висікати тканину і розділити її на окремі клітини (використовуючи протеази для розщеплення молекул клітинно-клітинної адгезії) без порушення цілісності клітин. Цей метод може застосовуватися при пухлині, але частіше для дослідження клітин в тканині використовують імуногістохімію і імуноцитохімію.
Перегляньте відео, щоб дізнатися більше про те, як працюють проточні цитометрії та FACS.
Вправа\(\PageIndex{4}\)
При флуоресцентному активованому сортуванні клітин, яка характеристика клітин-мішеней дозволяє їх відокремлювати?
Таблиця\(\PageIndex{1}\) порівнює механізми методів флуоресцентних антитіл, розглянутих у цьому розділі.
| Тип аналізу | Механізм | Приклади |
|---|---|---|
| Прямі флуоресцентні антитіла (DFA) | Використовує кон'югати флюороген-антитіла для маркування бактерій із зразків пацієнтів | Візуалізація легіонели пневмофіли з мазка з горла |
| Непрямі флуоресцентні антитіла (IFA) | Виявляє специфічні для захворювання антитіла у патентній сироватці | Діагностика сифілісу; виявлення антинуклеарних антитіл (АНА) для вовчака та інших аутоімунних захворювань |
| проточна цитометрія | Мітки клітинних мембран з флюороген-антитіла кон'югатними маркерами, збудженими лазером; машина підраховує клітину і записує відносну ф | Підрахунок кількості флуоресцентно маркованих клітин CD4 або CD8 у зразку |
| Флуоресцентний активований сортувальник клітин (FACS) | Форма проточної цитометрії, яка одночасно підраховує клітини і фізично розділяє їх на пули клітин з високою і низькою флуоресценцією | Сортування ракових клітин |
Ключові поняття та резюме
- Імунофлюоресцентні аналізи використовують антитіло-фторогенні кон'югати для освітлення антигенів для легкого та швидкого виявлення.
- Пряма імунофлюоресценція може бути використана для виявлення наявності бактерій в клінічних зразках, таких як мокрота.
- Непряма імунофлюоресценція виявляє наявність антиген-специфічних антитіл в сироватках пацієнта. Флуоресцентне антитіло зв'язується з антиген-специфічним антитілом, а не з антигеном.
- Застосування непрямих імунофлюоресцентних аналізів для виявлення антинуклеарних антитіл є важливим інструментом в діагностиці кількох аутоімунних захворювань.
- Проточна цитометрія використовує флуоресцентні MAB проти білків клітинної мембрани для кількісної оцінки конкретних підмножин клітин у складних сумішах.
- Флуоресцентно-активовані сортувальники клітин є продовженням потокової цитометрії, в якій інтенсивність флуоресценції використовується для фізичного поділу клітин у популяціях високої та низької флуоресценції.
Виноски
- 1 Гілл, Джеймс М., Анна Кізель, Пітер Рокка та Дене Т. Уолтерс. «Діагностика системного червоного вовчака». Американський сімейний лікар 68, № 11 (2003): 2179-2186.
