20.3: Аглютинаційні аналізи
- Page ID
- 3967
Цілі навчання
- Порівняйте пряму і непряму аглютинацію
- Визначте різні варіанти застосування гемаглютинації в діагностиці захворювання
- Поясніть, як визначаються групи крові
- Поясніть кроки, які використовуються для крос-відповідності крові, яка використовується при переливанні
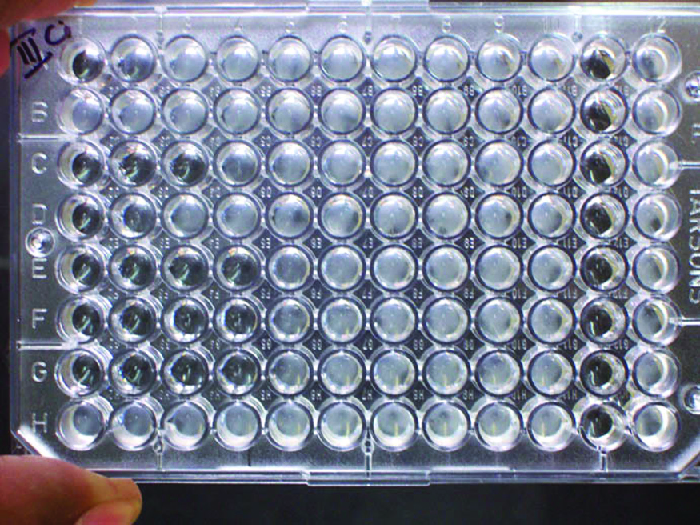
Окрім спричинення осадження розчинних молекул та флокуляції молекул у суспензії, антитіла також можуть згортати клітини або частинки (наприклад, латексні кульки, покриті антигеном) в процесі, який називається аглютинацією (рис. 18.1.8). Аглютинацію можна використовувати як показник наявності антитіл проти бактерій або еритроцитів. Аглютинаційні аналізи, як правило, швидко і легко виконуються на скляній гірці або мікротитрової пластині (рис.\(\PageIndex{1}\)). Мікротитрові пластини мають масив свердловин для утримання невеликих обсягів реагентів та спостереження за реакціями (наприклад, аглютинацією) або візуально, або за допомогою спеціально розробленого спектрофотометра. Свердловини бувають різних розмірів для аналізів за участю різних обсягів реагентів.
Аглютинація бактерій і вірусів
Використання тестів на аглютинацію для виявлення стрептококових бактерій було розроблено в 1920-х роках Ребеккою Лансфілд, працюючи зі своїми колегами А.Р. Дочесом і Освальдом Ейвері. 1 Вона використовувала антитіла для ідентифікації M білка, фактора вірулентності стрептококів, який необхідний для здатності бактерій викликати стрептококи. Виробництво антитіл проти білка М має вирішальне значення для встановлення захисної реакції проти бактерій.
Лансфілд використовував антисироватки, щоб показати, що різні штами одного виду стрептококів експресують різні версії білка М, що пояснює, чому діти можуть спускатися з стрептококом у горлі неодноразово. Лансфілд класифікував бета-гемолітичні стрептококи на багато груп на основі антигенних відмінностей у групоспецифічних полісахаридах, розташованих в клітинній стінці бактерій. Штами називають сероварами, оскільки вони диференціюються за допомогою антисироватки. Визначення сероварів, присутніх у спалаху захворювання, є важливим, оскільки деякі серовари можуть спричинити більш важке захворювання, ніж інші.
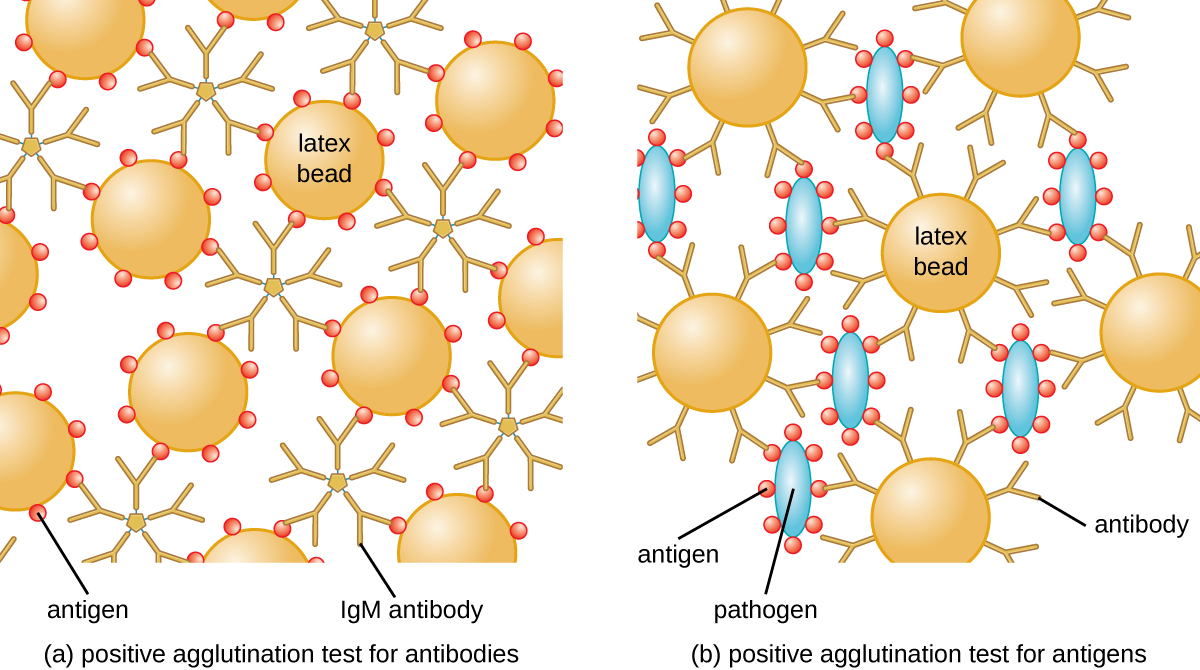
Метод, розроблений Lancefield, є прямим аглютинаційним аналізом, оскільки самі бактеріальні клітини агглютинації. Подібна стратегія частіше використовується сьогодні при ідентифікації сероварів бактерій і вірусів; однак для поліпшення візуалізації аглютинації антитіла можуть бути прикріплені до інертних латексних кульок. Ця методика називається непрямим аглютинаційним аналізом (або латексним фіксаційним аналізом), оскільки аглютинація кульок є маркером зв'язування антитіл з деяким іншим антигеном (рис.\(\PageIndex{2}\)). Непрямі аналізи можуть бути використані для виявлення наявності або антитіл, або специфічних антигенів.
Для виявлення антитіл в сироватці пацієнта цікавить антиген прикріплюють до латексних кульок. При змішуванні з сироваткою пацієнта антитіла зв'язують антиген, зшиваючи латексні кульки і змушуючи кульки аглютинуватися опосередковано; це свідчить про наявність антитіла (рис.\(\PageIndex{3}\)). Ця методика найчастіше використовується при пошуку антитіл IgM, оскільки їх структура забезпечує максимальне зшивання. Одним із широко використовуваних прикладів цього аналізу є тест на ревматоїдний фактор (РФ) для підтвердження діагнозу ревматоїдного артриту. РФ - це, по суті, наявність антитіл IgM, які зв'язуються з власним IgG пацієнта. РФ буде аглютинувати латексні намистини з покриттям IgG.
У зворотному тесті розчинні антигени можуть бути виявлені в сироватці пацієнта шляхом приєднання специфічних антитіл (зазвичай MAB) до латексних кульок і змішування цього комплексу з сироваткою (рис.\(\PageIndex{3}\)).
Тести на аглютинацію широко використовуються в слаборозвинених країнах, які можуть не мати відповідних засобів для культивування бактерій. Наприклад, тест Widal, який використовується для діагностики черевного тифу, шукає аглютинацію підвидів Salmonella enterica typhi у сироватках пацієнта. Тест Widal є швидким, недорогим і корисним для моніторингу ступеня спалаху; однак він не такий точний, як тести, які передбачають культивування бактерій. Тест Відала часто виробляє помилкові спрацьовування у пацієнтів з попередніми інфекціями іншими підвидами сальмонели, а також помилкові негативи у пацієнтів з гіперпротеїнемією або імунною недостатністю.
Крім того, тести на аглютинацію обмежені тим, що пацієнти, як правило, не виробляють виявлені рівні антитіл протягом першого тижня (або довше) інфекції. Кажуть, що пацієнт пройшов сероконверсію, коли рівень антитіл досягає порогу для виявлення. Зазвичай сероконверсія збігається з появою ознак і симптомів захворювання. Однак, наприклад, при ВІЛ-інфекції, як правило, потрібно 3 тижні, щоб відбулася сероконверсія, а в деяких випадках це може зайняти набагато більше часу.
Подібно до методів тесту на кільце пресіпітину та аналізів зубного нальоту, зазвичай готують серійні дворазові розведення сироватки пацієнта та визначення титру присутніх агглютинуючих антитіл. Оскільки рівень антитіл змінюється з часом як у первинних, так і у вторинних імунних реакціях, перевіряючи зразки з часом, можна виявити зміни титру антитіл. Наприклад, порівняння титру під час гострої фази інфекції з титром з фази реконвалесценції дозволить розрізнити, чи є інфекція поточною або відбулася в минулому. Також можна стежити за тим, наскільки добре імунна система пацієнта реагує на збудника.
Перегляньте це відео, яке демонструє реакції аглютинації латексними намистинами.
Вправа\(\PageIndex{1}\)
- Як використовується аглютинація, щоб відрізнити серовари один від одного?
- У аналізі латексних намистин для тестування на антитіла в сироватці пацієнта, чим покриті намистини?
- Що сталося, коли пацієнт переніс сероконверсію?
Гемаглютинація
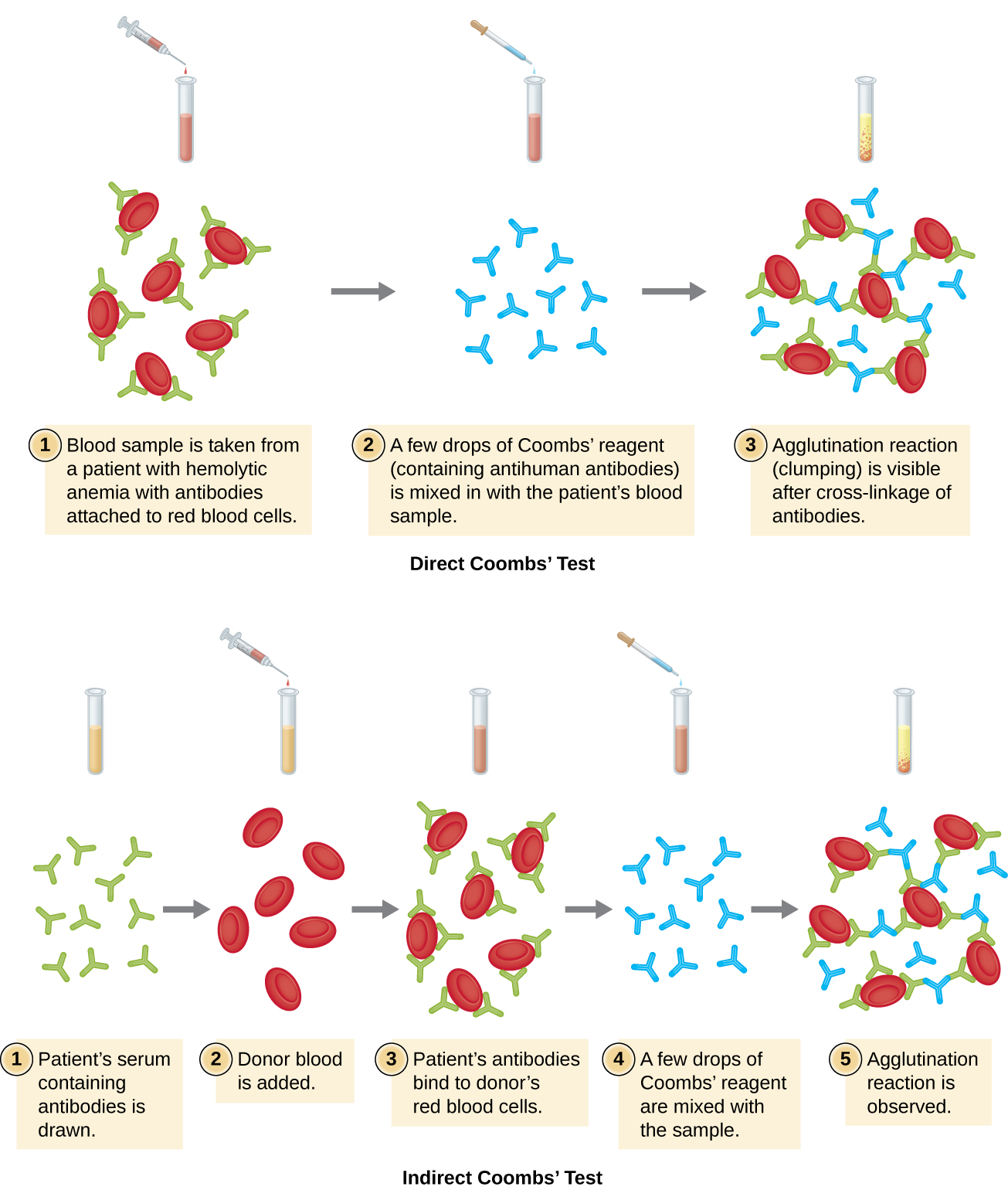
Аглютинація еритроцитів називається гемаглютинацією. Одним із поширених аналізів, який використовує гемаглютинацію, є прямий тест Кумбса, який також називають прямим антилюдським глобуліновим тестом (DAT), який, як правило, шукає неагглютинуючі антитіла. Тест також може виявити доповнення, прикріплене до еритроцитів.
Тест Кумбса часто застосовують, коли у новонародженого спостерігається жовтяниця, пожовтіння шкіри, викликане високими концентраціями в крові білірубіну, продукту розпаду гемоглобіну в крові. Тест Кумбса використовується для визначення того, чи були пов'язані еритроцити дитини антитілами матері. Ці антитіла б активувати комплемент, що призводить до лізису еритроцитів і подальшої жовтяниці. Інші стани, які можуть викликати позитивні прямі тести Кумбса, включають гемолітичні трансфузійні реакції, аутоімунну гемолітичну анемію, інфекційний мононуклеоз (викликаний вірусом Епштейна-Барра), сифіліс та мікоплазматичну пневмонію. Позитивний прямий тест Кумбса також може спостерігатися при деяких ракових захворюваннях та як алергічна реакція на деякі препарати (наприклад, пеніцилін).
Антитіла, пов'язані з еритроцитами в цих умовах, найчастіше є IgG, і через орієнтацію антигензв'язуючих ділянок на IgG і порівняно великого розміру еритроцити навряд чи відбудеться якась видима аглютинація. Однак наявність IgG, пов'язаного з еритроцитами, можна виявити, додавши реагент Кумбса, антисироватку, що містить антилюдські антитіла IgG (які можуть поєднуватися з антикомплементом) (рис.\(\PageIndex{4}\)). Реагент Кумбса пов'язує IgG, прикріплений до сусідніх еритроцитів, і, таким чином, сприяє аглютинації.
Існує також непрямий тест Кумбса, відомий як непрямий тест на антиглобулін (IAT). Це перевіряє індивіда на наявність антитіл проти антигенів еритроцитів (крім антигенів A і B), які не пов'язані в сироватці пацієнта (рис.\(\PageIndex{4}\)). ІАТ можна використовувати для скринінгу вагітних жінок на антитіла, які можуть викликати гемолітичну хворобу новонародженого. Він також може бути використаний перед здачею переливання крові. Більш докладно про те, як виконується ІАТ, розглянуто нижче.
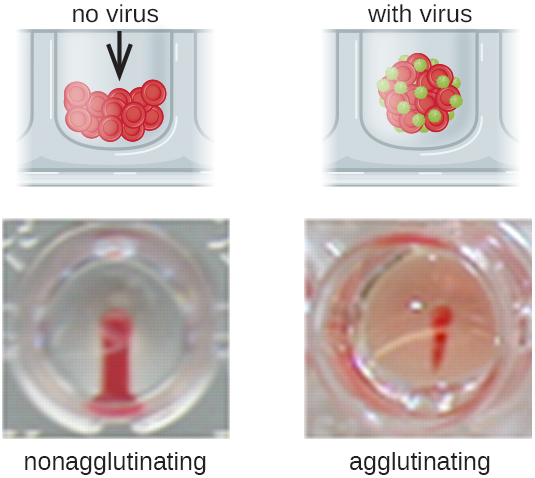
Антитіла, які зв'язуються з еритроцитами, є не єдиною причиною гемаглютинації. Деякі віруси також зв'язуються з еритроцитами, і це зв'язування може викликати аглютинацію, коли віруси зшивають еритроцити. Наприклад, віруси грипу мають два різних типи вірусних спайок, які називаються нейрамінідазою (N) і гемаглютиніном (H), останній названий за здатність до агглютинації еритроцитів (див. Віруси). Таким чином, ми можемо використовувати еритроцити для виявлення наявності вірусу грипу за допомогою прямих гемаглютинаційних аналізів (ГК), в яких вірус викликає видиму аглютинацію еритроцитів. Віруси свинки та краснухи також можуть бути виявлені за допомогою ГК.
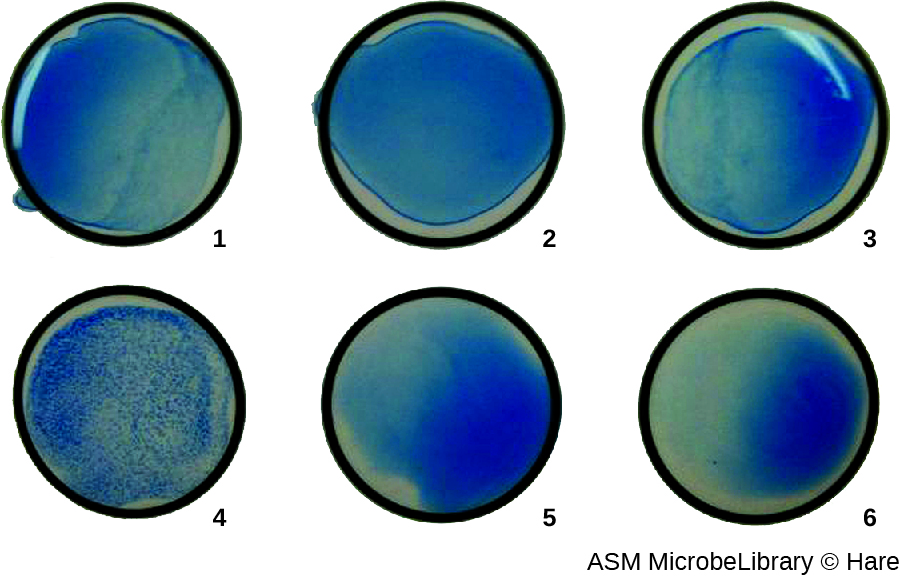
Найчастіше аналіз вірусної агглютинації з серійним розрідженням використовується для вимірювання титру або оцінки кількості вірусу, що виробляється в культурі клітин або для виробництва вакцин. Вірусний титр можна визначити за допомогою прямої ГК, зробивши серійне розведення зразка, що містить вірус, починаючи з високої концентрації зразка, який потім розлучається в серії лунок. Найвищим розведенням, що виробляє видиму аглютинацію, є титр. Аналіз проводять в мікротитрової пластині з V- або круглодонними лунками. При наявності аглютинуючих вірусів еритроцити і вірус скупчуються і утворюють дифузний мат над дном колодязя. При відсутності вірусу еритроцити скочуються або осаджуються на дно колодязя і утворюють щільну гранулу, через що плоскі свердловини використовувати не можна (рис.\(\PageIndex{5}\)).
Модифікація аналізу на ГК може бути використана для визначення титру противірусних антитіл. Наявність цих антитіл у сироватці пацієнта або в лабораторній антисироватці нейтралізує вірус і блокує його від агглютинації еритроцитів, роблячи це вірусним аналізом на інгібування гемаглютинації (HIA). У цьому аналізі сироватка пацієнта змішується зі стандартизованою кількістю вірусу. Після нетривалої інкубації додається стандартизована кількість еритроцитів і спостерігається гемаглютинація. Титр сироватки пацієнта є найвищим розведенням, яке блокує аглютинацію (рис.\(\PageIndex{6}\)).

Вправа\(\PageIndex{2}\)
- Який механізм, за яким віруси виявляються при гемаглютинаційному аналізі?
- Який результат гемаглютинації говорить нам про титр вірусу в зразку?
Тварини в лабораторії
Багато з того, що ми знаємо сьогодні про імунну систему людини, було вивчено за допомогою досліджень, проведених з використанням тварин - насамперед, ссавців - як моделей. Крім досліджень, ссавці також використовуються для виробництва більшості антитіл та інших компонентів імунної системи, необхідних для імунодіагностики. Вакцини, діагностика, терапія та трансляційна медицина загалом були розроблені шляхом досліджень з моделями тварин.
Розглянемо деякі загальні види використання лабораторних тварин для виробництва компонентів імунної системи. Морські свинки використовуються як джерело комплементу, а миші є основним джерелом клітин для виготовлення MAB. Ці MAB можуть бути використані в дослідженнях і в терапевтичних цілях. Антисери вирощують у різних видів, включаючи коней, овець, кіз та кроликів. При виробництві антисироватки тварині зазвичай вводять принаймні двічі, а ад'юванти можуть використовуватися для посилення реакції антитіл. Більші тварини, які використовуються для виготовлення антисироватки, будуть збирати кров неодноразово протягом тривалого періоду часу, з невеликою шкодою для тварин, але це зазвичай не стосується кроликів. Хоча ми можемо отримати кілька мілілітрів крові з вушних вен кроликів, нам зазвичай потрібні більші обсяги, що призводить до загибелі тварин.
Ми також використовуємо тварин для вивчення хвороб. Єдиний спосіб вирощування Treponema pallidum для дослідження сифілісу - у живих тварин. Багато вірусів можна вирощувати в культурі клітин, але зростання культури клітин говорить нам дуже мало про те, як імунна система буде реагувати на вірус. Працюючи над нововиявленою хворобою, ми все ще використовуємо постулати Коха, які вимагають викликати захворювання у лабораторних тварин, використовуючи патогени з чистої культури як вирішальний крок у доведенні того чи іншого мікроорганізму є причиною захворювання. Вивчення розповсюдження бактерій та вірусів у господарів тварин та того, як реагує імунна система господаря, займає центральне місце в мікробіологічних дослідженнях протягом більш ніж 100 років.
Хоча практика використання лабораторних тварин має важливе значення для наукових досліджень та медичної діагностики, багато людей категорично заперечують проти експлуатації тварин на благо людини. Цей етичний аргумент не є новим - справді, одна з дочок Чарльза Дарвіна була активним антивівісекціоністом (вівісекція - це практика різання або розтину живої тварини для її вивчення). Більшість вчених визнають, що повинні існувати обмеження щодо того, наскільки тварини можуть експлуатуватися в дослідницьких цілях. Етичні міркування змусили Національний інститут охорони здоров'я (NIH) розробити суворі правила щодо видів досліджень, які можуть бути виконані. Ці правила також включають керівні принципи гуманного поводження з лабораторними тваринами, встановлення стандартів їх житла, догляду та евтанізації. Документ NIH «Посібник з догляду та використання лабораторних тварин» дає зрозуміти, що використання тварин у дослідженнях є привілеєм, наданим суспільством дослідникам.
Керівні принципи NIH засновані на принципі трьох R: замінити, вдосконалити та зменшити. Дослідники повинні прагнути замінити моделі тварин неживими моделями, замінити хребетних безхребетних, коли це можливо, або використовувати комп'ютерні моделі, коли це можливо. Вони повинні вдосконалювати землеробство та експериментальні процедури, щоб зменшити біль і страждання, а також використовувати експериментальні конструкції та процедури, які зменшують кількість тварин, необхідних для отримання бажаної інформації. Щоб отримати фінансування, дослідники повинні задовольнити рецензентів NIH, що дослідження виправдовує використання тварин і що їх використання відповідає вказівним принципам.
На місцевому рівні будь-який заклад, який використовує тварин і отримує федеральне фінансування, повинен мати інституційний комітет з догляду та використання тварин (IACUC), який забезпечує дотримання вказівок NIH. IACUC повинен включати дослідників, адміністраторів, ветеринара та принаймні одну особу, яка не має зв'язків з установою, тобто зацікавлений громадянин. Цей комітет також здійснює перевірки лабораторій і протоколів. Для досліджень за участю людських суб'єктів Рада інституційного огляду (IRB) гарантує дотримання належних вказівок.
Відвідайте цей сайт, щоб переглянути Керівництво NIH по догляду та використання лабораторних тварин.
Типування крові та перехресне узгодження
Окрім антитіл проти бактерій та вірусів, яким вони раніше піддавалися, більшість людей також переносять антитіла проти груп крові, відмінних від власних. В даний час існує 33 імунологічно важливі системи типу крові, багато з яких обмежені в різних етнічних групах або рідко призводять до вироблення антитіл. Найбільш важливими і, мабуть, найбільш відомими є АВО і резус-групи крові (див. Рис.
Коли розглядаються одиниці крові для переливання, необхідно провести переливання крові. Для блоку крові комерційно підготовлені антитіла проти антигенів A, B та Rh змішуються з еритроцитами з одиниць, щоб спочатку підтвердити, що група крові на одиниці точна. Після того, як одиниця крові була запрошена для переливання, життєво важливо переконатися, що донор (одиниця крові) та реципієнт (пацієнт) сумісні з цими важливими антигенами. Крім підтвердження групи крові відділення, група крові пацієнта також підтверджується за допомогою тих же комерційно підготовлених антитіл до А, В і резус. Наприклад, як показано на малюнку\(\PageIndex{7}\), якщо донорська кров А-позитивна, вона буде агглютинуватися з антисироваткою проти А та анти-RH антисироваткою. Якщо не спостерігається аглютинації ні з якою з сироваток, то група крові була б О-негативною.
Після визначення групи крові, безпосередньо перед випуском крові для переливання, проводиться перехресна відповідність, при якій невелика аліквота донорських еритроцитів змішується з сироваткою від пацієнта, що очікує переливання. Якщо у пацієнта є антитіла проти донорських еритроцитів, відбудеться гемаглютинація. Щоб підтвердити будь-які негативні результати тесту та перевірити наявність сенсибілізованих еритроцитів, реагент Кумбса може бути доданий до суміші для полегшення візуалізації взаємодії антитіло-еритроцитів.
За деяких обставин може виконуватися і незначний крос-матч. У цьому аналізі невелика аліквота донорської сироватки змішується з еритроцитами пацієнта. Це дозволяє виявити аглютинізуючі антитіла в сироватці донора. Цей тест рідко необхідний, оскільки при переливанні зазвичай використовуються упаковані еритроцити з більшою частиною плазми, видаленої центрифугуванням.
Еритроцити мають багато інших антигенів крім АВО і резус. Хоча більшість людей навряд чи матимуть антитіла проти цих антигенів, жінки, які перенесли багатоплідну вагітність або пацієнти, які перенесли багаторазові переливання, можуть мати їх через повторне опромінення. З цієї причини для визначення наявності таких антитіл використовується скринінг тест на антитіла. Сироватку пацієнта перевіряють на комерційно підготовлені, об'єднані еритроцити типу O, які експресують ці антигени. Якщо відбувається аглютинація, антиген, на який реагує пацієнт, повинен бути ідентифікований і визначений, що не присутній в донорському відділенні.

Вправа\(\PageIndex{3}\)
- Якщо кров пацієнта аглютинується сироваткою проти В, яка група крові пацієнта?
- Що таке крос-матчевий аналіз, і навіщо він проводиться?
Таблиця\(\PageIndex{1}\) узагальнює різні види аналізів аглютинації, розглянуті в цьому розділі.
| Тип аналізу | Механізм | Приклад |
|---|---|---|
| Аглютинація | Прямий: Антитіло використовується для скупчення бактеріальних клітин або інших великих структур | Серотипування бактерій |
| Непрямий: латексні кульки поєднуються з антигеном або антитілами, щоб шукати антитіла або антиген відповідно в сироватці пацієнта | Підтвердження наявності в сироватці пацієнта ревматоїдного фактора (IgM-зв'язуючого Ig) | |
| Гемаглютинація | Прямий: Деякі бактерії та віруси зшивають еритроцити та комкують їх разом | Діагностика грипу, свинки та кору |
| Прямий тест Кумбса (DAT): виявляє неагглютинуючі антитіла або білки комплементу на еритроцитах in vivo | Перевірка материнських антитіл зв'язування з еритроцитами новонароджених | |
| Непрямий тест Кумбса (ІАТ): екранує індивіда на антитіла проти антигенів еритроцитів (крім антигенів A та B), які не пов'язані в сироватці пацієнта in vitro | Виконання претрансфузійного аналізу крові | |
| Інгібування вірусної гемаглютинації: використовує антитіла пацієнта для інгібування вірусної аглютинації | Діагностика різних вірусних захворювань за наявністю у пацієнта антитіл проти вірусу | |
| Типування крові та перехресне узгодження: виявляє АВО, резус та незначні антигени в крові | Відповідність донорської крові до імунних потреб реципієн |
Ключові поняття та резюме
- Антитіла можуть аглютинувати клітини або великі частинки у видимий матрикс. Тести на аглютинацію часто проводяться на картках або в мікротитрових пластин, які дозволяють багаторазовим реакціям протікати пліч-о-пліч з використанням невеликих обсягів реагентів.
- Використання антисироватки проти певних білків дозволяє ідентифікувати серовари всередині видів бактерій.
- Виявлення антитіл проти збудника може бути потужним інструментом діагностики захворювання, але існує певний проміжок часу, перш ніж пацієнти пройдуть сероконверсію і рівень антитіл стає виявленим.
- Аглютинація латексних кульок в аналізах непрямої аглютинації може бути використана для виявлення наявності специфічних антигенів або специфічних антитіл в сироватці пацієнта.
- Наявність деяких антибактеріальних та противірусних антитіл можна підтвердити використанням прямого тесту Кумбса, який використовує реагент Кумбса для перехресного зв'язку антитіл, пов'язаних з еритроцитами, та полегшення гемаглютинації.
- Деякі віруси і бактерії зв'язуватимуть і аглютинують еритроцити; ця взаємодія є основою прямого гемаглютинаційного аналізу, найчастіше використовується для визначення титру вірусу в розчині.
- Нейтралізаційні аналізи кількісно визначають рівень вірусоспецифічних антитіл шляхом вимірювання зниження гемаглютинації, що спостерігається після змішування сироватки пацієнта зі стандартизованою кількістю вірусу.
- Гемаглютинаційні аналізи також використовуються для скринінгу та крос-відповідності донорської та реципієнтної крові, щоб переконатися, що реципієнт переливання не має антитіл до антигенів у донорській крові.
Виноски
- 1 Лансфілд, Ребекка С., «Антигенний комплекс Streptococcus haemoliticus. Демонстрація специфічної речовини типу в екстрактах Streptococcus haemolyticus», Журнал експериментальної медицини 47, № 1 (1928): 91-103.
