2.3: Інструменти мікроскопії
- Page ID
- 3979
Цілі навчання
- Визначте та опишіть частини світлового мікроскопа
- Розрахуйте загальне збільшення для складного мікроскопа
- Опишіть відмінні риси та типові види використання для різних типів світлових мікроскопів, електронних мікроскопів та скануючих зондових мікроскопів
Ранні піонери мікроскопії відкрили вікно в невидимий світ мікроорганізмів. Але мікроскопія продовжувала просуватися в наступні століття. У 1830 році Джозеф Джексон Лістер створив по суті сучасний світловий мікроскоп. У 20 столітті відбувся розвиток мікроскопів, які використовували невидиме світло, такі як флуоресцентна мікроскопія, яка використовує ультрафіолетове джерело світла, та електронна мікроскопія, яка використовує короткохвильові електронні пучки. Ці досягнення призвели до значних покращень у збільшенні, роздільній здатності та контрасті. Для порівняння, відносно рудиментарні мікроскопи ван Леувенгука і його сучасників були набагато менш потужними, ніж навіть самі основні мікроскопи, що використовуються сьогодні. У цьому розділі ми розглянемо широкий спектр сучасних мікроскопічних технологій та загальних застосувань для кожного типу мікроскопа.
світлова мікроскопія
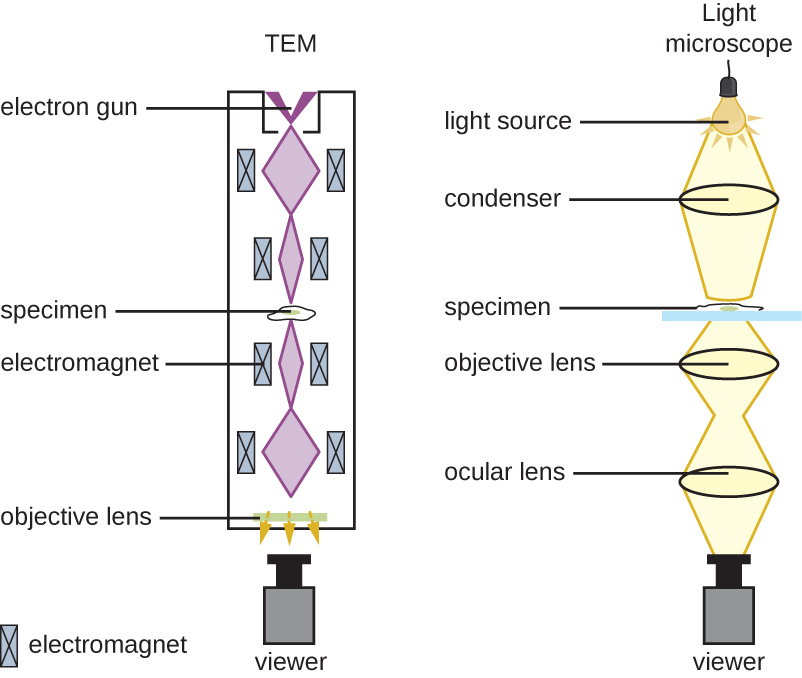
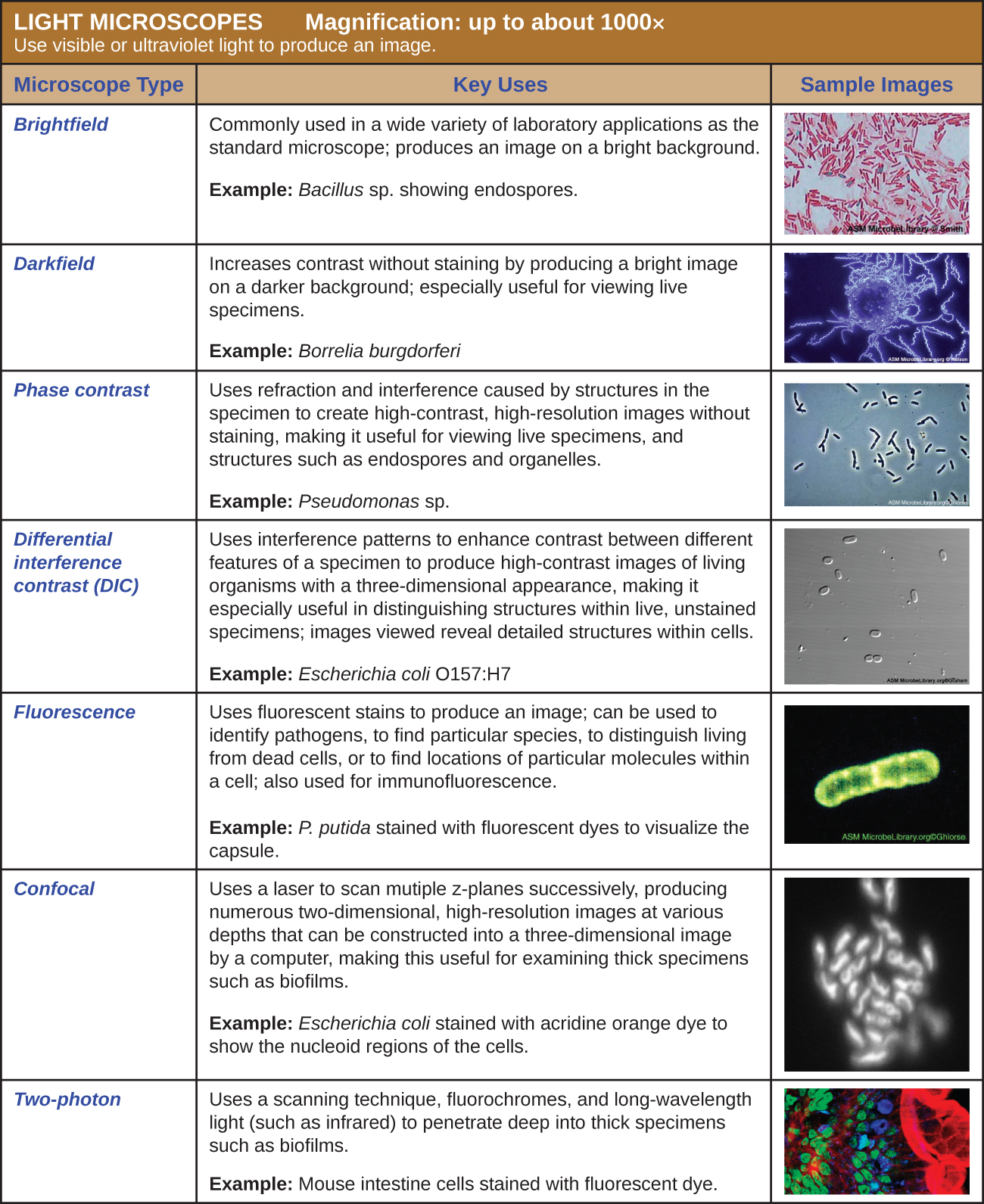
Багато типів мікроскопів підпадають під категорію світлових мікроскопів, які використовують світло для візуалізації зображень. Приклади світлових мікроскопів включають мікроскопи яскравого поля, мікроскопи темного поля, мікроскопи з фазовим контрастом, диференціальні інтерференційні контрастні мікроскопи, флуоресцентні мікроскопи, конфокальні скануючі лазерні мікроскопи та двофотонні мікроскопи. Ці різні типи світлових мікроскопів можуть бути використані для доповнення один одного в діагностиці та дослідженнях.
Мікроскопи Брайтфілд
Мікроскоп brightfield, мабуть, найбільш часто використовуваний тип мікроскопа, являє собою складний мікроскоп з двома або більше лінзами, які виробляють темне зображення на яскравому тлі. Деякі мікроскопи яскравого поля є монокулярними (мають один окуляр), хоча більшість новіших мікроскопів brightfield є бінокулярними (мають два окуляри), як показано на малюнку\(\PageIndex{1}\); в будь-якому випадку кожен окуляр містить лінзу, яка називається очна лінза. Очні лінзи зазвичай збільшують зображення 10 разів (10). На іншому кінці тулуба знаходяться набір об'єктивних лінз на обертовому носі. Збільшення цих об'єктивів зазвичай коливається від 4до 100, зі збільшенням для кожного об'єктива, призначеного на металевому корпусі лінзи. Очні та лінзи об'єктива працюють разом, щоб створити збільшене зображення. Загальне збільшення - це продукт збільшення очей, що разів перевищує об'єктивне збільшення:
\[\text{ocular magnification} \times \text{objective magnification} \nonumber\]
Наприклад, якщо обрана лінза\(40 \times\) об'єктиву і очна лінза\(10\times\), загальне збільшення буде
\[(40×)(10×)=400× \nonumber\]
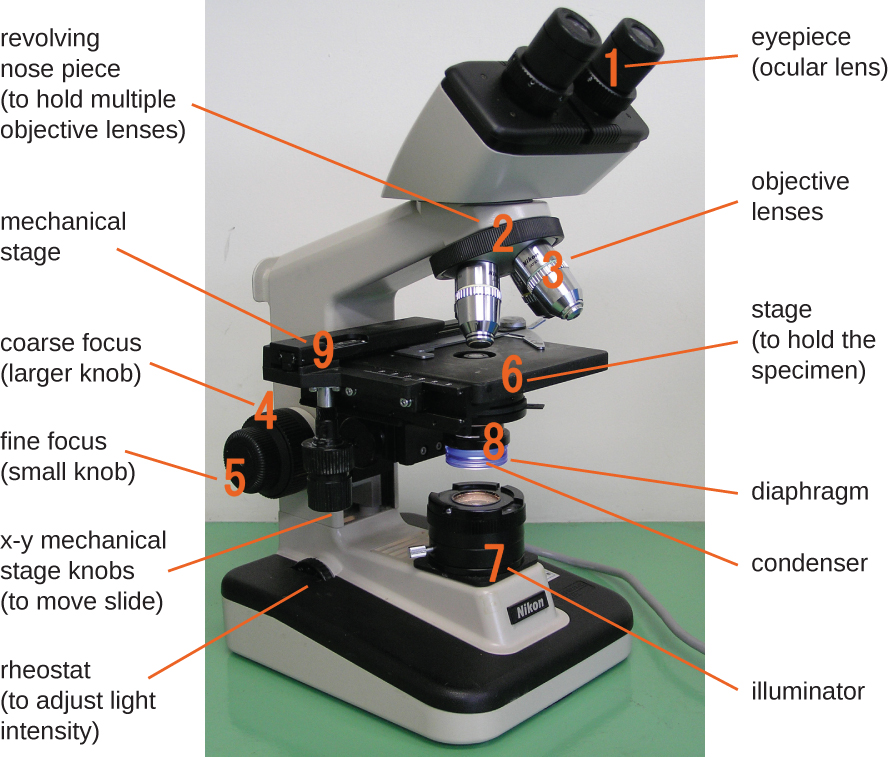
Компоненти типового світлового мікроскопа.
Розглядається предмет називається зразком. Зразок поміщається на скляну гірку, яка потім обрізається на місце на сцені (платформі) мікроскопа. Після того, як слайд закріплений, зразок на слайді розміщується над світлом за допомогою механічних ручок ступеня xy. Ці ручки переміщують гірку по поверхні сцени, але не піднімають і не опускають сцену. Після того, як зразок зосереджений над світлом, положення сцени можна підняти або опустити, щоб сфокусувати зображення. Ручка грубого фокусування використовується для великомасштабних рухів з об'єктивами 4та 10; тонка ручка фокусування використовується для дрібномасштабних рухів, особливо з об'єктивами 40або 100.
Коли зображення збільшуються, вони стають тьмянішими, оскільки на одиницю площі зображення менше світла. Значно збільшені зображення, отримані мікроскопами, тому вимагають інтенсивного освітлення. У мікроскопі яскравого поля це світло забезпечується освітлювачем, який, як правило, є лампочкою високої інтенсивності нижче сцени. Світло від освітлювача проходить вгору через конденсаторну лінзу (розташовану нижче сцени), яка фокусує всі світлові промені на зразку для максимального освітлення. Положення конденсатора можна оптимізувати за допомогою приєднаної ручки фокусування конденсатора; після встановлення оптимальної відстані конденсатор не слід переміщати для регулювання яскравості. Якщо потрібні менш ніж максимальні рівні освітленості, кількість світла, що вражає зразок, можна легко регулювати, відкривши або закривши діафрагму між конденсатором та зразком. У деяких випадках яскравість також можна регулювати за допомогою реостата - перемикача диммера, який контролює інтенсивність освітлювача.
Яскраво-польовий мікроскоп створює зображення, направляючи світло від освітлювача на зразок; це світло диференційно передається, поглинається, відбивається або заломлюється різними структурами. Різні кольори можуть поводитися по-різному, коли вони взаємодіють зхромофорами (пігментами, які поглинають і відбивають певні довжини хвиль світла) в частинок зразка. Часто хромофори штучно додають до зразка за допомогою плям, які служать для підвищення контрастності та роздільної здатності. В цілому структури в екземплярі будуть здаватися темнішими, в різній мірі, ніж яскравий фон, створюючи максимально різкі зображення при збільшеннях приблизно до 1000. Подальше збільшення створило б зображення більшого розміру, але без збільшеної роздільної здатності. Це дозволяє нам бачити об'єкти, такі маленькі, як бактерії, які видно приблизно при 400 або близько того, але не менші об'єкти, такі як віруси.
При дуже великих збільшеннях роздільна здатність може бути порушена, коли світло проходить через невелику кількість повітря між зразком і лінзою. Це пов'язано з великою різницею між показниками заломлення повітря і скла; повітря розсіює світлові промені, перш ніж вони зможуть бути сфокусовані лінзою. Для вирішення цієї проблеми можна використовувати краплю масла для заповнення простору між зразком і масляною занурювальною лінзою, спеціальною лінзою, призначеною для використання з іммерсійними маслами. Оскільки масло має показник заломлення, дуже схожий на показник скла, воно збільшує максимальний кут, під яким світло, що виходить із зразка, може вдарити об лінзу. Це збільшує зібране світло і, таким чином, роздільну здатність зображення (рис.\(\PageIndex{2}\)). Різноманітні масла можна використовувати для різних типів світла.
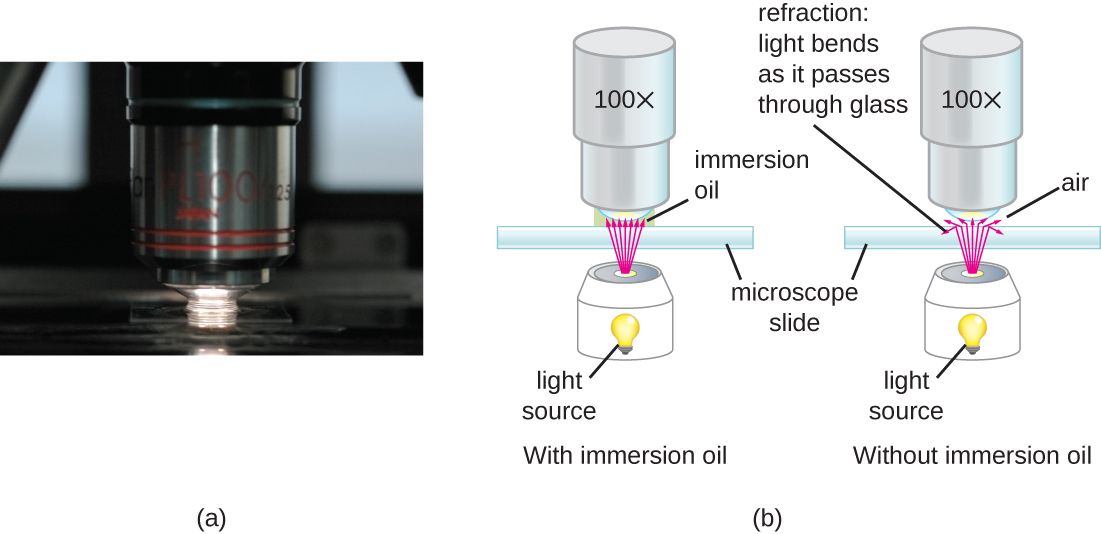
Навіть дуже потужний мікроскоп не може доставити зображення з високою роздільною здатністю, якщо він не очищений і не підтримується належним чином. Оскільки лінзи ретельно розроблені та виготовлені для заломлення світла з високим ступенем точності, навіть злегка брудна або подряпана лінза буде ненавмисно заломлювати світло, погіршуючи зображення зразка. Крім того, мікроскопи є досить делікатними інструментами, і необхідно дотримуватися великої обережності, щоб уникнути пошкодження деталей і поверхонь. Крім усього іншого, правильний догляд за мікроскопом включає в себе наступне:
- очищення лінз папером для лінз
- не дозволяючи лінзам контактувати з слайдом (наприклад, шляхом швидкої зміни фокусу)
- захист колби (якщо вона є) від поломки
- не штовхаючи мета в слайд
- не використовуючи ручку грубого фокусування при використанні об'єктивів 40або більше
- лише використовуючи іммерсійне масло зі спеціалізованою олійною метою, як правило, об'єктом 100
- очищення масла від іммерсійних лінз після використання мікроскопа
- очищення будь-якого масла, випадково перенесеного з інших лінз
- покриття мікроскопа або розміщення його в шафі, коли він не використовується
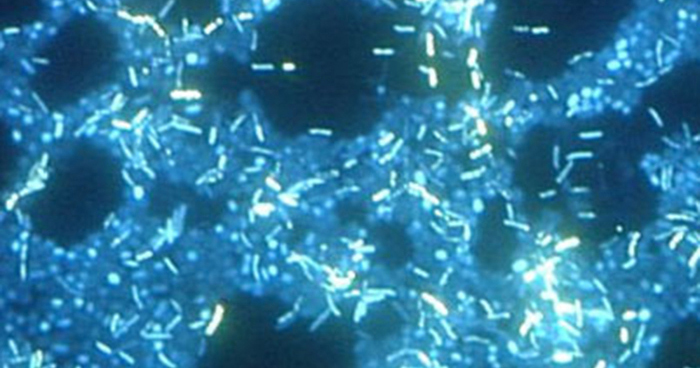
Мікроскопія темного поля
Мікроскоп темного поля - це яскравопольовий мікроскоп, який має невелику, але значну модифікацію конденсатора. Між освітлювачем і лінзою конденсатора поміщається невеликий непрозорий диск (близько 1 см в діаметрі). Цей непрозорий світловий стоп, як називається диск, блокує більшу частину світла від освітлювача, коли він проходить через конденсатор на шляху до об'єктива, виробляючи порожнистий конус світла, який зосереджений на зразку. Єдине світло, яке досягає мети, - це світло, яке було заломлено або відбито структурами в зразку. Отримане зображення зазвичай показує яскраві об'єкти на темному тлі (рис.\(\PageIndex{3}\))
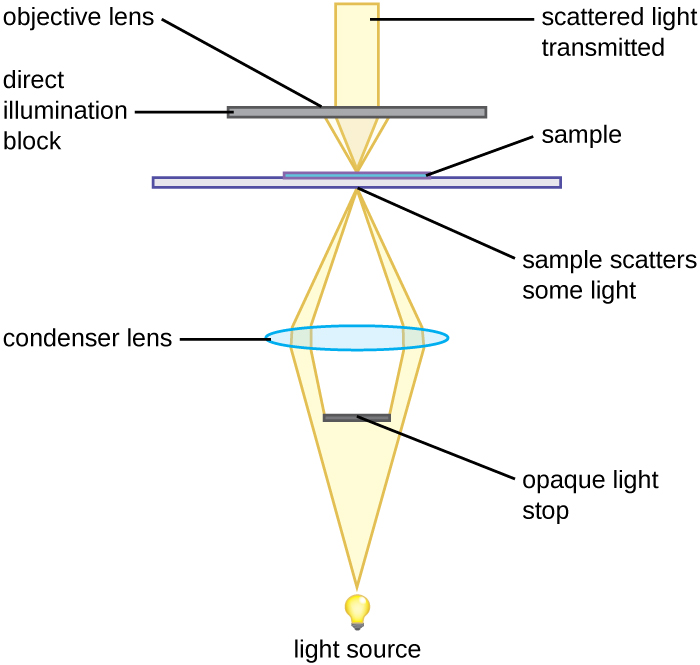
Непрозорий світловий стоп, вставлений в мікроскоп brightfield, використовується для отримання зображення темного поля. Зупинка світла блокує світло, що рухається безпосередньо від освітлювача до об'єктива, дозволяючи лише відбитому або заломленому світлу від зразка потрапляти до ока.
Мікроскопія темного поля часто може створювати висококонтрастні зображення зразків з високою роздільною здатністю без використання плям, що особливо корисно для перегляду живих зразків, які можуть бути вбиті або іншим чином скомпрометовані плямами. Наприклад, тонкі спірохети на кшталт Treponema pallidum, збудника сифілісу, найкраще можна розглянути за допомогою мікроскопа темного поля (рис.\(\PageIndex{4}\)).
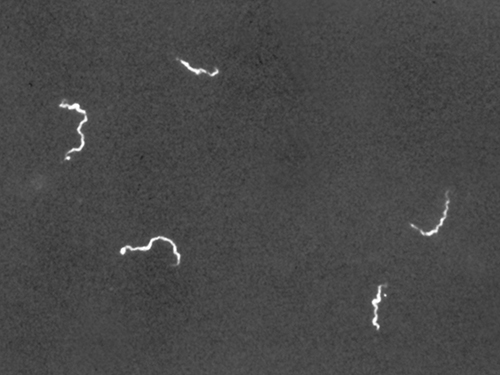
Використання мікроскопа темного поля дозволяє переглядати живі, незаплямовані зразки спірохети Treponema pallidum. Схожі на фотографічний негатив, спірохети виглядають яскраво на темному тлі. (кредит: Центри контролю та профілактики захворювань/Хаббард Хаббард)
Вправа\(\PageIndex{1}\)
Визначте ключові відмінності між яскравим полем та мікроскопією темного поля.
Клінічна спрямованість: Частина 2
Ранові інфекції, такі як Сінді, можуть бути викликані багатьма різними типами бактерій, деякі з яких можуть швидко поширюватися з серйозними ускладненнями. Виявлення конкретної причини дуже важливо для вибору ліків, які можуть вбити або зупинити ріст бактерій.
Після виклику місцевого лікаря з приводу справи Сінді табірна медсестра відправляє зразок з рани в найближчу медичну лабораторію. На жаль, оскільки табір знаходиться у віддаленому районі, найближча лабораторія невелика і погано обладнана. Більш сучасна лабораторія, швидше за все, використовуватиме інші методи для культури, вирощування та ідентифікації бактерій, але в цьому випадку технік вирішує зробити мокре кріплення зі зразка та переглянути його під мікроскопом яскравого поля. У мокрому кріпленні до гірки додається невелика крапля води, а поверх зразка розміщується ковзання кришки, щоб утримувати його на місці перед тим, як він буде розміщений під об'єктивом.
Під мікроскопом brightfield технік ледве бачить клітини бактерій, оскільки вони майже прозорі на яскравому тлі. Щоб збільшити контрастність, технік вставляє непрозору світлову зупинку над освітлювачем. Отримане зображення темного поля чітко показує, що клітини бактерій кулясті і згруповані в грона, як виноград.
- Чому важливо визначити форму і закономірності росту клітин в зразку?
- Які ще види мікроскопії можна ефективно використовувати для перегляду цього зразка?
Мікроскопи з фазовим контрастом
Мікроскопи з фазовим контрастом використовують заломлення та перешкоди, спричинені структурами в зразку, для створення висококонтрастних зображень з високою роздільною здатністю без фарбування. Це найстаріший і найпростіший тип мікроскопа, який створює зображення, змінюючи довжини хвиль світлових променів, що проходять через зразок. Для створення змінених шляхів довжини хвилі в конденсаторі використовується кільцевий упор. Кільцева зупинка виробляє порожнистий конус світла, який фокусується на зразку до досягнення об'єктива. Об'єктив містить фазову пластину, що містить фазове кільце. В результаті світло, що рухається безпосередньо від освітлювача, проходить через фазне кільце, в той час як світло, заломлене або відбите зразком, проходить через пластину. Це призводить до того, що хвилі, що проходять через кільце, становитимуть близько половини довжини хвилі поза фазою з тими, що проходять через пластину. Оскільки хвилі мають піки та западини, вони можуть складатися разом (якщо у фазі разом) або скасовувати один одного (якщо поза фазою). Коли довжини хвиль поза фазою, хвильові жолоби скасують піки хвиль, що називається руйнівними перешкодами. Структури, які заломлюють світло, тоді здаються темними на яскравому тлі тільки незаломленого світла. Більш загально структури, що відрізняються такими особливостями, як показник заломлення, будуть відрізнятися рівнями темряви (рис.\(\PageIndex{5}\)).
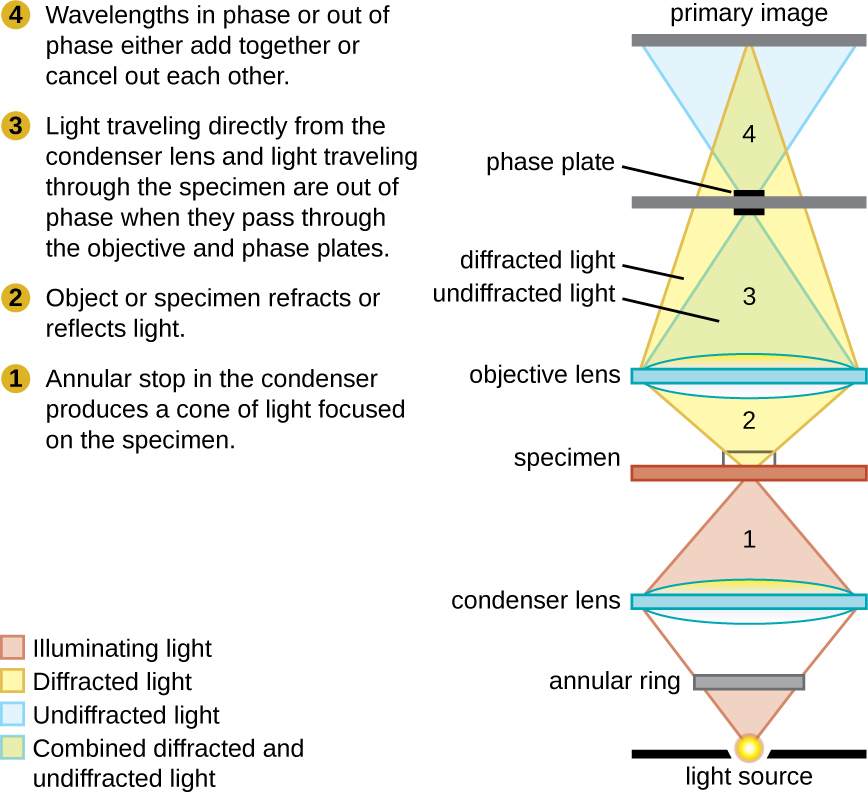
Ця діаграма мікроскопа з фазовим контрастом ілюструє фазові відмінності між світлом, що проходить через об'єкт, і фоном. Ці відмінності утворюються шляхом пропускання променів через різні частини фазової пластини. Світлові промені накладаються на площину зображення, створюючи контраст за рахунок їх перешкод.
Оскільки він збільшує контраст, не вимагаючи плям, для спостереження за живими зразками часто використовується мікроскопія з фазовим контрастом. Певні структури, такі як органели в еукаріотичних клітині та ендоспори в прокаріотичних клітині, особливо добре візуалізуються за допомогою мікроскопії з фазовим контрастом (рис.\(\PageIndex{6}\)).
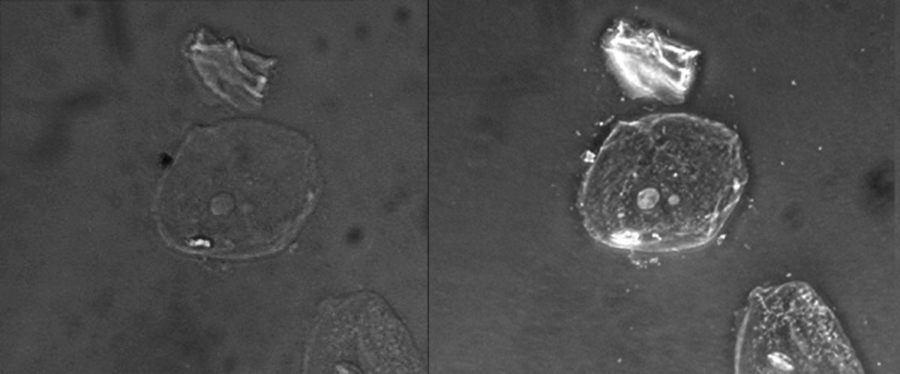
Ця цифра порівнює зображення яскравого поля (зліва) з фазоконтрастним зображенням (праворуч) тих же незаплямованих простих плоскоклітинних епітеліальних клітин. Клітини знаходяться в центрі та правому нижньому куті кожної фотографії (нерегулярний елемент над клітинами - це клітинні уламки). Зверніть увагу, що незабарвлені осередки в світлому полі зображення майже непомітні на тлі, тоді як осередки в фазоконтрастному зображенні здаються світитися на тлі, виявляючи набагато більше деталей. (кредит: «Ясно кефір» /Wikimedia Commons)
Диференціальні перешкоди контрастні мікроскопи
Мікроскопи з диференціальним інтерференційним контрастом (DIC) (також відомі як оптика Номарського) схожі на мікроскопи з фазовим контрастом тим, що вони використовують інтерференційні моделі для посилення контрасту між різними особливостями зразка. У ДВС-мікроскопі створюються два пучка світла, в яких різниться напрямок руху хвилі (поляризація). Після того, як промені проходять через простір зразка або зразка, вони рекомбінуються, і ефекти зразків спричиняють відмінності в інтерференційних схемах, що генеруються об'єднанням пучків. Це призводить до отримання висококонтрастних зображень живих організмів з тривимірним виглядом. Ці мікроскопи особливо корисні для розрізнення структур всередині живих, незаплямованих зразків. (Малюнок\(\PageIndex{7}\)).

ДВС-зображення Fonsecaea pedrosoi, вирощеного на модифікованому леонівському агарі. Цей гриб викликає хромобластомікоз - хронічну шкірну інфекцію, поширену в тропічному та субтропічному кліматі.
Вправа\(\PageIndex{2}\)
Які переваги фазового контрасту та ДВС-мікроскопії?
Флуоресцентні мікроскопи
Флуоресцентний мікроскоп використовує флуоресцентні хромофори, звані флюорохромами, які здатні поглинати енергію від джерела світла, а потім випромінювати цю енергію як видиме світло. Флюорохроми включають природно флуоресцентні речовини (такі як хлорофіли), а також флуоресцентні плями, які додаються до зразка для створення контрасту. Барвники, такі як Техаський червоний і FITC, є прикладами фторохромів. Інші приклади включають барвники нуклеїнової кислоти 4',6'-діамідіно-2-феніліндол (DAPI) та акридин помаранчевий.
Мікроскоп передає світло збудження, як правило, форму ЕМР з короткою довжиною хвилі, наприклад, ультрафіолетове або синє світло, до зразка; хромофори поглинають світло збудження і випромінюють видиме світло з більшими довжинами хвиль. Потім світло збудження фільтрується (частково тому, що ультрафіолетове світло шкідливо для очей), так що через очну лінзу проходить лише видиме світло. При цьому виходить зображення екземпляра в світлих тонах на темному тлі.
Флуоресцентні мікроскопи особливо корисні в клінічній мікробіології. Вони можуть бути використані для ідентифікації патогенів, пошуку певних видів у середовищі або для пошуку місць розташування певних молекул і структур всередині клітини. Також були розроблені підходи для відрізнення живих від мертвих клітин за допомогою флуоресцентної мікроскопії на основі того, чи беруть вони конкретні флюорохроми. Іноді кілька фторохромів використовуються на одному зразку, щоб показати різні структури або особливості.
Одним з найважливіших застосувань флуоресцентної мікроскопії є методика під назвою імунофлюоресценція, яка використовується для ідентифікації певних хвороботворних мікробів, спостерігаючи, чи зв'язуються з ними антитіла. (Антитіла - це білкові молекули, що виробляються імунною системою, які приєднуються до конкретних патогенів, щоб вбити або пригнічувати їх. Існує два підходи до цієї методики: прямий імунофлюоресцентний аналіз (DFA) та непрямий імунофлюоресцентний аналіз (IFA). У ДФА специфічні антитіла (наприклад, ті, які є мішенню вірусу сказу) забарвлюються флюорохромом. Якщо зразок містить цільовий збудник, можна спостерігати антитіла, що зв'язуються зі збудником під флуоресцентним мікроскопом. Це називається первинним плямою антитіл, оскільки забарвлені антитіла прикріплюються безпосередньо до збудника.
При ІФА вторинні антитіла забарвлюються флюорохромом, а не первинними антитілами. Вторинні антитіла не прикріплюються безпосередньо до збудника, але зв'язуються з первинними антитілами. Коли неокрашенние первинні антитіла зв'язуються зі збудником, флуоресцентні вторинні антитіла можуть спостерігатися зв'язування з первинними антитілами. Таким чином, вторинні антитіла приєднуються побічно до збудника. Оскільки множинні вторинні антитіла часто можуть приєднуватися до первинного антитіла, IFA збільшує кількість флуоресцентних антитіл, прикріплених до зразка, полегшуючи візуалізацію особливостей у зразку (рис.\(\PageIndex{8}\)).
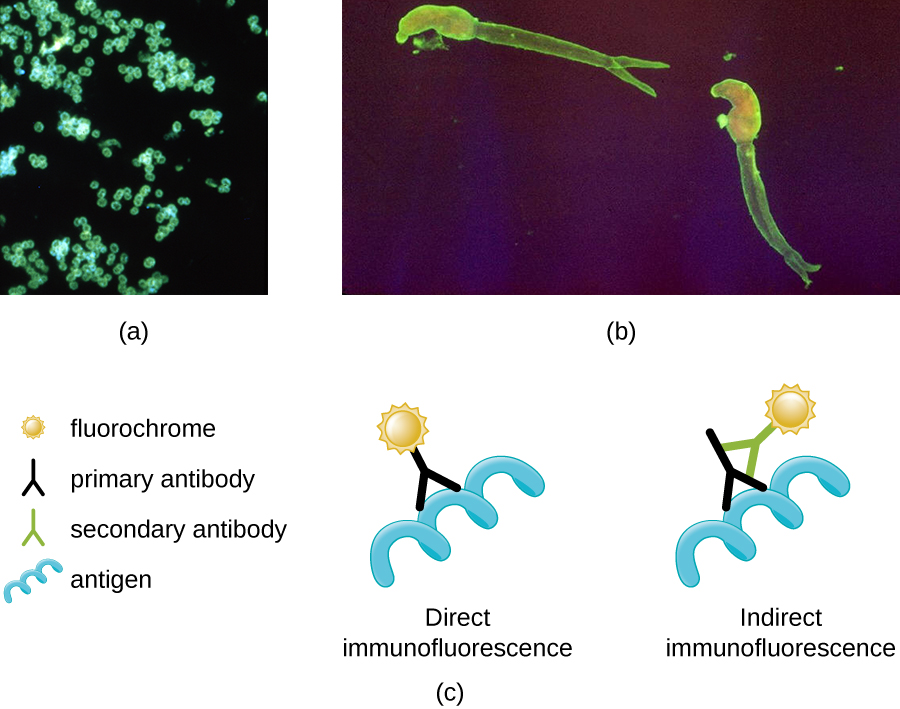
Вправа\(\PageIndex{3}\)
Чому флюорохроми повинні використовуватися для дослідження зразка під флуоресцентним мікроскопом?
Конфокальні мікроскопи
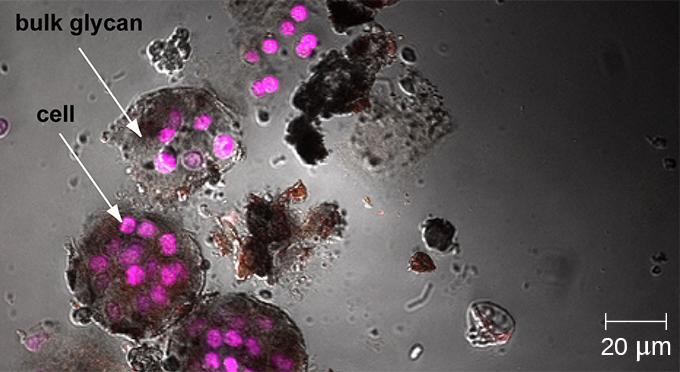
Тоді як інші форми світлової мікроскопії створюють зображення, максимально сфокусоване на одній відстані від спостерігача (глибина або z-площина), конфокальний мікроскоп використовує лазер для послідовного сканування декількох Z-площин. Це дає численні двовимірні зображення з високою роздільною здатністю на різній глибині, які можуть бути побудовані в тривимірне зображення комп'ютером. Як і у випадку з флуоресцентними мікроскопами, флуоресцентні плями зазвичай використовуються для збільшення контрастності та роздільної здатності. Чіткість зображення додатково підвищується за рахунок вузької діафрагми, яка виключає будь-яке світло, яке не знаходиться з z-площини. Таким чином, конфокальні мікроскопи дуже корисні для дослідження товстих зразків, таких як біоплівки, які можна досліджувати живими та нефіксованими (рис.\(\PageIndex{9}\)).
Двофотонні мікроскопи
Хоча оригінальні флуоресцентні та конфокальні мікроскопи дозволили краще візуалізувати унікальні особливості зразків, все ще існували проблеми, які перешкоджали оптимальній візуалізації. Ефективна чутливість флуоресцентної мікроскопії при перегляді товстих зразків, як правило, обмежувалася позафокусованим спалахом, що призвело до поганої роздільної здатності. Це обмеження було значно зменшено в конфокальному мікроскопі завдяки використанню конфокальної точкової щілини для відхилення фонової флуоресценції поза фокусом з тонкими (<1 мкм), нерозмитими оптичними ділянками. Однак навіть конфокальним мікроскопам не вистачало дозволу, необхідного для перегляду зразків товстих тканин. Ці проблеми були вирішені розробкою двофотонного мікроскопа, який використовує метод сканування, флюорохроми та довгохвильове світло (наприклад, інфрачервоне) для візуалізації зразків. Низька енергія, пов'язана з довгохвильовим світлом, означає, що два фотони повинні вражати місце одночасно, щоб порушити флюорохром. Низька енергія світла збудження менш шкідлива для клітин, а довга довжина хвилі світла збудження легше проникає глибоко в товсті зразки. Це робить двофотонний мікроскоп корисним для дослідження живих клітин всередині неушкоджених тканин - зрізів мозку, ембріонів, цілих органів і навіть цілих тварин.
В даний час використання двофотонних мікроскопів обмежується передовими клінічними та дослідницькими лабораторіями через високу вартість приладів. Один двофотонний мікроскоп зазвичай коштує від 300 000 до 500 000 доларів, а лазери, що використовуються для збудження барвників, що використовуються на зразках, також дуже дорогі. Однак у міру вдосконалення технології двофотонні мікроскопи можуть стати більш доступними в клінічних умовах.
Вправа\(\PageIndex{4}\)
Які типи зразків найкраще досліджувати за допомогою конфокальної або двофотонної мікроскопії?
Електронна мікроскопія
Максимальна теоретична роздільна здатність зображень, створених світловими мікроскопами, в кінцевому підсумку обмежується довжинами хвиль видимого світла. Більшість світлових мікроскопів можуть збільшувати лише 1000, а деякі можуть збільшувати до 1500, але це не починає наближатися до збільшувальної потужності електронного мікроскопа (ЕМ), який використовує короткохвильові електронні пучки, а не світло для збільшення збільшення та роздільної здатності.
Електрони, як і електромагнітне випромінювання, можуть вести себе як хвилі, але при довжині хвиль 0,005 нм вони можуть виробляти набагато кращу роздільну здатність, ніж видиме світло. ЕМ може створювати різке зображення, яке збільшено до 100,000. Таким чином, ЕМС може розсмоктувати субклітинні структури, а також деякі молекулярні структури (наприклад, окремі нитки ДНК); однак електронна мікроскопія не може бути використана на живому матеріалі через методи, необхідні для підготовки зразків.
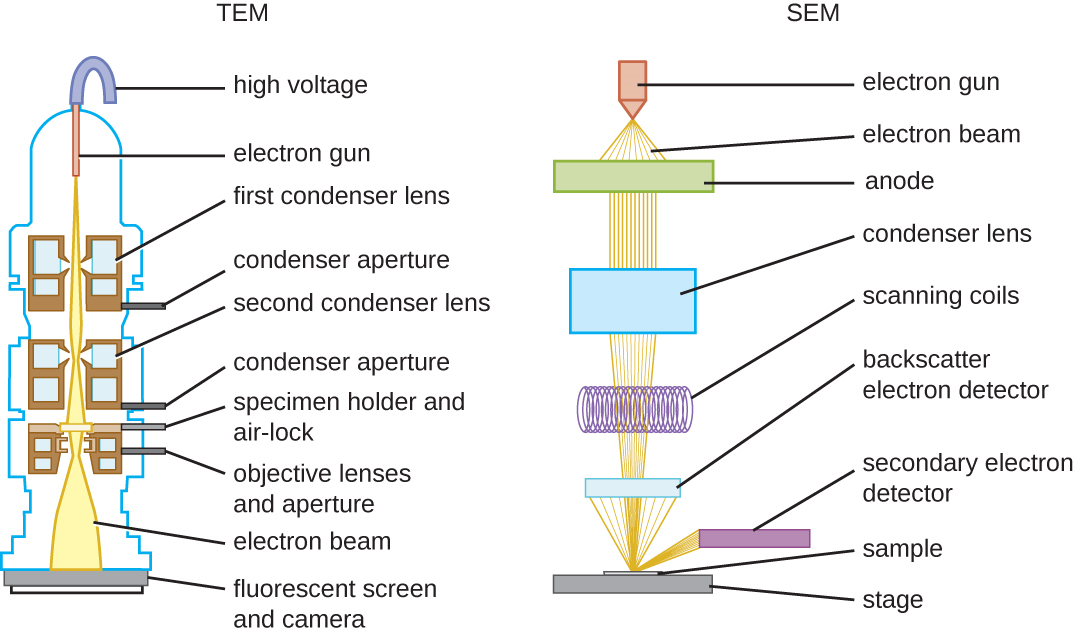
Існує два основних типи ЕМ: просвічувальний електронний мікроскоп (ТЕМ) і скануючий електронний мікроскоп (SEM) (рис.\(\PageIndex{10}\)). ТЕМ кілька аналогічний світловому мікроскопу яскравого поля в плані того, як він функціонує. Однак він використовує електронний промінь зверху зразка, який фокусується за допомогою магнітної лінзи (а не скляної лінзи) і проектується через зразок на детектор. Електрони проходять крізь зразок, а потім детектор захоплює зображення (рис.\(\PageIndex{11}\)).
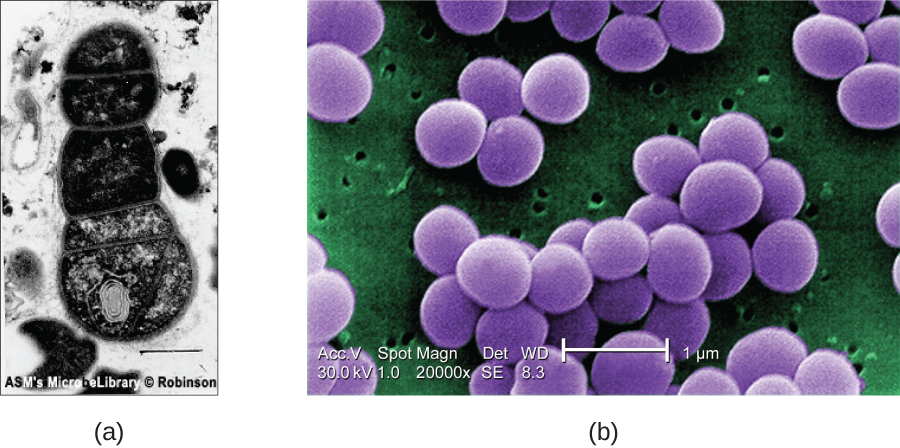
Щоб електрони проходили через зразок у ТЕМ, зразок повинен бути надзвичайно тонким (товщиною 20-100 нм). Зображення створюється через різну непрозорість у різних частинок зразка. Цю непрозорість можна посилити, фарбуючи зразок такими матеріалами, як важкі метали, які мають електронну щільність. TEM вимагає, щоб промінь і зразок знаходилися у вакуумі і щоб зразок був дуже тонким і зневодненим. Конкретні кроки, необхідні для підготовки зразка до спостереження під ЕМ, детально розглянуті в наступному розділі.
СЕМ утворюють зображення поверхонь зразків, як правило, з електронів, які збиваються з зразків пучком електронів. Це дозволяє створювати високодеталізовані зображення з тривимірним виглядом, які відображаються на моніторі (рис.\(\PageIndex{12}\)). Як правило, зразки сушать та готують із фіксаторами, які зменшують артефакти, такі як зморщування, які можуть бути отримані шляхом сушіння, перш ніж покрити напиленням тонким шаром металу, такого як золото. У той час як трансмісійна електронна мікроскопія вимагає дуже тонких ділянок і дозволяє побачити внутрішні структури, такі як органели та внутрішню частину мембран, скануюча електронна мікроскопія може бути використана для перегляду поверхонь великих об'єктів (наприклад, пилкового зерна), а також поверхні дуже малих зразків ( Малюнок\(\PageIndex{13}\)). Деякі EMS можуть збільшити зображення до 2,000,000. 1
Вправа\(\PageIndex{5}\)
- Які переваги та недоліки електронної мікроскопії, на відміну від світлової мікроскопії, для дослідження мікробіологічних зразків?
- Які види зразків найкраще досліджувати за допомогою ТЕА? СЕМ?
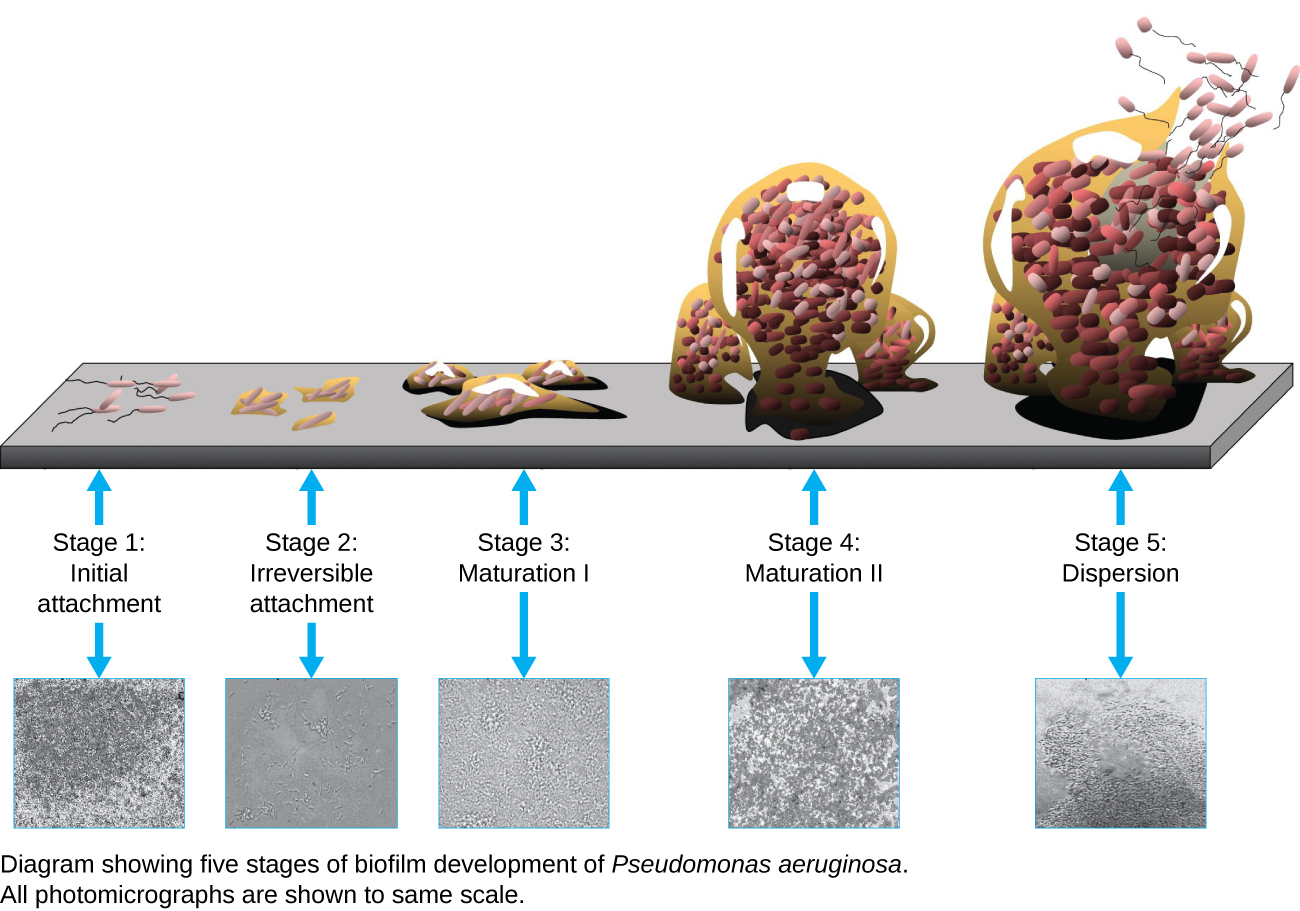
Біоплівка - це складне співтовариство одного або декількох видів мікроорганізмів, як правило, утворюється у вигляді слизового покриття, прикріпленого до поверхні через виробництво екстраполімерної речовини (EPS), яка прикріплюється до поверхні або на межі розділу між поверхнями (наприклад, між повітрям і водою). У природі біоплівки рясні і часто займають складні ніші всередині екосистем (рис.\(\PageIndex{14}\)). У медицині біоплівки можуть покривати медичні прилади і існувати в організмі. Оскільки вони мають унікальні характеристики, такі як підвищена стійкість до імунної системи та до протимікробних препаратів, біоплівки представляють особливий інтерес як для мікробіологів, так і для клініцистів.
Оскільки біоплівки товсті, їх не можна дуже добре спостерігати за допомогою світлової мікроскопії; нарізка біоплівки для створення більш тонкого зразка може вбити або порушити мікробну спільноту. Конфокальна мікроскопія забезпечує чіткіші зображення біоплівок, оскільки вона може фокусуватися на одній z-площині одночасно і виробляти тривимірне зображення товстого зразка. Флуоресцентні барвники можуть бути корисними для ідентифікації клітин в матриці. Крім того, можуть бути використані такі методи, як імунофлюоресценція і флуоресценція in situ гібридизація (FISH), в яких флуоресцентні зонди використовуються для зв'язування з ДНК.
Електронна мікроскопія може бути використана для спостереження за біоплівками, але тільки після зневоднення зразка, який виробляє небажані артефакти і спотворює зразок. На додаток до цих підходів, можна стежити за водними потоками через форми (наприклад, конуси та гриби) біоплівок, використовуючи відео руху флуоресцентно покритих намистин (рис.\(\PageIndex{15}\)).
Скануюча зондова мікроскопія
Скануючий зондовий мікроскоп використовує не світло або електрони, а досить дуже гострі зонди, які пропускаються по поверхні зразка і взаємодіють з ним безпосередньо. Це дає інформацію, яка може бути зібрана в зображення зі збільшенням до 100,000,000. Такі великі збільшення можна використовувати для спостереження окремих атомів на поверхнях. На сьогоднішній день ці методики використовуються в першу чергу для досліджень, а не для діагностики.
Існує два типи скануючого зондового мікроскопа: скануючий тунельний мікроскоп (STM) і атомно-силовий мікроскоп (AFM). STM використовує зонд, який пропускається трохи вище зразка, оскільки зміщення постійної напруги створює потенціал для електричного струму між зондом та зразком. Цей струм відбувається за допомогою квантового тунелювання електронів між зондом і зразком, а інтенсивність струму залежить від відстані між зондом і зразком. Зонд переміщають горизонтально над поверхнею і вимірюють інтенсивність струму. Скануюча тунельна мікроскопія може ефективно відображати структуру поверхонь з роздільною здатністю, при якій можуть бути виявлені окремі атоми.
Подібно до STM, AFM мають тонкий зонд, який пропускається трохи вище зразка. Однак замість того, щоб вимірювати зміни струму на постійній висоті над зразком, AFM встановлює постійний струм і вимірює зміни висоти наконечника зонда при проходженні над зразком. Коли наконечник зонда передається над зразком, сили між атомами (сили ван дер Ваальса, капілярні сили, хімічний зв'язок, електростатичні сили та інші) змушують його рухатися вгору і вниз. Прогин наконечника зонда визначається і вимірюється за законом пружності Гука, і ця інформація використовується для побудови зображень поверхні зразка з роздільною здатністю на атомному рівні (рис.\(\PageIndex{16}\)).

Вправа\(\PageIndex{6}\)
- Який має більш високе збільшення, світловий мікроскоп або скануючий зондовий мікроскоп?
- Назвіть одну перевагу і одне обмеження скануючої зондової мікроскопії.


Ключові поняття та резюме
- Численні типи мікроскопів використовують різні технології для створення мікрознімків. Більшість з них корисні для конкретного типу зразка або застосування.
- Світлова мікроскопія використовує лінзи для фокусування світла на зразку для отримання зображення. Зазвичай використовувані світлові мікроскопи включають яскраве поле, темне поле, фазовий контраст, диференціальний інтерференційний контраст, флуоресценцію, конфокальні та двофотонні мікроскопи.
- Електронна мікроскопія фокусує електрони на зразку за допомогою магнітів, виробляючи набагато більше збільшення, ніж світлова мікроскопія. Просвічувальний електронний мікроскоп (ТЕМ) та скануючий електронний мікроскоп (SEM) є двома поширеними формами.
- Скануюча зондова мікроскопія створює зображення ще більшого збільшення шляхом вимірювання зворотного зв'язку від гострих зондів, які взаємодіють зі зразком. Зондові мікроскопи включають скануючий тунельний мікроскоп (STM) і атомно-силовий мікроскоп (AFM).
Виноски
- 1 «JEM-ARM200F Трансмісійний електронний мікроскоп,» JEOL США Inc, www.jeolusa.com/продукти/Tran... специфікації. Доступно 28.08.2015.
Глосарій
- атомний силовий мікроскоп
- скануючий зонд-мікроскоп, який використовує тонкий зонд, який передається трохи вище зразка для вимірювання сил між атомами і зондом
- бінокулярний
- мають два окуляра
- яскравий польовий мікроскоп
- складний світловий мікроскоп з двома лінзами; він виробляє темне зображення на яскравому тлі
- груба ручка фокусування
- ручка на мікроскопі, який виробляє відносно великі рухи для регулювання фокусування
- хромофори
- пігменти, які поглинають і відображають певні довжини хвиль світла (надаючи їм колір)
- об'єктив конденсатора
- об'єктив на мікроскоп, який фокусує світло від джерела світла на зразок
- конфокальний мікроскоп
- скануючий лазерний мікроскоп, який використовує флуоресцентні барвники та лазери збудження для створення тривимірних
- мікроскоп темного поля
- з'єднання світла мікроскоп, який виробляє яскраве зображення на темному тлі; як правило, модифікований яскраве поле мікроскоп
- діафрагми
- компонент мікроскопа; зазвичай складається з диска під сценою з отворами різних розмірів; можна регулювати, щоб дозволити більш-менш світла від джерела світла, щоб досягти зразка
- диференціальний інтерференційно-контрастний мікроскоп
- мікроскоп, який використовує поляризоване світло для збільшення контрасту
- електронний мікроскоп
- тип мікроскопа, який використовує короткохвильові електронні пучки, а не світло для збільшення збільшення та роздільної здатності
- тонка ручка фокусування
- ручка на мікроскопі, який виробляє відносно невеликі рухи для регулювання фокусування
- флуоресцентний мікроскоп
- мікроскоп, який використовує природні флюорохроми або флуоресцентні плями для збільшення контрасту
- фторохроми
- хромофори, які флуоресцентні (поглинають, а потім випромінюють світло)
- освітлювач
- джерело світла на мікроскопі
- імунофлюоресценції
- метод, який використовує флуоресцентний мікроскоп і антитіло-специфічних флюорохромів для визначення наявності специфічних патогенів у зразку
- монокуляр
- маючи єдиний окуляр
- об'єктивні лінзи
- на світловому мікроскопі лінзи, найближчі до зразка, зазвичай розташовані на кінцях башточок
- очна лінза
- на мікроскопі лінза, найближча до ока (також називається окуляром)
- масло занурення лінзи
- спеціальна об'єктивна лінза на мікроскопі, призначена для використання з іммерсійним маслом для поліпшення роздільної здатності
- фазово-контрастний мікроскоп
- світло мікроскоп, який використовує кільцевої зупинки і кільцевої пластини для збільшення контрасту
- реостат
- перемикач диммера, який контролює інтенсивність освітлювача на світловому мікроскопі
- скануючий електронний мікроскоп (SEM)
- тип електронний мікроскоп, який відскакує електронів від зразка, утворюючи зображення поверхні
- скануючий зондовий мікроскоп
- мікроскоп, який використовує зонд, який подорожує по поверхні зразка на постійній відстані в той час як струм, який чутливий до розміру зазору, вимірюється
- скануючий тунельний мікроскоп
- мікроскоп, який використовує зонд, який передається трохи вище зразка, як зміщення постійної напруги створює потенціал для електричного струму між зондом і зразком
- етап
- платформа мікроскопа, на якій розміщені слайди
- загальне збільшення
- в світловому мікроскопі - величина, розрахована шляхом множення збільшення ока на збільшення об'єктивів
- просвічувальний електронний мікроскоп (ТЕМ)
- тип електронний мікроскоп, який використовує електронний промінь, сфокусовані з магнітами, що проходить через тонкий зразок
- двофотонний мікроскоп
- мікроскоп, який використовує довгохвильовий або інфрачервоне світло для флуоресценції флюорохромів у зразку
- x-y механічні ручки ступені
- ручки на мікроскопі, які використовуються для регулювання положення зразка на поверхні сцени, як правило, для центрування його безпосередньо над світлом
