20.4: Імуноферментні аналізи (EIA) та імуноферментні аналізи (ІФА)
Цілі навчання
- Поясніть відмінності та подібності між ОВД, ФЕІА та ІФА
- Охарактеризуйте різницю та схожість між імуногістохімією та імуноцитохімією
- Опишіть різні цілі прямої та непрямої ІФА
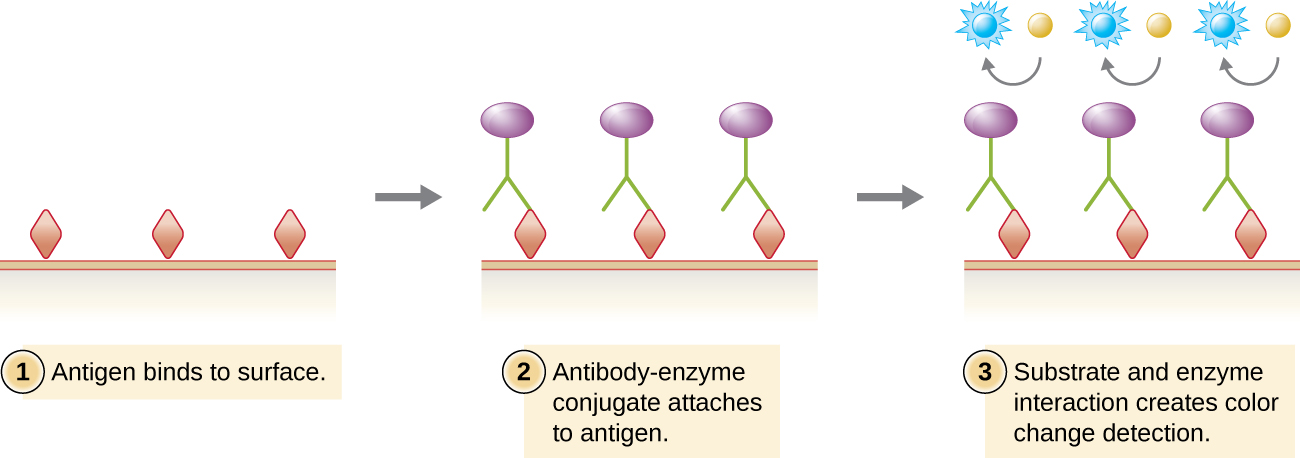
Подібно до західного блота, імуноферментні аналізи (ЕІА) використовують антитіла для виявлення наявності антигенів. Однак EIA відрізняються від західних плям тим, що аналізи проводяться в мікротитрових пластин або in vivo, а не на абсорбуючій мембрані. Існує багато різних типів EIA, але всі вони включають молекулу антитіл, постійна область якої зв'язує фермент, залишаючи змінну область вільною для зв'язування свого специфічного антигену. Додавання субстрату для ферменту дозволяє візуалізувати або кількісно оцінити антиген (рис.20.4.1).
В ЕІА субстратом для ферменту найчастіше є хромоген, безбарвна молекула, яка перетворюється в кольоровий кінцевий продукт. Найбільш широко використовуваними ферментами є лужна фосфатаза і пероксидаза хрону, для яких доступні відповідні субстрати. У деяких ЕІА субстратом є фтороген, нетлуоресцентна молекула, яку фермент перетворює в флуоресцентну форму. EIA, які використовують фтороген, називаються флуоресцентними імуноферментними аналізами (ФЕІА). Флуоресценцію можна виявити або флуоресцентним мікроскопом, або спектрофотометром.
Титр MMR
Вакцина MMR - це комбінована вакцина, яка забезпечує захист від кору, свинки та краснухи (німецький кір). Більшість людей отримують вакцину MMR у дітей і, таким чином, мають антитіла проти цих захворювань. Однак з різних причин навіть щеплені особи можуть знову стати сприйнятливими до цих захворювань пізніше в житті. Наприклад, деякі діти можуть отримати лише один раунд вакцини MMR замість рекомендованих двох. Крім того, титр захисних антитіл в організмі людини може почати знижуватися з віком або внаслідок деяких захворювань.
Щоб визначити, чи достатньо титру антитіл у крові людини для забезпечення захисту, можна провести тест на титр MMR. Тест - це простий імуноаналіз, який можна швидко зробити за допомогою зразка крові. Результати тесту вказуватимуть, чи є у людини ще імунітет або потрібна інша доза вакцини MMR.
Подача титру MMR часто є вимогою до працевлаштування для медичних працівників, особливо тих, хто часто контактує з маленькими дітьми або пацієнтами з ослабленим імунітетом. Якщо медичний працівник заразився кором, свинкою або краснухою, людина могла легко передати ці захворювання сприйнятливим пацієнтам, що призвело до спалаху. Залежно від результатів титру MMR, медичним працівникам може знадобитися ревакцинація перед початком роботи.
імунофарбування
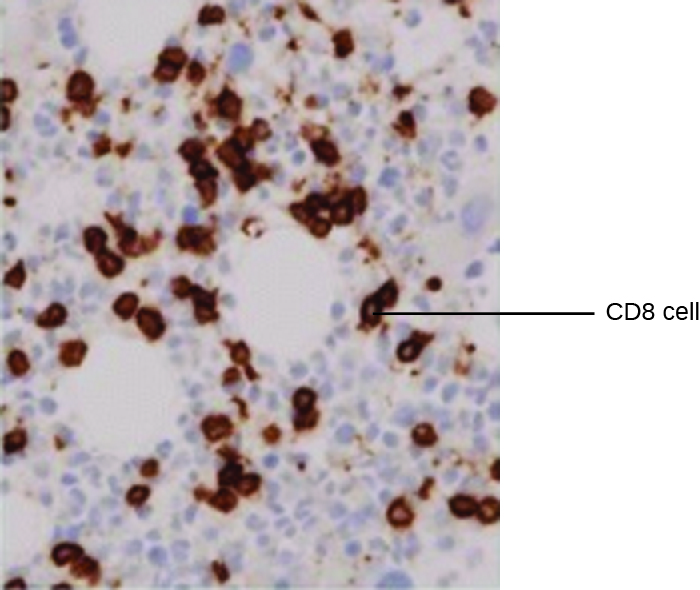
Одним з потужних застосувань ЕІА є імунофарбування, при якому кон'югати антитіло-ферменту підсилюють мікроскопію. Імуногістохімія (IHC) використовується для дослідження цілих тканин. Як видно на малюнку20.4.2, ділянку тканини може бути забарвлений для візуалізації різних типів клітин. У цьому прикладі MaB проти CD8 був використаний для фарбування клітин CD8 в ділянці тканини мигдалин. Тепер можна підрахувати кількість клітин CD8, визначити їх відносну кількість порівняно з іншими наявними типами клітин та визначити розташування цих клітин у цій тканині. Такі дані були б корисними для вивчення таких захворювань, як СНІД, при яких нормальна функція клітин CD8 має вирішальне значення для уповільнення прогресування захворювання.
Імуноцитохімія (ICC) - ще одна цінна форма імунофарбування. Хоча подібно до IHC, в ICC матеріал позаклітинного матриксу відривається, а клітинна мембрана витравлюється спиртом, щоб зробити її проникною для антитіл. Це дозволяє антитілам проходити через клітинну мембрану і зв'язуватися з конкретними мішенями всередині клітини. Таким чином можна візуалізувати органели, цитоскелетні компоненти та інші внутрішньоклітинні структури. Хоча деякі методи ICC використовують EIA, фермент можна замінити флуоресцентною молекулою, що робить його флуоресцентним імуноаналізом.
Вправа20.4.1
- Чим відрізняється імуногістохімія від імуноцитохімії?
- Що повинно бути правдою щодо продукту ферментативної реакції, використовуваного в імуногістохімії?
Імуноферментні аналізи (ІФА)
Імуноферментні аналізи (ІФА) широко використовуються ЕІФА. При прямому ІФА антигени іммобілізуються в лунці мікротитрової пластини. У кожну лунку додають антитіло, специфічне для конкретного антигену і кон'юговане з ферментом. Якщо антиген присутній, то антитіло зв'яжеться. Після промивання для видалення будь-яких незв'язаних антитіл додають безбарвний субстрат (хромоген). Наявність ферменту перетворює субстрат в кольоровий кінцевий продукт (рис.20.4.1). Хоча ця методика швидша, оскільки вимагає використання лише одного антитіла, вона має недолік, що сигнал від прямого ІФА нижчий (нижча чутливість).
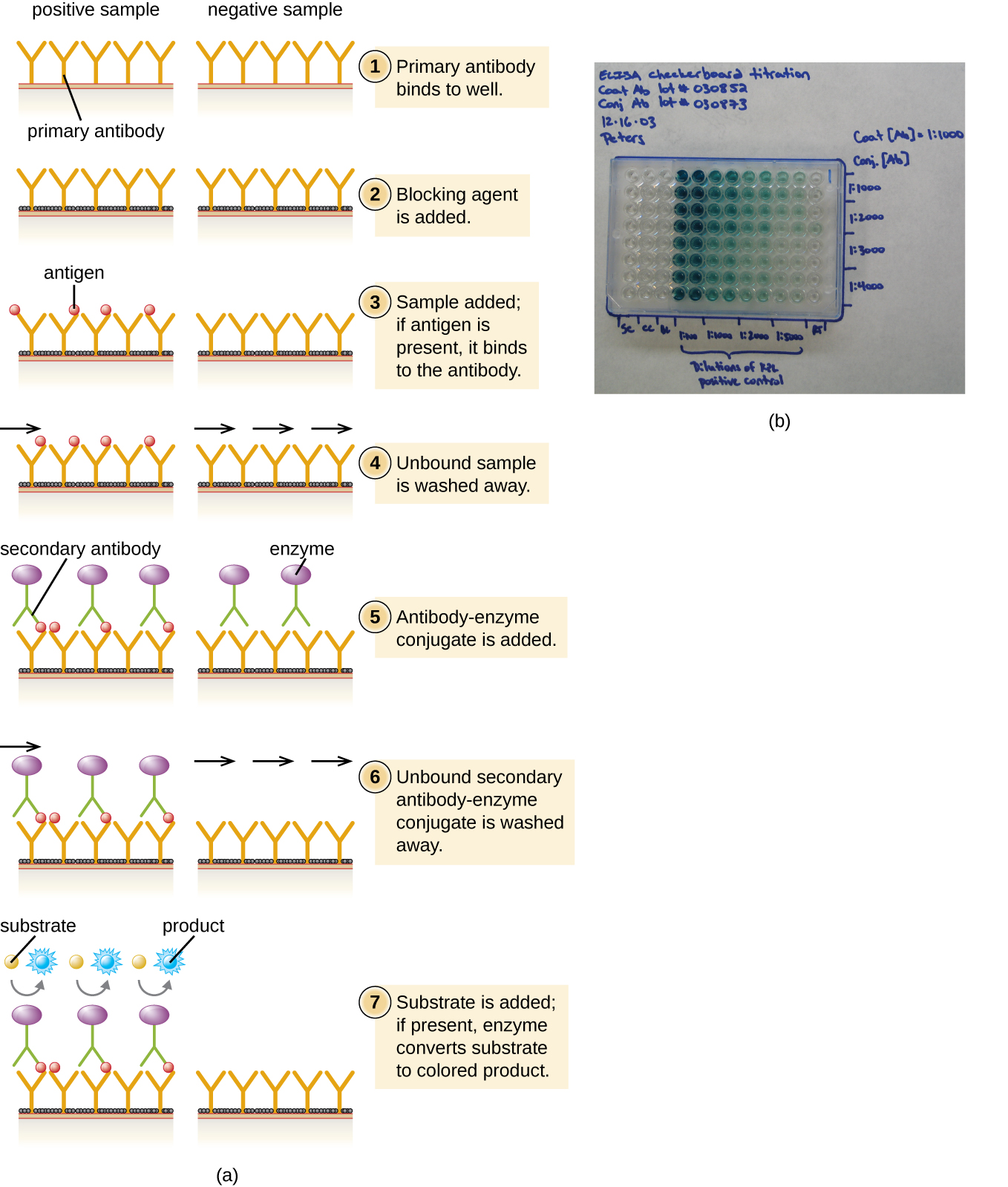
У сендвіч-ІФА метою є використання антитіл для точної кількісної оцінки специфічного антигену, присутнього в розчині, такого як антиген від збудника, сироватковий білок або гормон з крові або сечі, щоб перерахувати лише кілька прикладів. Першим кроком сендвіч-ІФА є додавання первинного антитіла до всіх лунок мікротитрової пластини (рис.20.4.3). Антитіло прилипає до пластиці шляхом гідрофобних взаємодій. Після відповідного часу інкубації будь-яке незв'язане антитіло змивається. Порівняльні промивання використовуються між кожним з наступних етапів, щоб гарантувати, що тільки спеціально пов'язані молекули залишаються прикріпленими до пластини. Потім додають блокуючий білок (наприклад, альбумін або казеїн молочного білка) для зв'язування решти неспецифічних білкових зв'язуючих ділянок в лунці. Деякі свердловини отримають відомі кількості антигену, щоб дозволити побудувати стандартну криву, а до інших свердловин додаються невідомі розчини антигену. Первинне антитіло захоплює антиген і після промивання додається вторинне антитіло, яке є поліклональним антитілом, яке кон'юговано з ферментом. Після остаточного миття додається безбарвний субстрат (хромоген), і фермент перетворює його в кольоровий кінцевий продукт. Інтенсивність кольору зразка, викликана кінцевим продуктом, вимірюється спектрофотометром. Кількість виробленого кольору (вимірюється як поглинання) прямо пропорційна кількості ферменту, який, в свою чергу, прямо пропорційний захопленому антигену. ІФА надзвичайно чутливі, що дозволяє кількісно оцінювати антиген в нанограмі (10 —9 г) на мл діапазону.
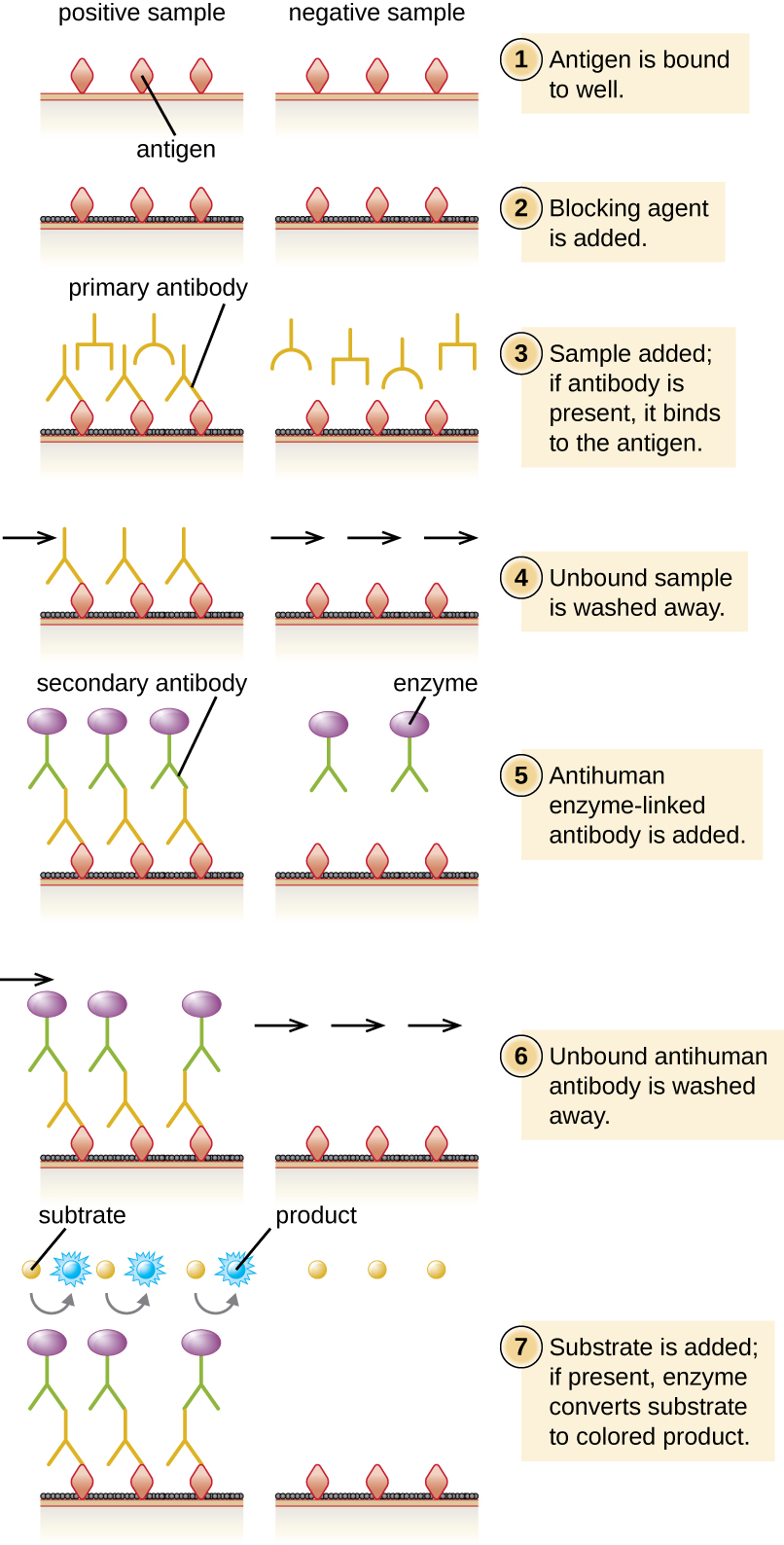
У непрямому ІФА ми кількісно визначаємо антиген-специфічні антитіла, а не антиген. Ми можемо використовувати непряму ІФА для виявлення антитіл проти багатьох типів збудників, включаючи Borrelia burgdorferi (хвороба Лайма) та ВІЛ. Існують три важливі відмінності між непрямими та прямими ІФА, як показано на малюнку20.4.4. Замість того, щоб використовувати антитіла для захоплення антигену, непряма ІФА починається з приєднання відомого антигену (наприклад, пептидів від ВІЛ) до дна лунок мікротитрової пластини. Після блокування незв'язаних ділянок на пластині додається сироватка пацієнта; якщо присутні антитіла (первинне антитіло), вони зв'яжуть антиген. Після вимивання будь-яких незв'язаних білків вторинне антитіло з його кон'югованим ферментом направляється проти первинного антитіла (наприклад, антилюдського імуноглобуліну). Вторинне антитілодозволяє кількісно оцінити, скільки антиген-специфічних антитіл присутній в сироватці пацієнта за інтенсивністю кольору, що виробляється в результаті кон'югованої ферментно-хромогенної реакції.
Як і у випадку з кількома іншими тестами на антитіла, розглянутими в цьому розділі, завжди існує занепокоєння щодо перехресної реактивності з антитілами, спрямованими проти деякого іншого антигену, що може призвести до хибно-позитивних результатів. Таким чином, ми не можемо остаточно діагностувати ВІЛ-інфекцію (або будь-який інший тип інфекції) на основі одного непрямого аналізу ІФА. Ми повинні підтвердити будь-який підозрюваний позитивний тест, який найчастіше робиться за допомогою або імуноблоту, який фактично ідентифікує наявність специфічних пептидів від збудника, або тесту для виявлення нуклеїнових кислот, пов'язаних із збудником, таких як ПЛР із зворотною транскриптазою (ЗТ-ПЛР) або антиген нуклеїнової кислоти тест.
Вправа20.4.2
- Яке призначення вторинного антитіла в прямому ІФА?
- Що кількісно оцінюють прямі та непрямі ІФА?
Клінічна спрямованість: Частина 2
Незважаючи на те, що контакт та тестування пацієнтів 1300 на ВІЛ були б трудомісткими та дорогими, адміністратори сподівалися мінімізувати відповідальність лікарні, активно шукаючи та лікуючи потенційних жертв злочину працівника-шахрая. Раннє виявлення ВІЛ важливо, а оперативне лікування може уповільнити прогресування захворювання.
Існують різноманітні скринінгові тести на ВІЛ, але найбільш широко застосовується непряма ІФА. Як і у випадку з іншими непрямими ІФА, тест працює шляхом приєднання антигену (в даному випадку пептидів ВІЛ) до лунки в 96-луночной пластині. Якщо пацієнт ВІЛ-позитивний, антитіла проти ВІЛ зв'язуються з антигеном і будуть ідентифіковані другим кон'югатом антитіло-фермент.
Вправа20.4.3
- Наскільки точним є непрямий ІФА тест на ВІЛ і які фактори можуть вплинути на точність тесту?
- Чи повинна лікарня використовувати будь-які інші тести для підтвердження результатів непрямого ІФА?
Імунофільтруючі та імунохроматографічні аналізи
Для деяких ситуацій може знадобитися виявлення або кількісне визначення антигенів або антитіл, які присутні в дуже низькій концентрації в розчині. Для того, щоб зробити це можливим, були розроблені методи імунофільтрування. При імунофільтрації великий обсяг рідини пропускається через пористу мембрану в абсорбуючу прокладку. Антиген, прикріплений до пористої мембрани, захоплює антитіла під час проходження; альтернативно, ми також можемо прикріпити антитіло до мембрани для захоплення антигену.
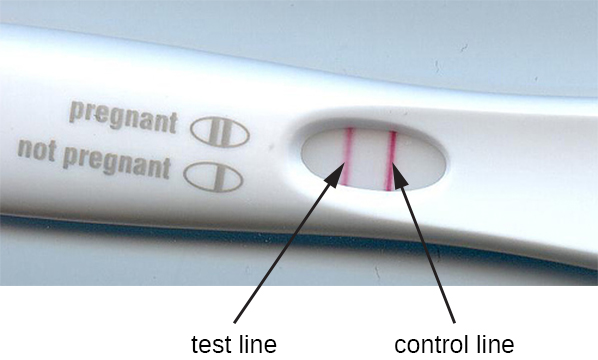
Метод імунофільтрації був адаптований при розробці імунохроматографічних аналізів, широко відомих як тести на бічний потік або смужкові тести. Ці тести швидко і легко виконати, що робить їх популярними для використання в точці догляду (тобто в кабінеті лікаря) або в домашніх умовах. Одним із прикладів є тест TORCH, який дозволяє лікарям перевіряти вагітних жінок або новонароджених на предмет зараження масивом вірусів та інших збудників (токсоплазма, інші віруси, краснуха, цитомегаловірус, простий герпес). Тести на вагітність в домашніх умовах - ще один широко використовуваний приклад тесту на бічний потік (рис.20.4.5). Тести на імунофільтрацію також популярні в країнах, що розвиваються, оскільки коштують недорого і не вимагають постійного охолодження висушених реагентів. Однак технологія також вбудована в деяке складне лабораторне обладнання.
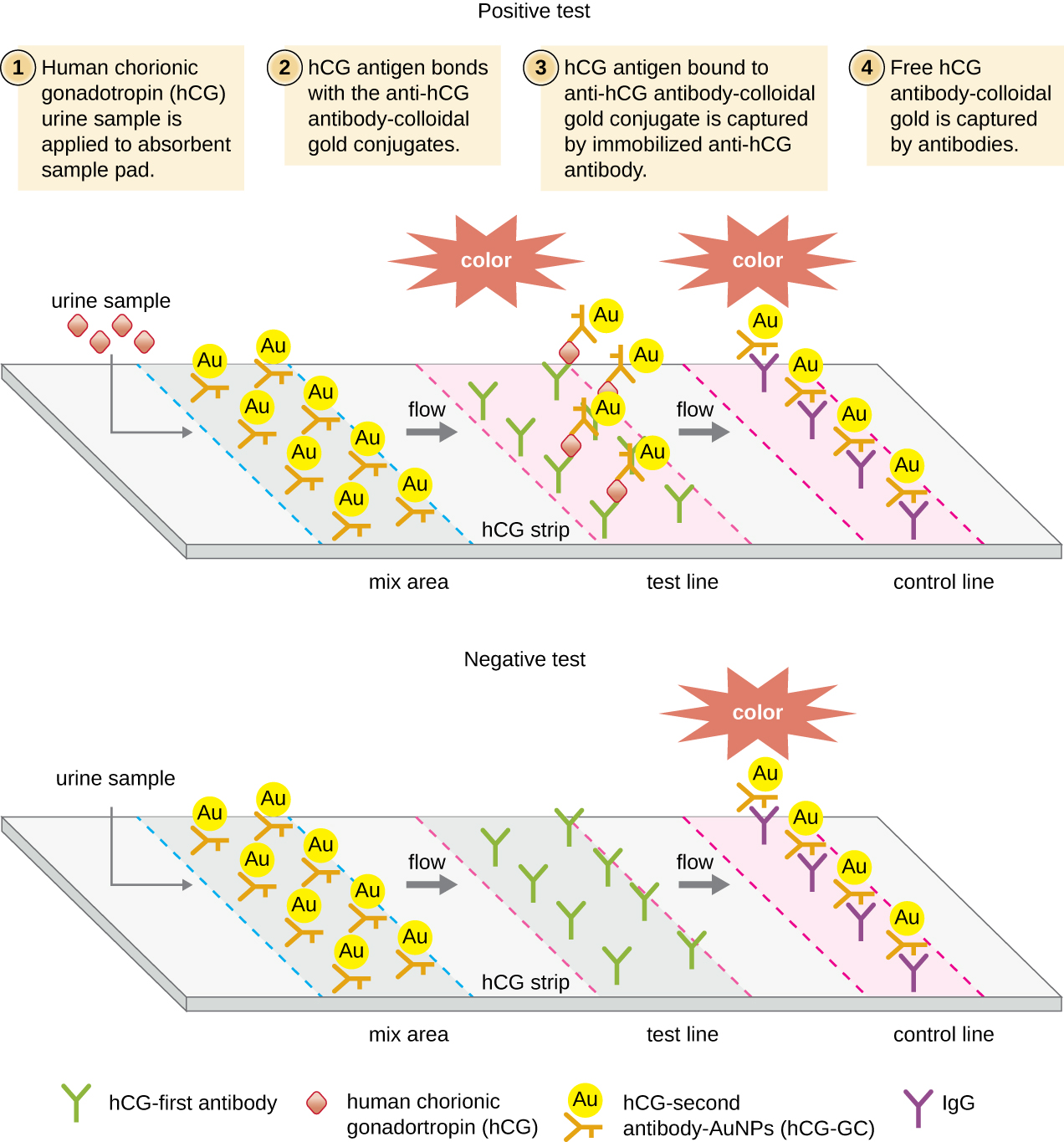
У тестах на бічний потік (рис.20.4.6) рідини, такі як сеча, наносяться на абсорбуючу прокладку на тест-смужці. Рідина протікає капілярним дією і рухається через смугу кульок з прикріпленими до їх поверхонь антитілами. Рідина в зразку фактично гідратує реагенти, які присутні в висушеному стані в смузі. Намистини, покриті антитілами, виготовлені з латексу або крихітних частинок золота, зв'язують антигени в досліджуваній рідині Потім комплекси антитіло-антиген протікають по другій смузі, яка має іммобілізоване антитіло проти антигену; ця смужка збереже кульки, які мають пов'язаний антиген. Третя контрольна смужка пов'язує будь-які намистини. Червоний колір (від частинок золота) або синій (з латексних намистин), що розвивається на тестовій лінії, вказує на позитивний тест. Якщо колір розвивається тільки на контрольній лінії, тест негативний.
Як і методи ІФА, тести на бічний потік використовують переваги бутербродів з антитілами, забезпечуючи чутливість та специфічність. Хоча ці тести не такі кількісні, як ІФА, мають перевагу в тому, що вони швидкі, недорогі та не залежні від спеціального обладнання. Таким чином, їх може виконувати будь-хто. Є деякі побоювання щодо надання таких потужних діагностичних тестів в руки людей, які можуть не зрозуміти обмежень тестів, таких як можливість хибно-позитивних результатів. Хоча домашні тести на вагітність стали широко прийнятими, домашні тести на виявлення антитіл до таких захворювань, як ВІЛ, викликали деякі занепокоєння у медичній спільноті. Деякі поставили під сумнів, чи слід дозволяти самостійне призначення таких тестів за відсутності медичного персоналу, який може пояснити результати аналізів та замовити відповідні підтверджуючі тести. Однак зі зростанням кількості тестів на бічний потік стає доступним та швидким розвитком технології лабораторії на чіпі (рис. 20.1), домашні медичні тести, ймовірно, стануть ще більш звичними в майбутньому.
Вправа20.4.4
- Який фізичний процес вимагає метод бічного потоку для функціонування?
- Поясніть призначення третьої смуги в аналізі бічного потоку.
Таблиця20.4.1 порівнює деякі ключові механізми та приклади деяких ОВД, розглянутих у цьому розділі, а також імуноблоти, які обговорювалися в розділі Виявлення комплексів антиген-антитіла.
| Тип аналізу | Механізм | Конкретні процедури | Приклади |
|---|---|---|---|
| Імуноблоти | Використовує кон'югати ензим-антитіла для ідентифікації специфічних білків, які були перенесені на абсорбуючу мембрану | Вестерн пляма: виявляє наявність певного білка | Виявлення наявності пептидів ВІЛ (або пептидів від інших інфекційних агентів) у сироватках пацієнта |
| імунофарбування | Використовує кон'югати ензим-антитіла для фарбування конкретних молекул на клітині або в них | Імуногістохімія: Використовується для фарбування специфічних клітин у тканині | Пляма на наявність клітин CD8 в тканині господаря |
| Імуноферментний аналіз (ІФА) | Використовує кон'югати ензим-антитіла для кількісної оцінки молекул мішені | Прямий ІФА: використовує одне антитіло для виявлення наявності антигену | Виявлення ВІЛ-антигену p24 до одного місяця після зараження |
| Непрямий ІФА: Вимірює кількість антитіл, вироблених проти антигену | Виявлення антитіл до ВІЛ в сиро | ||
| Імунохроматографічні (бічні течії) аналізи | Методи використовують захоплення проточних, кольорових мічених комплексів антиген-антитіла фіксованими антитілами для діагностики захворювання | Сендвіч ІФА: Вимірює кількість антигену, пов'язаного антитілом | Виявлення антитіл до різних патогенних мікроорганізмів у сироватках пацієнта (наприклад, швидкий стреп, малярійний щуп) |
| Тест на вагітність виявлення хоріонічного гонадотропіну людини в сечі |
Клінічна спрямованість: Частина 3
Хоча непрямий ІФА на ВІЛ є чутливим аналізом, існує кілька ускладнюючих міркувань. По-перше, якщо заражена людина проходить тестування занадто рано після зараження, тест може дати хибно-негативні результати. Вікно сероконверсії зазвичай становить близько трьох тижнів, але в деяких випадках воно може становити більше двох місяців.
Окрім помилкових негативів, також можуть виникати помилкові спрацьовування, як правило, через попередні інфекції іншими вірусами, які індукують антитіла перехресної реакції. Хибно-позитивний показник залежить від конкретної марки використовуваного тесту, але 0,5% не є незвичайним. 1 Через можливість помилкового позитиву всі позитивні тести супроводжуються підтверджуючим тестом. Цей підтверджуючий тест часто є імуноблотом (західним блотом), в якому пептиди ВІЛ з крові пацієнта ідентифікуються за допомогою ВІЛ-специфічного кон'югату MAB-ферменту. Позитивний західний блот підтвердив би ВІЛ-інфекцію, а негативний блот підтвердив би відсутність ВІЛ, незважаючи на позитивну ІФА.
На жаль, західні блоти для антигенів ВІЛ часто дають невизначені результати, і в цьому випадку вони не підтверджують і не визнають недійсними результати непрямого ІФА. Насправді норма індетермінантів може становити 10— 49% (саме тому в сукупності з їх вартістю західні плями не використовуються для скринінгу). Подібно до непрямого ІФА, індетермінантний західний блот може виникнути через перехресну реактивність або попередні вірусні інфекції, щеплення або аутоімунні захворювання.
Вправа20.4.5
- З 1300 пацієнтів, які тестуються, скільки хибно-позитивних ІФА можна було б очікувати?
- З помилкових спрацьовувань, скільки можна очікувати індетермінантних західних плям?
- Як би лікарня вирішувала будь-які випадки, коли західна пляма пацієнта була невизначеною?
Ключові поняття та резюме
- Імуноферментні аналізи (EIA) використовуються для візуалізації та кількісної оцінки антигенів. Вони використовують антитіло, кон'юговане з ферментом для зв'язування антигену, а фермент перетворює субстрат у спостережуваний кінцевий продукт. Субстратом може бути або хромоген, або фтороген.
- Імунофарбування - це методика EIA для візуалізації клітин в тканині (імуногістохімія) або дослідження внутрішньоклітинних структур (імуноцитохімія).
- Прямий ІФА використовується для кількісної оцінки антигену в розчині. Первинне антитіло захоплює антиген, а вторинне антитіло доставляє фермент. Виробництво кінцевого продукту з хромогенного субстрату прямо пропорційно кількості захопленого антигену.
- Непрямий ІФА використовується для виявлення антитіл у сироватці пацієнта шляхом приєднання антигену до лунки мікротитрової пластини, що дозволяє пацієнту (первинному) антитілу зв'язувати антиген і кон'юговане ферментом вторинне антитіло для виявлення первинного антитіла.
- Імунофільтрувальні та імунохроматографічні аналізи використовуються в тестах бічного потоку, які можуть бути використані для діагностики вагітності та різних захворювань шляхом виявлення кольорових мічених комплексів антиген-антитіла в сечі або інших зразках рідини
Виноски
- 1 Томас, Джастін Г., Віктор Джаффе, Джудіт Шаффер та Хосе Абреу, «Тестування на ВІЛ: рекомендації США 2014,» Остеопатічний сімейний лікар 6, № 6 (2014).
