20.2: Виявлення комплексів антиген-антитіла in vitro
- Page ID
- 3973
Цілі навчання
- Опишіть різні типи аналізів, що використовуються для пошуку комплексів антиген-антитіла
- Опишіть обставини, при яких комплекси антиген-антитіла випадають в осад з розчину
- Поясніть, як антитіла в сироватці крові пацієнта можуть бути використані для діагностики захворювання
Лабораторні тести для виявлення антитіл і антигенів поза організмом (наприклад, в пробірці) називаються аналізами in vitro. Коли в розчині присутні як антитіла, так і відповідні їм антигени, ми часто можемо спостерігати реакцію опадів, при якій утворюються і осідають з розчину великі комплекси (решітки). У наступних кількох розділах ми обговоримо кілька поширених аналізів in vitro.
Реакції опадів
Видимий комплекс антиген-антитіло називається преципітином, а аналізи in vitro, які виробляють преципітин, називаються реакціями преципітину. Реакція преципітину зазвичай включає додавання розчинних антигенів до пробірки, що містить розчин антитіл. Кожне антитіло має дві руки, кожна з яких може зв'язуватися з епітопом. Коли антитіло зв'язується з двома антигенами, два антигени зв'язуються між собою антитілом. Решітка може утворюватися як антитіла пов'язують все більше антигенів разом, в результаті чого утворюється преципітин (рис.\(\PageIndex{1}\)). Більшість тестів преципітину використовують поліклональну антисироватку, а не моноклональні антитіла, оскільки поліклональні антитіла можуть зв'язуватися з декількома епітопами, що робить формування решітки більш імовірним. Хоча MAB можуть зв'язувати деякі антигени, зв'язування буде відбуватися рідше, що робить набагато менше ймовірності утворення видимого преципітину.
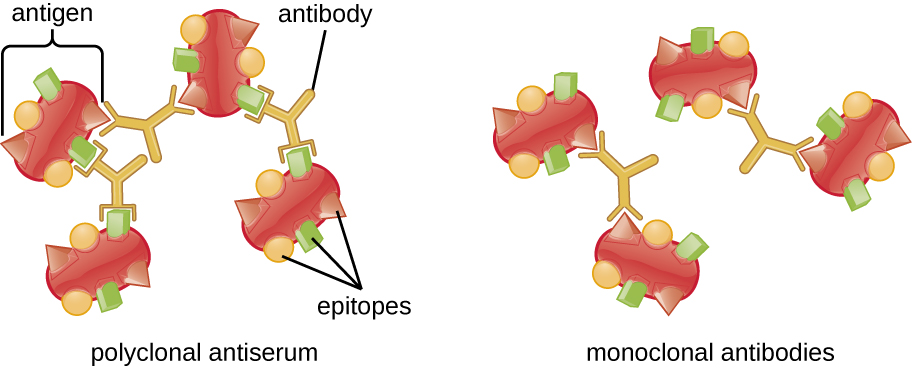
Кількість опадів також залежить від кількох інших факторів. Наприклад, осадження посилюється, коли антитіла мають високу спорідненість до антигену. Хоча більшість антитіл пов'язують антиген з високою спорідненістю, навіть зв'язування з високою афінністю використовує відносно слабкі нековалентні зв'язки, так що індивідуальні взаємодії часто розриваються і відбуватимуться нові взаємодії.
Крім того, щоб утворення преципітину було видно, має бути оптимальне співвідношення антитіла до антигену. Оптимальним співвідношенням навряд чи буде співвідношення антигену до антитіла 1:1; воно може різко змінюватися, залежно від кількості епітопів на антигені та класу антитіл. Деякі антигени можуть мати лише один або два епітопи, розпізнавані антисироваткою, тоді як інші антигени можуть мати багато різних епітопів та/або кілька екземплярів одного епітопу на одній молекулі антигену.
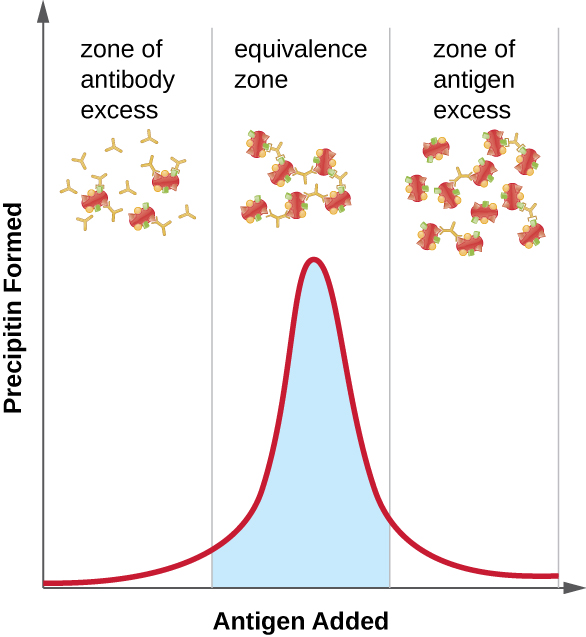
Малюнок\(\PageIndex{2}\) ілюструє, як співвідношення антигену і антитіл впливає на кількість опадів. Для досягнення оптимального співвідношення антиген повільно додають в розчин, що містить антитіла, і якісно визначається кількість преципітину. Спочатку антигену недостатньо, щоб виробляти видиме утворення решітки; це називається зоною надлишку антитіл. У міру додавання більшої кількості антигену реакція потрапляє в зону еквівалентності (або зону еквівалентності), де відбувається як оптимальна взаємодія антиген-антитіло, так і максимальне осадження. Якби було додано ще більше антигену, кількість антигену стане надмірною і фактично призведе до зменшення кількості опадів.
Вправа\(\PageIndex{1}\)
- Що таке опади?
- Чому поліклональні антисироватки виробляють кращу реакцію опадів?
Випробування Кільце Опади
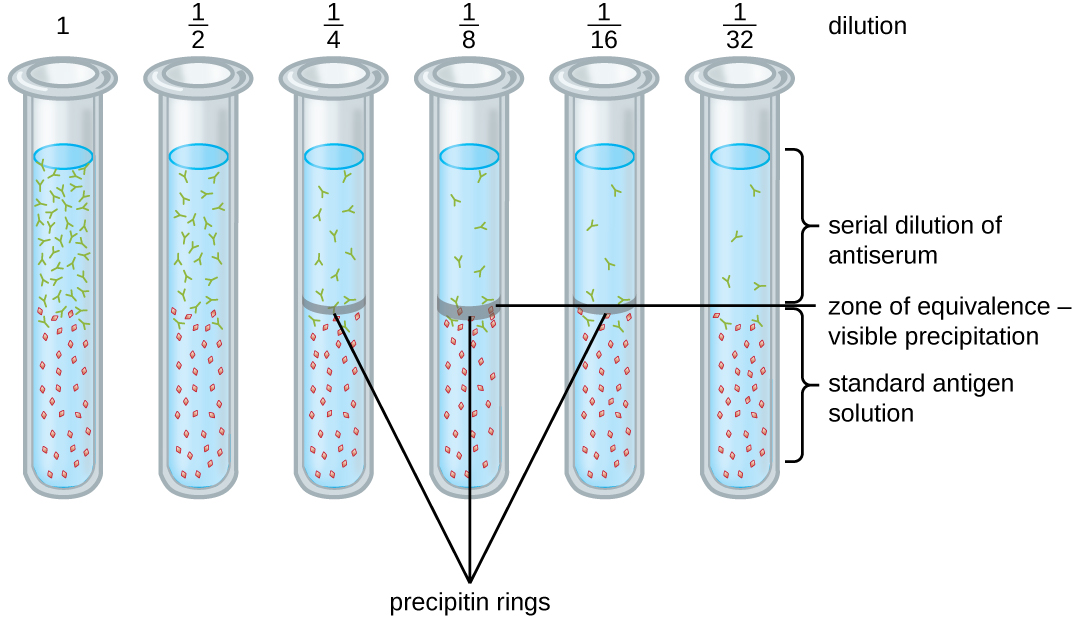
Різноманітні методики дозволяють використовувати утворення преципітину для кількісної оцінки або концентрації антигену, або кількості антитіл, присутніх в антисироватці. Однією з таких методик є кільцевий тест преципітину (рис.\(\PageIndex{3}\)), який використовується для визначення відносної кількості антиген-специфічних антитіл у зразку сироватки крові. Для виконання цього тесту готують набір пробірок, додаючи на дно кожної пробірки розчин антигену. Кожна пробірка отримує однаковий об'єм розчину, а концентрація антигенів постійна (наприклад, 1 мг/мл). Далі в розчин антигену в кожну пробірку додають гліцерин з подальшим серійним розведенням антисироватки. Гліцерин перешкоджає змішуванню антисироватки з розчином антигену, дозволяючи зв'язуванню антиген-антитіла відбуватися тільки на межі розділу двох розчинів. Результатом є видиме кільце преципітину в пробірках, які мають співвідношення антиген-антитіло в межах зони еквівалентності. Це найбільш високе розведення з видимим кільцем використовується для визначення титру антитіл. Титр - це зворотне найвищого розведення, що показує позитивний результат, виражений цілим числом. На\(\PageIndex{3}\) малюнку титр дорівнює 16.
Хоча вимірювання титру не говорить нам в абсолютному вираженні, скільки антитіл присутній, воно дає міру біологічної активності, яка часто важливіша за абсолютну кількість. У цьому прикладі було б некорисно знати, яка маса IgG була присутня в антисироватці крові, оскільки існує багато різних особливостей антитіл; але нам важливо знати, наскільки активність антитіл у сироватці пацієнта спрямована проти цікавого антигену (наприклад, a конкретного збудника або алергену).
Аналіз Ухтерлоні
Хоча тест на кільце преципітину дає уявлення про взаємодії антитіло-антиген, він також має деякі недоліки. Він вимагає використання великої кількості сироватки, і необхідно дотримуватися великої обережності, щоб уникнути змішування розчинів і порушення роботи кільця. Виконання подібного тесту в матриці з агаром-гелем може мінімізувати ці проблеми. Цей тип аналізу по-різному називають подвійною імунодифузією або аналізом Ouchterlony для Оряна Ухтерлоні, 1, який вперше описав техніку в 1948 році.
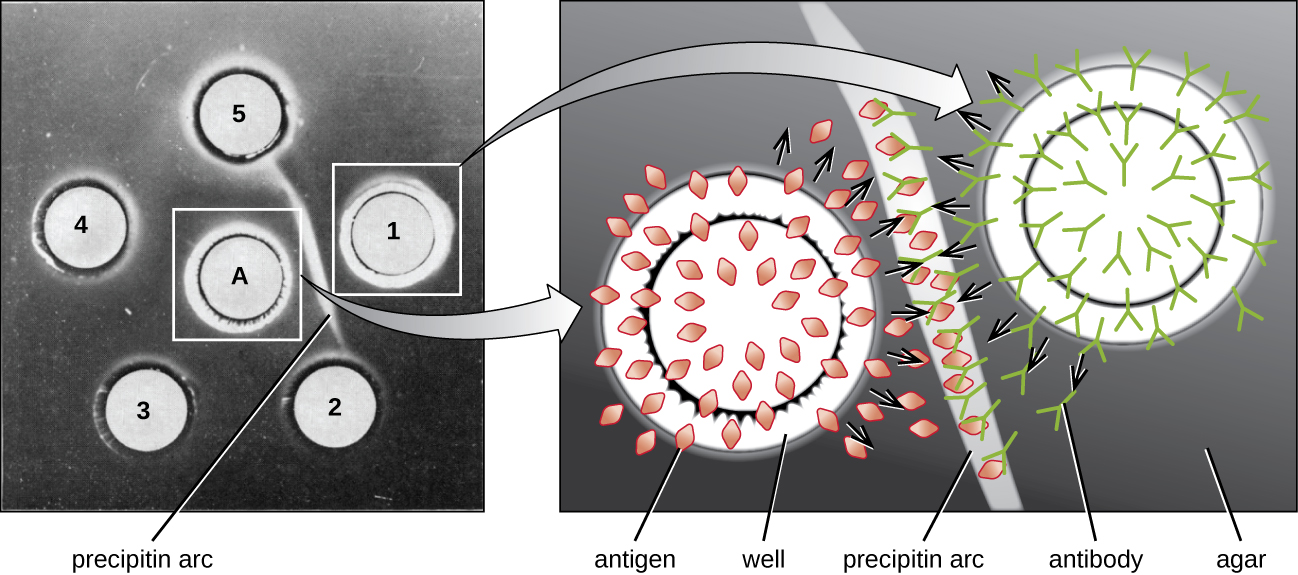
Коли агар високоочищений, він утворює прозорий безбарвний гель. У гелі пробивають отвори для утворення лунок, а в сусідні лунки додають антиген і антисироватку. Білки здатні дифузіроваться через гель, а між лунками утворюються преципітинние дуги в зоні еквівалентності. Оскільки решітка pecipitin занадто велика, щоб розсіяти через гель, дуги міцно зафіксовані на місці і їх легко побачити (рис.\(\PageIndex{4}\)).
Хоча зараз існують більш чутливі і кількісні методи виявлення взаємодій антитіло-антиген, тест Ухтерлоні забезпечує швидкий і якісний спосіб визначення наявності антисироватки антитіл проти того чи іншого антигену. Тест Ухтерлоні особливо корисний при пошуку перехресної реактивності. Ми можемо перевірити антисироватку проти групи тісно пов'язаних антигенів і побачити, які комбінації утворюють дуги преципітину.
Радіальний імунодифузійний аналіз
Аналіз радіальної імунодифузії (RID) схожий на аналіз Ouchterlony, але використовується для точної кількісної оцінки концентрації антигену, а не для порівняння різних антигенів. У цьому аналізі антисироватку додають до темперованого агару (рідкого агару при трохи вище 45° С), який наливають у невелику чашку Петрі або на скляну гірку і дають охолонути. Лунки розрізають в охолодженому агарі, а потім в лунки додають антиген і дають розсіюватися. У міру взаємодії антигену і антитіла вони утворюють зону опадів. Квадрат діаметра зони опадів прямо пропорційний концентрації антигену. Вимірюючи зони опадів, вироблених зразками відомої концентрації (див. Зовнішнє кільце зразків на рис.\(\PageIndex{5}\)), ми можемо підготувати стандартну криву для визначення концентрації невідомого розчину. Аналіз RID також є корисним тестом для визначення концентрації багатьох білків сироватки крові, таких як білки комплементу C3 та C4, серед інших.
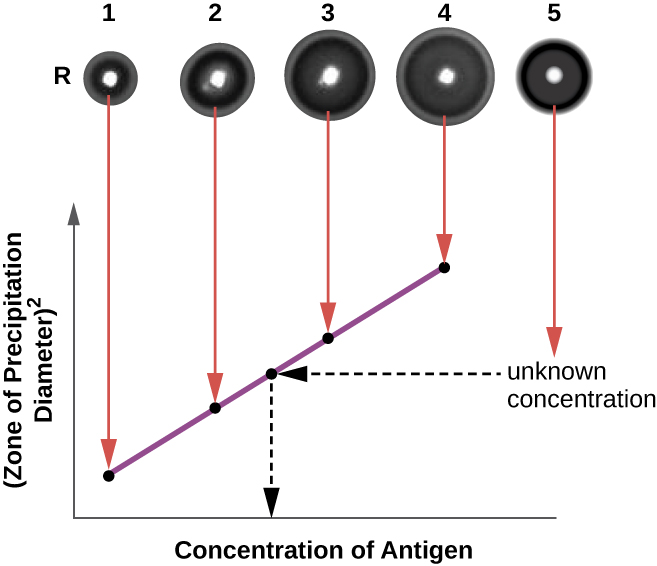
Вправа\(\PageIndex{2}\)
- Чому в тесті кільця pecipitin утворюється кільце pecipitin, і які деякі причини, чому кільце може не утворюватися?
- Порівняйте та порівняйте методи, що використовуються в аналізі Ouchterlony та променевому імунодиффузійному аналізі.
Флокуляційні аналізи
Флокуляційний аналіз схожий на реакцію пресіпітину, за винятком того, що він включає нерозчинні антигени, такі як ліпіди. Флокулянт схожий на пресіпітин тим, що є видима решітка антигену та антитіл, але оскільки ліпіди нерозчинні у водному розчині, вони не можуть випасти в осад. Замість опадів в рідині пробірки спостерігається флокуляція (спінювання).
Використання флокуляції для тестування на сифіліс
Сифіліс - це інфекція, що передається статевим шляхом, яка може спричинити важке хронічне захворювання у дорослих. Крім того, він легко передається від інфікованих матерів до їх новонароджених під час вагітності та пологів, що часто призводить до мертвонародження або серйозних довгострокових проблем зі здоров'ям немовляти. На жаль, сифіліс також важко діагностувати у майбутніх мам, оскільки він часто протікає безсимптомно, особливо у жінок. Крім того, збудник, бактерія Treponema pallidum, як важко виростити на звичайних лабораторних середовищах, так і занадто малий, щоб побачити за допомогою звичайної мікрокопії. З цих причин передбачувані діагнози сифілісу, як правило, підтверджуються побічно в лабораторії за допомогою тестів, які виявляють антитіла до трепонемних антигенів.
У 1906 році німецький вчений Август фон Вассерман (1866—1925) ввів перший тест на сифіліс, який спирався на виявлення антитрепонемних антитіл у крові пацієнта. Антитіла, виявлені в тесті Вассермана, представляли собою антифосфоліпідні антитіла, неспецифічні до T. pallidum. Їх наявність може допомогти в діагностиці сифілісу, але оскільки вони неспецифічні, вони також можуть призвести до хибно-позитивних результатів у пацієнтів з іншими захворюваннями та аутоімунними станами. Оригінальний тест Вассермана протягом багатьох років модифікувався, щоб мінімізувати помилкові позитиви, і тепер відомий як тест лабораторії досліджень венеричних захворювань, більш відомий під його абревіатурою, тест VDRL.
Для виконання тесту VDRL сироватку пацієнта або спинномозкову рідину поміщають на гірку з сумішшю кардіоліпіну (антигенного фосфоліпіду, виявленого в мембрані мітохондрій різних збудників), лецитину, холестерину. Лецитин і холестерин стабілізують реакцію і зменшують помилкові спрацьовування. Антитрепонемні антитіла з сироватки інфікованого пацієнта зв'яжуть кардіоліпін і утворюють флокулянт. Хоча тест VDRL є більш специфічним, ніж оригінальний аналіз Вассермана, помилкові спрацьовування все ще можуть виникати у пацієнтів з аутоімунними захворюваннями, які викликають великі пошкодження клітин (наприклад, системний червоний вовчак).
Аналіз нейтралізації
Щоб викликати інфекцію, віруси повинні зв'язуватися з рецепторами на клітинах-господарях. Противірусні антитіла можуть нейтралізувати вірусні інфекції шляхом покриття віріонів, блокуючи зв'язування (рис. 18.1.6). Ця активність нейтралізує віріони і може призвести до утворення великих антитіло-вірусних комплексів (які легко видаляються фагоцитозом) або зв'язуванням антитіл з вірусом і блокуванням його зв'язування з рецепторами клітин господаря. Ця нейтралізаційна активність є основою нейтралізаційних аналізів, чутливих аналізів, що застосовуються для діагностики вірусних інфекцій.
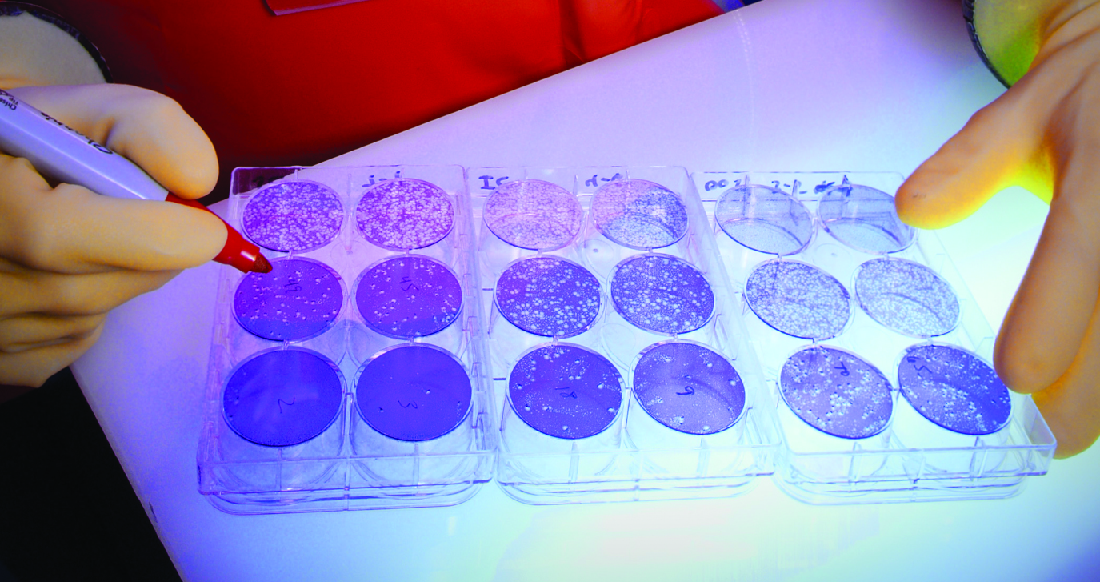
Коли віруси заражають клітини, вони часто викликають пошкодження (цитопатичні ефекти), які можуть включати лізис клітин господаря. Цитопатичні ефекти можна візуалізувати шляхом вирощування клітин господаря в чашці Петрі, покриваючи клітини тонким шаром агару, а потім додаючи вірус (див. Виділення, Культура та Ідентифікація вірусів). Вірус буде дуже повільно дифундувати через агар. Вірус потрапить в клітину господаря, розмножуватися (спричиняючи пошкодження клітин), звільняється від мертвої клітини господаря, а потім переміститься до сусідніх клітин. У міру відмирання все більшої кількості клітин будуть утворюватися бляшки відмерлих клітин (рис.\(\PageIndex{6}\)).
Під час вірусної інфекції пацієнт матиме реакцію антитіл до вірусу, і ми можемо кількісно оцінити ці антитіла за допомогою аналізу зменшення зубного нальоту. Для виконання аналізу проводять серійне розведення на зразку сироватки. Потім кожне розведення змішується зі стандартизованою кількістю підозрюваного вірусу. Будь-які вірусоспецифічні антитіла в сироватці крові нейтралізують частину вірусу. Потім суспензії додають до клітин господаря в культурі, щоб дозволити будь-якому ненейтралізованому вірусу інфікувати клітини і утворювати бляшки через кілька днів. Титр визначається як зворотний найвищого розведення, що показує 50% зменшення бляшок. Титр завжди виражається цілим числом. Наприклад, якщо розведення 1/64 було найвищим розведенням, щоб показати 50% зменшення нальоту, то титр дорівнює 64.
Наявність антитіл у сироватці пацієнта не говорить нам про те, інфікований пацієнт в даний час або був інфікований в минулому. Поточні інфекції можна виявити, зачекавши два тижні та протестуючи інший зразок сироватки. Чотириразове збільшення нейтралізуючого титру в цьому другому зразку свідчить про нову інфекцію.
Вправа\(\PageIndex{3}\)
У аналізі на нейтралізацію, якщо сироватка пацієнта має високу кількість противірусних антитіл, чи очікуєте ви побачити більше чи менше бляшок?
імуноелектрофорез
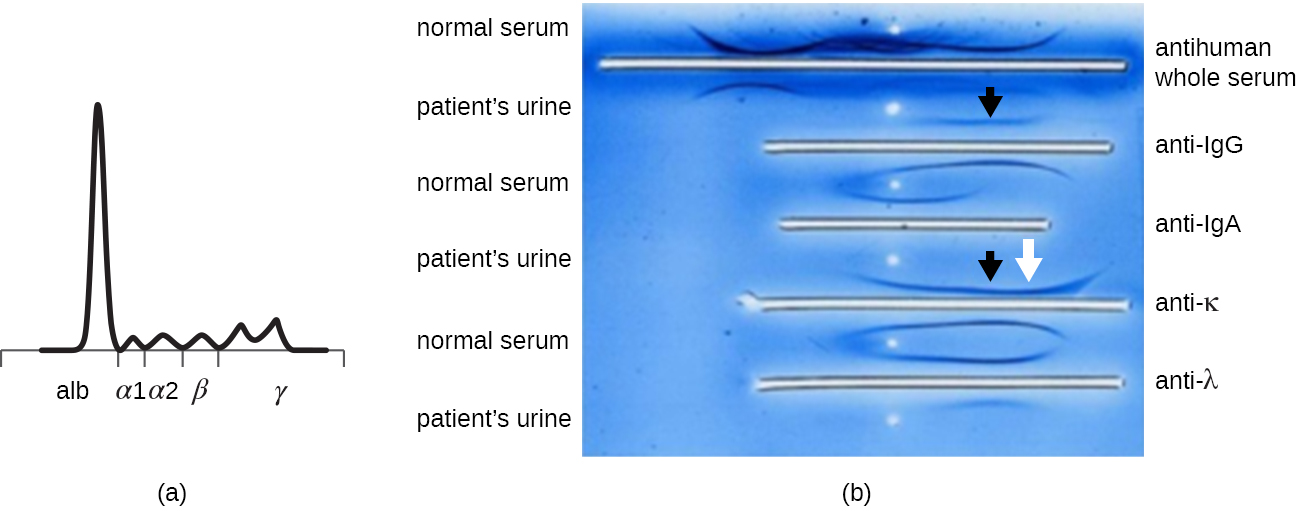
Коли пацієнт має підвищений рівень білка в крові або втрачає білок у сечі, клініцист часто замовляє аналіз на електрофорез поліакриламідного гелю (PAGE) (див. Візуалізація та характеристика ДНК, РНК та білка). Цей аналіз порівнює відносну велику кількість різних видів білків сироватки крові. Аномальні схеми електрофорезу білка можуть бути додатково вивчені за допомогою імуноелектрофорезу (ІЕП). IEP починається з запуску PAGE. Антисери проти вибраних білків сироватки додають до жолобів, що проходять паралельно доріжці електрофорезу, утворюючи дуги преципітину, подібні до тих, що спостерігаються в аналізі Ouchterlony (рис.\(\PageIndex{7}\)). Це дозволяє ідентифікувати аномальні білки імуноглобуліну в зразку.
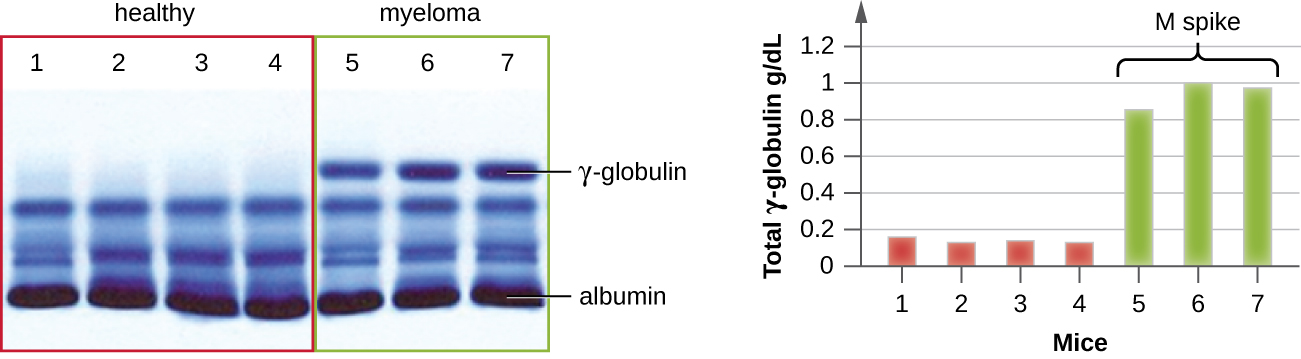
ІЕП особливо корисний при діагностиці множинної мієломи, раку клітин, що секретують антитіла. Пацієнти з множинною мієломою не можуть виробляти здорові антитіла; замість цього вони виробляють аномальні антитіла, які є моноклональними білками (M білки) Таким чином, пацієнти з множинною мієломою будуть мати підвищений рівень білка в сироватці крові, які показують виразну смугу в області гамма-глобуліну білкового гелю електрофорезу та різкий спайк (у білку М) на скануванні денситометра, а не нормальний широкий мазок (рис.\(\PageIndex{7}\)). Коли антитіла проти різних типів важких та легких ланцюгів антитіл використовуються для формування дуг преципітину, білок М спричинить чітко перекошені дуги проти одного класу важкого ланцюга та одного класу легкого ланцюга, як показано на малюнку\(\PageIndex{7}\).
Білковий електрофорез і характеристика структури імуноглобуліну
Поява електрофорезу в кінцевому підсумку призвело до дослідження і розуміння структури антитіл. Коли шведський біохімік Арне Тізеліус (1902—1971) опублікував перші результати електрофорезу білка в 1937 році 2, він міг визначити білковий альбумін (найменший і найпоширеніший білок сироватки) за гострою смугою, яку він виробляв у гелі. Інші білки сироватки не могли бути дозволені за допомогою простого білкового електрофорезу, тому він назвав три широкі смуги, з багатьма білками в кожній смузі, альфа, бета і гамма-глобулінів. Через два роки американський імунолог Елвін Кабат (1914—2000) поїхав до Швеції для роботи з Тізеліусом за допомогою цієї нової методики і показав, що антитіла мігрують у вигляді гамма-глобулінів. 3 З цим новим розумінням, дослідники незабаром дізналися, що множинна мієлома, оскільки це рак клітин, що секретують антитіла, може бути попередньо діагностована за наявністю великого спайка М в області гамма-глобуліну за допомогою білкового електрофорезу. До цього відкриття дослідження структури імуноглобуліну були мінімальними, через труднощі отримання чистих зразків для дослідження. Сироватки від хворих на множинну мієлому виявилися відмінним джерелом високозбагаченого моноклонального імуноглобуліну, що забезпечило сировину для досліджень протягом наступних 20 з лишком років, що призвело до з'ясування структури імуноглобуліну.
Вправа\(\PageIndex{4}\)
Загалом, чого робить аналіз на імуноелектрофорез?
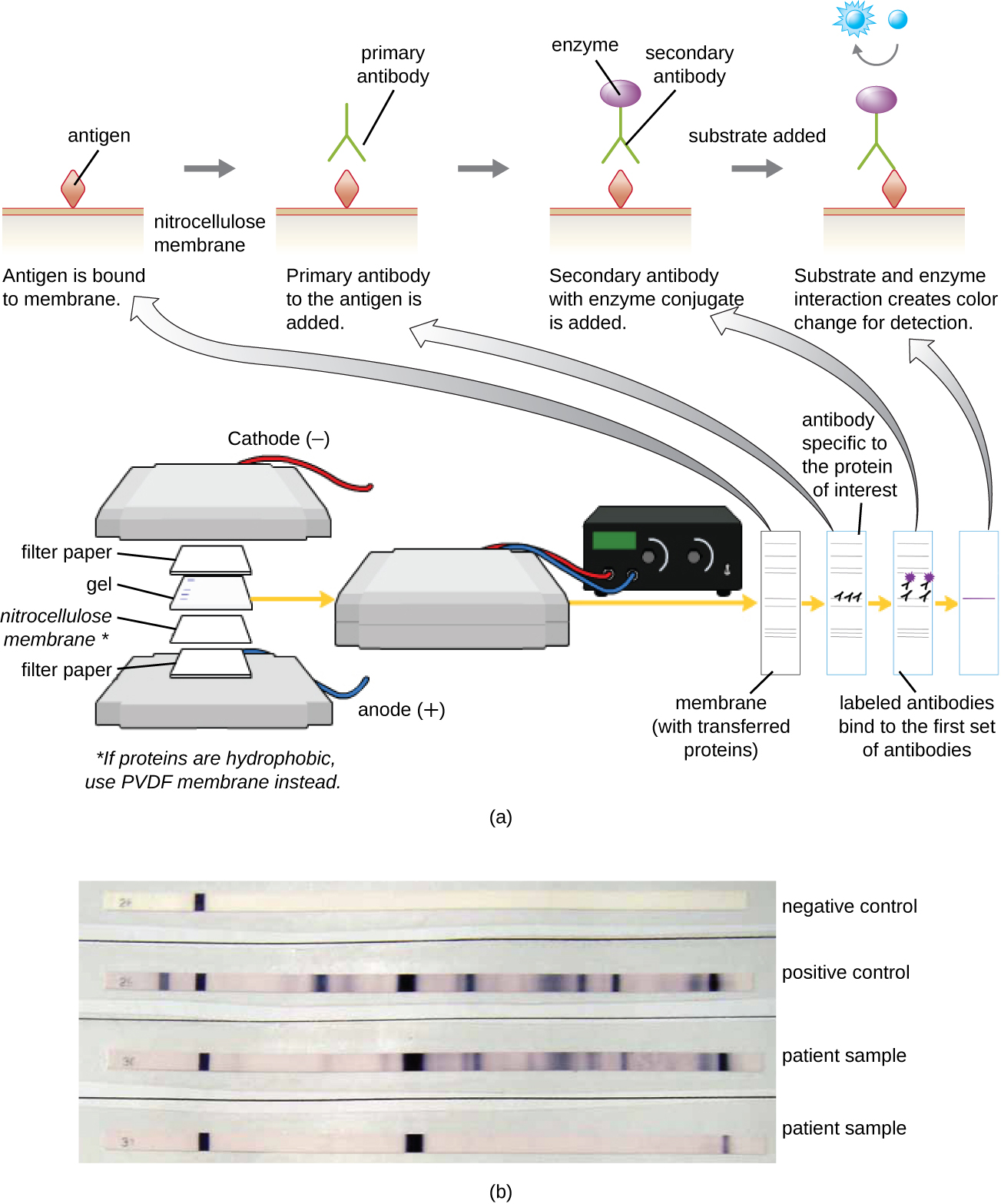
Імуноблот аналіз: Західний блот
Після виконання білкового гелю електрофорезу специфічні білки можуть бути ідентифіковані в гелі за допомогою антитіл. Ця методика відома як західна пляма. Після поділу білків PAGE білкові антигени в гелі переносяться і іммобілізуються на нітроцелюлозної мембрані. Потім ця мембрана може піддаватися впливу первинного антитіла, виробленого спеціально зв'язуватися з білком, що цікавить. Друге антитіло, забезпечене молекулярним маяком, потім зв'яжеться з першим. Ці вторинні антитіла з'єднані з іншою молекулою, такою як фермент або флюорофор (молекула, яка флуоресценція при збудженні світлом). При використанні антитіл, з'єднаних з ферментами, додається хромогенний субстрат для ферменту. Цей субстрат, як правило, безбарвний, але розвиває колір у присутності антитіла. Флуоресценція або забарвлення субстрату ідентифікує розташування специфічного білка в мембрані, до якої пов'язані антитіла (рис.\(\PageIndex{9}\)).
Як правило, поліклональні антитіла використовуються для аналізу вестерн-блот. Вони більш чутливі, ніж MAB через їх здатність зв'язуватися з різними епітопами первинного антигену, і сигнал від поліклональних антитіл, як правило, сильніший, ніж від MAB. Моноклональні антитіла також можуть бути використані; однак вони набагато дорожчі у виробництві і менш чутливі, оскільки вони здатні розпізнати лише один специфічний епітоп.
Кілька варіацій західного блота корисні в дослідженнях. У південно-західному блоті білки відокремлюються SDS-PAGE, промокають на нітроцелюлозну мембрану, дозволили ренатурувати, а потім зондують за допомогою флуоресцентно або радіоактивно маркованого ДНК зонда; метою південно-західного є виявлення специфічних взаємодій ДНК-білків. Далеко-західні блотипроводять для визначення білково-білкових взаємодій між іммобілізованими білками (розділеними SDS-PAGE, промокненими на нітроцелюлозної мембрані і дозволеними до ренатурування) і неантитіловими білковими зондами. Зв'язані білки без антитіл, які взаємодіють з іммобілізованими білками в далеко-західній плямі, можуть бути виявлені за допомогою радіомаркування, флуоресценції або використання антитіла з ферментативним молекулярним маяком.
Вправа\(\PageIndex{5}\)
Яка функція ферменту в аналізі імуноблот?
Комплемент-опосередкований імуноаналіз
Однією з ключових функцій антитіл є активація (фіксація) комплементу. Коли антитіла зв'язуються з бактеріями, наприклад, певні білки комплементу розпізнають пов'язане антитіло і активують каскад комплементу. У відповідь інші білки комплементу зв'язуються з бактеріями, де деякі служать опсонінами для підвищення ефективності фагоцитозу, а інші створюють отвори в грамнегативних бактеріальних клітинних мембранах, викликаючи лізис. Ця літична активність може бути використана для виявлення наявності антитіл проти специфічних антигенів в сироватці крові.
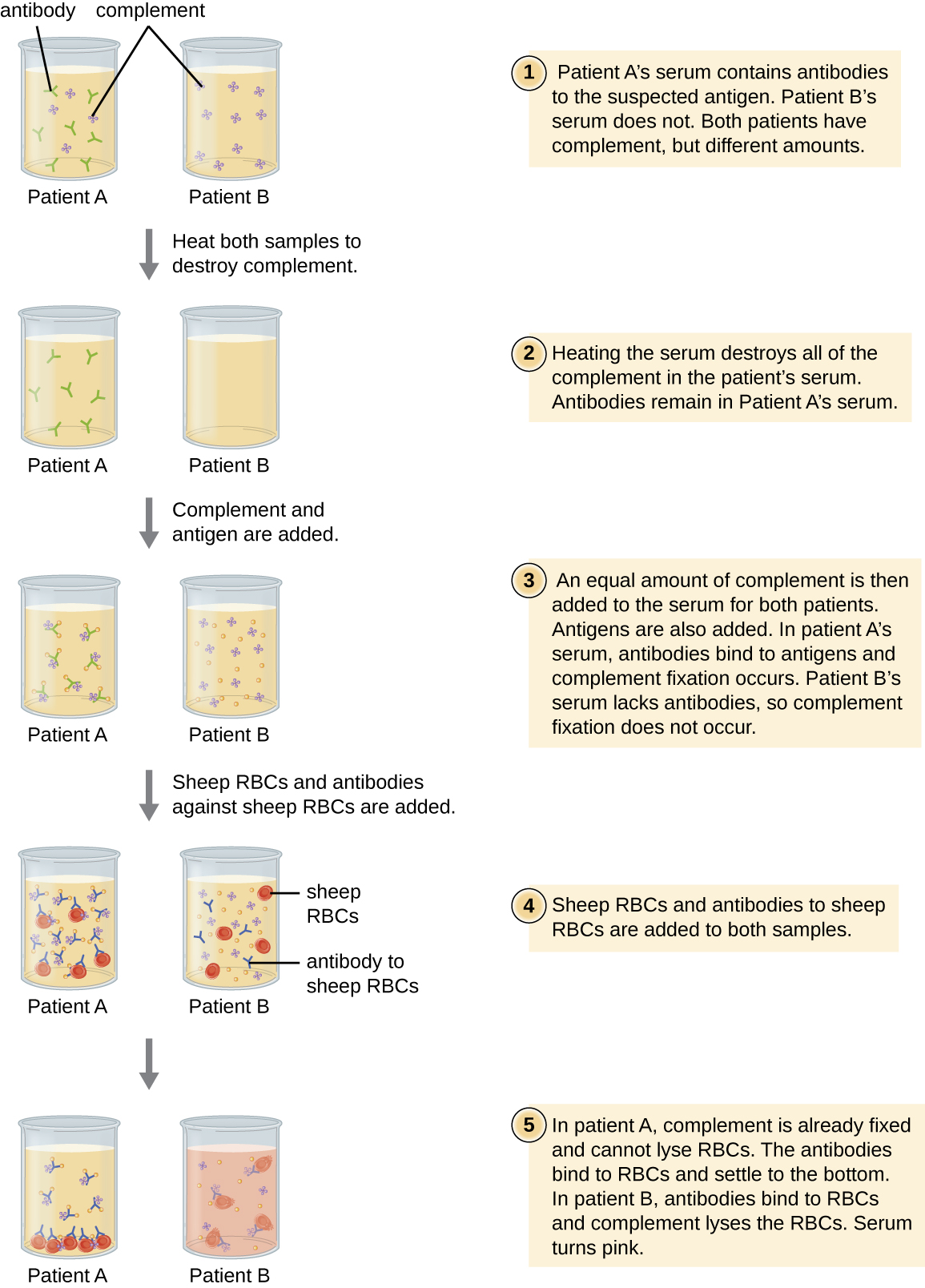
Еритроцити є хорошими індикаторними клітинами для використання при оцінці цитолізу, опосередкованого комплементом. Гемоліз еритроцитів виділяє гемоглобін, який є яскраво забарвленим пігментом, а гемоліз навіть невеликої кількості еритроцитів призведе до того, що розчин стане помітно рожевим (рис.\(\PageIndex{10}\)). Ця характеристика відіграє роль в тесті фіксації комплементу, що дозволяє виявити антитіла проти специфічних збудників. Тест на фіксацію комплементу може бути використаний для перевірки антитіл проти патогенів, які важко культивувати в лабораторії, таких як гриби, віруси або бактерії Хламідії.
Для виконання тесту на фіксацію комплементу в сироватку пацієнта додають антиген від збудника. Якщо антитіла до антигену присутні, антитіло зв'яже антиген і закріпить весь наявний комплемент. Коли еритроцити та антитіла проти еритроцитів згодом додаються до суміші, не залишиться комплементу для лізу еритроцитів. Таким чином, якщо розчин залишається прозорим, тест позитивний. Якщо в сироватці пацієнта немає антипатогенних антитіл, додані антитіла активують комплемент для лізування еритроцитів, даючи негативний тест (рис.\(\PageIndex{10}\)).
Перегляньте це відео, щоб побачити контур етапів тесту на фіксацію комплементу.
Вправа\(\PageIndex{6}\)
У тесті на фіксацію комплементу, якщо сироватка стає рожевою, чи є у пацієнта антитіла до антигену чи ні? Поясніть.
Таблиця\(\PageIndex{1}\) узагальнює різні типи аналізів на антитіло-антиген, розглянуті в цьому розділі.
| Тип аналізу | Механізм | Приклади |
|---|---|---|
| Опади | Антитіло зв'язується з розчинним антигеном, утворюючи видимий преципітин | Тест кільця Precipitin для візуалізації утворення решітки в розчині |
| Імуноелектрофорез для дослідження розподілу антигенів після електрофорезу | ||
| Аналіз Ouchterlony для порівняння різноманітних антигенів | ||
| Радіальний імунодиффузійний аналіз для кількісної оцінки антигенів | ||
| Флокуляція | Антитіла зв'язується з нерозчинними молекулами в суспензії, утворюючи видимі агрегати | VDRL-тест на сифіліс |
| Нейтралізація | Антитіла зв'язуються з вірусом, блокуючи потрапляння вірусу в клітини-мішені і запобігаючи утворенню бляшок | Аналіз зменшення зубного нальоту для виявлення наявності нейтралізуючих антитіл у сироватках пацієнта |
| Активація комплементу | Антитіла зв'язується з антигеном, викликаючи активацію комплементу і не залишаючи доповнення до лізу еритроцитів | Тест на фіксацію комплементу для антитіл пацієнта проти важко культивуваних бактерій, таких як хламідіоз |
Ключові поняття та резюме
- Коли вони присутні в правильному співвідношенні, антитіла та антиген утворюють преципітин або решітку, яка випадає з розчину.
- Для візуалізації формування решітки в розчині може бути використаний тест на препітінове кільце. Аналіз Ouchterlony демонструє утворення решітки в гелі. Променевий імунодифузійний аналіз використовується для кількісної оцінки антигену шляхом вимірювання розміру зони осадження в гелі, наповненому антитілами.
- Нерозчинні антигени в суспензії утворюватимуть флокулянти при зв'язуванні антитілами. Це основа тесту VDRL на сифіліс, при якому антитрепонемні антитіла зв'язуються з кардіоліпіном у суспензії.
- Вірусні інфекції можна виявити шляхом кількісної оцінки нейтралізуючих вірусів антитіл в сироватці пацієнта.
- Різні класи антитіл в плазмі або сироватці крові ідентифікуються за допомогою імуноелектрофорезу.
- Наявність специфічних антигенів (наприклад, бактеріальних або вірусних білків) у сироватці крові може бути продемонстровано за допомогою тестів Western blot, в яких білки переносяться на нітроцелюлозну мембрану та ідентифікуються за допомогою мічених антитіл.
- У тесті на фіксацію комплементу використовується комплемент для виявлення антитіл проти різних збудників.
Виноски
- 1 Ухтерлоні, Ерджан, «Метод in vitro для тестування здатності дифтерійних бактерій виробляти токсини», Acta Pathologica Microbiologica Scandinavica 26, № 4 (1949): 516-24.
- 2 Tiselius, Арне, «Електрофорез сироваткового глобуліну: електрофоретичний аналіз нормальних та імунних сироваток», біохімічний журнал 31, № 9 (1937): 1464.
- 3 Тіселій, Арне і Ельвін Кабат. «Електрофоретичне дослідження імунних сироваток та очищених препаратів антитіл», Журнал експериментальної медицини 69, № 1 (1939): 119-31.
