12.9: Імунотерапія раку
- Page ID
- 5150
Більшість хворих на рак лікуються деякою комбінацією хірургічного втручання, променевої та хіміотерапії. Променева та хіміотерапія мають недолік знищення здорових, а також злоякісних клітин і, таким чином, можуть спричинити серйозні побічні ефекти. Що потрібно, так це більш точно цілеспрямовані терапії. Одна давня мрія полягає в тому, щоб специфіка імунних механізмів могла бути використана проти пухлинних клітин. Це може використовувати власну імунну систему пацієнта або перенесення антитіл або Т-клітин із зовнішнього джерела (тобто пасивної імунізації). В ідеалі ці агенти були б орієнтовані на молекули, експресовані на ракові клітини, але не на здорові клітини. Однак такі пухлиноспецифічні антигени було важко знайти, і так багато імунних агентів, які зараз використовуються, також орієнтовані на здорові клітини.
імуностимулятори
Є значні докази того, що онкологічні хворі мають Т-клітини, які здатні атакувати їх пухлинні клітини. Насправді може бути, що поява раку - це збій імунного спостереження: здатність власної імунної системи знищувати ракові клітини, як тільки вони з'являються. Але що робити, якщо вони виходять з ладу? Імуностимулятори - це неспецифічні засоби, які налаштовують імунний захист організму. Були певні успіхи з
- введення ад'ювантоподібних засобів безпосередньо в пухлину. Єдине, кому вдається досить часто залишатися у використанні, це бактеріальний препарат БЦЖ. Введений в сечовий міхур, він може допомогти викорінити пухлини сечового міхура на ранній стадії.
- Пероральна терапія левамізолом, препаратом, широко використовуваним для дегельмінтизації (люди, а також тварини), був використаний для лікування різних видів раку, але з суперечливими результатами.
- інтерлейкін-2 (ІЛ-2), потужний фактор росту Т-клітин;
- альфа-інтерферон (IFN- α)
Терапія раку моноклональними антитілами
Ряд моноклональних антитіл виявляють обіцянку проти раку, особливо раку лейкоцитів (лейкози, лімфоми та множинна мієлома). Деякі приклади:
- Ритуксимаб (торгова назва = Рітуксан®). Використовується для лікування В-клітинних лімфом. Молекула CD20, з якою вона зв'язується, присутня на більшості В-клітин, здорових, а також злоякісних, але протягом місяців після лікування нові здорові В-клітини утворюються з попередників, які не мають CD20 і, таким чином, не були знищені лікуванням.
- Трастузумаб (торгова назва = Герцептин®). Зв'язує HER2, рецептор фактора росту, виявлений на деяких пухлинних клітині (деякі рак молочної залози, лімфоми). Єдиний моноклональний поки що, здається, ефективний проти солідних пухлин.
- Алемтузумаб (MAB Campath®). Зв'язується з CD52, молекулою, виявленою на лейкоцитах. Спровокував ремісію хронічного лімфолейкозу.
- Лайм-1 (Онколім®). Зв'язується з HLA-DR-кодованим антигеном гістосумісності, який може бути виражений на високих рівнях на клітині лімфоми.
- Бевацизумаб (Авастин®). Зв'язується з судинним ендотеліальним фактором росту (VEGF), тим самим блокуючи його дію і позбавляючи пухлину її кровопостачання.
- Цетуксимаб (Ербітукс®). Використовується для лікування колоректального раку.
- Моноклональне антитіло проти CD47. CD47 - це білок поверхні клітин, виражений на високих рівнях при багатьох різних ракових захворюваннях людини. CD47 блокує будь-які зусилля, які макрофаги та дендритні клітини можуть зробити для фагоцитози ракових клітин; тобто CD47 - це сигнал «не їж мене». Різноманітні види раку людини, пересаджені імунодефіцитним мишам, пригнічують ріст і запобігають метастази, коли мишам дають моноклональне антитіло проти CD47, тим самим розкриваючи здатність фагоцитів руйнувати ракові клітини. Успіх у мишей незабаром призведе до клінічних випробувань на людях.
- Іпілімумаб (Єрвой®). На відміну від інших перерахованих тут моноклоналів, іпілімумаб діє як імуностимулятор. Це робиться шляхом зв'язування з молекулами CTLA-4 на Т-клітині, щоб вони не могли зв'язуватися з молекулами B7 на антигенпрезентуючій клітині. Це звільняє молекули CD28 Т-клітини для зв'язування B7, отримуючи стимулюючий «сигнал 2" від антигенпрезентуючої клітини. Ipilimumab був схвалений Управлінням з контролю за продуктами і ліками США 25 березня 2011 для використання проти метастатичної меланоми. Оскільки його подвійний негативний ефект працює для посилення загальних реакцій Т-клітин організму, він цілком може виявитися корисним і проти інших видів раку (і пояснює деякі аутоімунні побічні ефекти, які він виробляє). Він також дає, мабуть, найкращі докази існування імунного спостереження; тобто наявність в організмі пацієнта вродженої популяції Т-клітин, специфічних для пухлини.
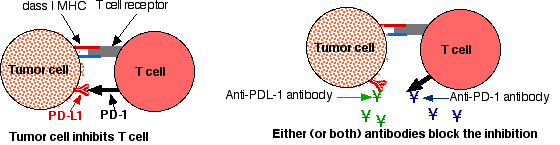
- Пембролізумаб і ніволумаб
- Блінатумомаб - синтетичне моноклональне антитіло, кожне плече якого несе в собі місце зв'язування з різною специфікою:
- одна рука зв'язується з CD19, антигеном, виявленим на поверхні В-клітин і В-клітинних лімфом
- інша рука зв'язується з CD3, молекулою поверхні клітини на Т-клітинами, включаючи цитотоксичні Т-лімфоцити (CTL)
Утворюючи міст між CD3 і CD19, блінатумомаб здатний прикріплювати Т-клітини до В-клітин і активувати Т-клітини, щоб вбити В-клітини. Ранні клінічні випробування з блінатумомабом на невеликій кількості пацієнтів виявляються досить перспективними. Скромні дози препарату виробляють частковий і, в декількох випадках, повний регрес їх лімфоми.
імунотоксини
Основною проблемою хіміотерапії є пошкодження ліків завдають усім тканинам, де відбувається швидке поділ клітин. Потрібна «чарівна куля», спосіб доставки цитотоксичного препарату безпосередньо і конкретно до пухлинних клітин, щадячи здорові клітини. Така чарівна куля мала б дві частини - моноклональне антитіло, специфічне для ракової клітини, прикріплене до цитотоксичного препарату або токсину, який вбиває клітину, як тільки вона потрапляє всередину.
Близько двох десятків імунотоксинів знаходяться в клінічних випробуваннях. Два, які вже отримали схвалення FDA:
- Адцетріс®. Ведотин прикріплюється до моноклонального антитіла мостом, який розщеплюється після того, як кон'югат безпечно знаходиться всередині пухлинної клітини, вивільняючи токсин, щоб виконувати там свою роботу. В одному дослідженні 73% пацієнтів з лімфомою Ходжкіна перейшли в ремісію.
- моноклональне антитіло, яке зв'язує CD30, молекула поверхні клітини, виражена клітинами деяких лімфом, але не знайдена на нормальних стовбурових клітині, необхідних для повторного заселення кісткового мозку.
- ведотин, препарат, який блокує мітоз, запобігаючи полімеризації тубуліну (необхідного для формування мітотичного веретена).
- Kadcyla® DM1 прикріплюється до моноклонального антитіла мостом, який розщеплюється після того, як кон'югат безпечно знаходиться всередині пухлинної клітини, вивільняючи токсин, щоб виконувати свою роботу там. Кадцила® продовжує виживання у жінок, у яких рак молочної залози надмірно виражає HER2 (близько 20% випадків раку молочної залози).
- Трастузумаб (Герцептин®), моноклональні антитіла проти HER2, перераховані вище;
- DM1, ще один препарат, який пригнічує мітоз, запобігаючи полімеризації тубуліну (необхідного для формування мітотичного веретена).
Променева імунотерапія
Моноклональні антитіла проти пухлинних антигенів також можуть бути пов'язані з радіоактивними атомами. Мета цих агентів - обмежити руйнівну силу випромінювання тими клітинами (раковими), які були «пальцями» прикріпленим моноклональним антитілом. Приклади:
- Зевалін®. Це моноклональне антитіло проти молекули CD20 на В-клітині (і лімфомах), кон'югованих з будь-яким
- радіоактивний ізотоп індій-111 (111 В) або
- радіоактивний ізотоп ітрій-90 (90 Y)
- Бексар® (тосітумомаб). Це кон'югат моноклонального антитіла проти CD20 і радіоактивного ізотопу йоду-131 (131 I). Він теж призначений для лікування лімфоми. Хоча і Bexxar®, і Zevalin® вбивають нормальні В-клітини, вони не завдають шкоди попередникам В-клітин, оскільки вони не виражають CD20. Так, з часом провісники можуть заново заселити організм здоровими В-клітинами.
На 3 Лютий 2005, New England Journal of Medicine повідомили, що 59% пацієнтів з В-клітинної лімфомою були без хвороб 5 років після одного лікування з 131 i-tositumomab (лікування, яке було відносно вільним від неприємних побічних ефектів, наприклад, випадання волосся, звичайних хіміотерапії).
Приймальна клітинна терапія (ACT)
Знищення пухлини проводиться клітинами. Антитіла можуть допомогти, але лише шляхом ідентифікації клітин, які потрібно знищити, наприклад, макрофагами. Але Т-клітини, наприклад, цитотоксичні Т-лімфоцити (CTL), призначені для знищення клітин-мішеней. А як щодо того, щоб залучити їх до боротьби?
Пухлино-інфільтруючі лімфоцити (ТІЛ)
Солідні пухлини містять лімфоцити, специфічні для антигенів, виражених пухлиною. Протягом багатьох років Стівен Розенберг та його соратники з Національного інституту раку США намагалися залучити ці клітини в терапію раку.
19 вересня 2002 року він повідомив про свої найбільш перспективні на той момент результати. Процедура:
- Ізолювати Т-клітини — як CD4+ Т-хелперні клітини, так і CD8+ цитотоксичні Т-лімфоцити (CTL) із зразків пухлини (меланоми)
- Перевірте їх in vitro, щоб знайти найбільш ефективних вбивць клітин меланоми.
- Вирощують їх велику кількість в культурі (використовуючи потужний Т-клітинний фактор росту ІЛ-2).
- Лікуйте пацієнта скромними дозами цитотоксичних препаратів, щоб зменшити - але не руйнувати - кістковий мозок (званий немієлоабляційний кондиціонування).
- Повторно ввести суміш клітин Th (CD4 +) і CTL (CD8 +) пацієнту (разом з IL-2).
Результати:
- Наполягали клітини зазвичай займали тривале проживання.
- У 10 з 13 пацієнтів їх клітини меланоми, включаючи всі метастази, регресували або частково, або повністю.
У кількох випадках ТІЛ, здавалося, реагував на пухлиноспецифічні антигени, але в більшості мішенню, здається, були антигени, виражені всіма клітинами, що містять меланін. Докази:
- Чотири пацієнти втратили нормальні меланоцити зі шкіри, залишаючи білі плями.
- У одного пацієнта розвинулося запалення увеи, оболонки меланінсодержащих клітин всередині ока.
Адоптивний перенос клону власних пухлино-антиген-специфічних Т-клітин пацієнта
У 19 червня 2008 року випуск New England Journal of Medicine (Naomi Hunder et al) провів звіт, що описує успішне лікування людини з метастазірованою меланомою за допомогою власних Т-клітин. Процедура:
- Його лейкоцити збирали і готували змішану культуру, що містить
- антигенпрезентуючі дендритні клітини.
- пептид з антигену NY-ESO-1. NY-ESO-1 - це білок, який виробляється кількома типами пухлин (наприклад, меланома, рак легенів та молочної залози), але не виражається нормальними клітинами (крім тих, що знаходяться в яєчку).
- Власні Т-клітини пацієнта.
- Після повторної стимуляції антигеном реагуючі клітини клонували шляхом обмеження розведення.
- Одну (з чотирьох) антиген-реактивних клітин потім розширювали в культурі до
- 5 мільярдів (5 х 10 9) ідентичних анти-NY-ESO-1 CD4+ Т-клітин були доступні для вливання пацієнту.
Результат: повна регресія кожного метастатичного скупчення клітин меланоми, і пацієнт залишається вільним від цього летального раку протягом двох років з моменту цього лікування.
Прийняття перенесення генетично модифікованих Т-клітин
Генетично інженерний з Т-клітинним рецептором
20 квітня 2006 року група Розенберга повідомила про певний успіх у пацієнтів з меланомою, використовуючи модифікацію процедури TIL.
- Т-клітини пацієнта видаляли та лікували ретровірусним вектором, що містить рецептор αβ Т-клітин (TCR), специфічний для антигену меланоми.
- Велика їх кількість вирощувалася в культурі.
- Після немієлоабляційного кондиціонування, щоб «звільнити місце» для них, генетично модифіковані лімфоцити були влиті пацієнту.
- Таке застосування генної терапії дозволило усунути метастази і забезпечити безперебійний період двох років у двох пацієнтів.
Генетично інженерний з рецептором химерного антигену (CAR)
The 10 Серпень 2011 онлайн версія Нової Англії Журнал медицини здійснив доповідь Портера, Д., і ін. за їх результатами з одним (з трьох) пацієнтів, які лікувалися від хронічного лімфолейкозу (ХЛЛ) інфузією власних генетично модифікованих Т-клітин.
Злоякісні В-клітини пацієнта виражали поверхневий антиген CD19 так само, як це роблять нормальні В-клітини.
Т-клітини збирали з його крові і пізніше обробляли вектором, що кодує антигензв'язуючий сайт антитіла проти CD19 разом з двома іншими костимулюючими молекулами. Результат: близько 5% цих Т-клітин експресували це синтетичне антитіло (зване рецептором химерного антигену або CAR) і були активовані, коли вони зв'язували CD19 з ним (а не зі своїм Т-клітинним рецептором (TCR), який вони зазвичай використовували).
Введені назад пацієнту, вони розросталися приблизно в 1000 разів і зберігалися місяцями. За цей період вони усунули всі його злоякісні В-клітини (а також його нормальні В-клітини). На момент доповіді (через 10 місяців після лікування) він продовжував бути вільним від раку. Не маючи нормальних В-клітин, він потребував періодичних вливань імунного глобуліну, щоб тримати інфекції в страху.
«Одна ластівка не робить літа», але ці результати дають надію, що з часом імунотерапія стане ефективною зброєю проти раку.
Вакцини проти раку
Будь-яка реакція власної імунної системи пацієнта - імунний нагляд - явно зазнала невдачі у хворих на рак. Мета вакцин проти раку - викликати у пацієнта більш потужний активний імунітет. Досліджується кілька підходів.
Вакцини проти раку, специфічні для пацієнта
Специфічні для пацієнта дендритно-клітинні вакцини
Дендритні клітини є найбільш потужними антигенпрезентуючими клітинами. Вони поглинають антиген, переробляють його в пептиди і «представляють» їх Т-клітинам.
Щоб зробити дендритно-клітинну вакцину,
- Збирають дендритні клітини у пацієнта.
- Піддавати їх in vitro антигенам, пов'язаним з типом пухлини у пацієнта.
- Антигени знаходяться в нормальних - а також ракових - клітиках цієї тканини (наприклад, тирозиназа в меланоцитах, фосфатаза передміхурової залози [PAP] в клітині передміхурової залози).
- Вони можуть бути злиті зі стимулюючою молекулою, такою як колонієстимулюючий фактор гранулоцит-макрофагів (GM-CSF)
- Ввести ці «імпульсні» дендритні клітини назад пацієнту.
- Сподіваюся, що вони викликають сильну клітинну імунну відповідь, наприклад, цитотоксичними Т-лімфоцитами (CTL).
29 квітня 2010 року Управління з контролю за продуктами та ліками США схвалило першу протиракову вакцину: специфічну для пацієнта дендритну клітинну вакцину для використання проти запущеного раку передміхурової залози. Вакцина, яка називається Sipuleucel-T (Provenge®), виробляється шляхом пульсування дендритних клітин пацієнта злитим протеїном, що зв'язує фосфатазу простатичної кислоти [PAP] з GM-CSF.
Специфічні для пацієнта вакцини проти пухлинного антигену
Антигени в цих вакцини беруться з власних пухлинних клітин пацієнта.
- Збирають деякі пухлинні клітини у пацієнта.
- Відправте їх в компанію, яка буде використовувати їх для виготовлення комплексів з ад'ювантними матеріалами.
- Комплекси повертаються для введення пацієнту.
Кілька таких вакцин в даний час знаходяться в клінічних випробуваннях.
Вакцини, специфічні для пухлини
Ці вакцини використовуються для імунізації пацієнта антигеном, універсально вираженим пухлинами такого типу (але не нормальними клітинами), змішаним з деякою формою ад'юванту, що посилить реакцію.
Приклади:
- Багато хворих на рак встановлюють імунну відповідь - як опосередкований антитілами, так і клітинно-опосередкований - проти пухлини (і яєчка) антигену NY-ESO-1. Навмисна імунізація цим білком (плюс ад'ювант) підсилює цю реакцію і показала певну обіцянку на ранніх клінічних випробуваннях. (Клітини яєчка не експресують HLA-антигени, тому не піддаються ризику нападу NY-ESO-1-специфічних цитотоксичних Т-лімфоцитів).
- MAGE-A3 - ще один білок, поширений на ракових клітині. Вакцина з використанням MAGE-A3 - разом з ад'ювантом - знаходиться в клінічних випробуваннях фази III для оцінки її ефективності проти меланоми та раку легенів.
- HER2 - це білок, надмірно виражений на 20— 30% раку молочної залози. NeuVAx® - це вакцина, яка містить пептид HER2 разом з рекомбінантним GM-CSF як ад'ювант. Він стимулює утворення цитотоксичних Т-лімфоцитів (CTL), які атакують клітини, що експресують HER2, і показали перспективність у клінічних випробуваннях.
На відміну від специфічних для пацієнта вакцин, ці вакцини можуть бути масово виготовлені для використання у всіх, хто має відповідну пухлину.
Поєднання процедур #3 і #4
У той час як пухлини є імуногенними у пацієнта, який їх переносить, вони лише слабо. У надії покращити імунотерапію раку зараз продовжуються клінічні випробування для перевірки ефективності поєднання потужної імунізації раку, специфічної для пацієнта, з лікуванням пацієнта великою кількістю культивованих ракових антиген-специфічних Т-клітин, що призводить.
Пацієнту багаторазово імунізують власними раковими клітинами разом із сильним ад'ювантом (наприклад, GM-CSF) з подальшим збором лейкоцитів пацієнта та збільшенням їх великої кількості в лабораторії перед введенням їх у пацієнта разом з інтерлейкіну-2. Цей комбінований підхід - який генерує велику кількість клітин Т-кілерів, специфічних для пацієнта, - був протестований проти раку нирок та одного типу мозку з багатообіцяючими результатами.
Рак крові
Ракові захворювання клітин крові, лейкози і лімфоми, виникають в кістковому мозку — джерелі всіх клітин крові.
Одним із підходів до лікування лейкемії є лікування пацієнта такими високими дозами хіміотерапії та опромінення, що не тільки вбивають лейкозні клітини, але і руйнують кістковий мозок пацієнта. Якщо пацієнту належить пережити лікування, яке називається «мієлоаблятивним кондиціонуванням», йому необхідно зробити пересадку гемопоетичних стовбурових клітин — клітин, з яких утворюються всі клітини крові.
Стовбурові клітини можуть бути
- автотрансплантат; тобто з кісткового мозку, зібраного у пацієнта і зберігається до початку лікування. Однак у цьому випадку мозок також потрібно лікувати, щоб очистити його від усіх ракових клітин, які він може містити, перш ніж його повернути пацієнту. Це іноді не вдається.
- алло трансплантат; тобто клітини, зібрані від іншої людини, як правило, член сім'ї, що розділяє ті ж основні молекули гістосумісності.
Аллотрансплантовані гемопоетичні стовбурові клітини також іноді не піддаються лікуванню, але в цьому випадку це відбувається тому, що не всі лейкемічні клітини пацієнта були знищені. Однак інфузія Т-лімфоцитів з крові того ж донора, який забезпечив клітини, може закінчити роботу.
Цей ефект називається ефектом трансплантата проти лейкемії.
Однак більшість (якщо не всі) донорських Т-клітин, ймовірно, атакують нормальні молекули поверхні клітин, а не пухлиноспецифічні. (Навіть якщо донор і реципієнт збігаються з основними молекулами гістосумісності, будуть незначні, які викликають реакцію відторгнення.)
Таким чином, пацієнт також може страждати небезпечною для життя хворобою трансплантата проти господаря (ГВВГ).
Ефект трансплантату проти лейкемії закладає основу для підходу, який показав значну перспективу проти різних видів раку крові та навіть деяких твердих (наприклад, нирок) пухлин.
- Пацієнта лікують, щоб вбити деякі - але не всі - клітини кісткового мозку (немієлоабляційне кондиціонування).
- Замість використання високих доз опромінення на весь організм і хіміотерапії опромінюються тільки лімфоїдні органи (селезінка, тимус, лімфатичні вузли) (називається «тотальне лімфоїдне опромінення»).
- Також можна давати антитімоцитарний глобулін.
- Незважаючи на те, що це залишає деякі ракові клітини, це дає можливість алогенним стовбуровим клітинам кісткового мозку довго проживати у реципієнта (так само, як імуносупресія дозволяє трансплантувати нирки тощо, щоб уникнути відторгнення реципієнтом).
- Далі слід інфузія Т-клітин від того ж донора. Потім вони можуть працювати проти ракових клітин, не загрожуючи відторгненням господаря.
- Ще раз, однак, вони також атакують нормальні клітини реципієнта, які зазвичай викликають хворобу трансплантата проти господаря (GVHD). Однак це обіцяє бути більш м'яким, ніж після мієлоабляційного кондиціонування - можливо, тому, що повторювані малі дози радіації сприяють виживанню природних клітин вбивць (NK), і вони, здається, захищають від GVHD.
У мишей ефект трансплантата проти лейкемії можна насолоджуватися без зворотного боку GVHD, включаючи надзвичайно велику кількість регуляторних Т-клітин (клітини Treg) в інфузію кісткового мозку. Чи може цей підхід бути корисним для людей, залишається з'ясувати.
Віротерапія
Давно відомо, що вірусні інфекції можуть зрідка (і непередбачувано) викликати регрес пухлин. Ряд вірусів вивчено в надії розробити надійну терапію. 27 жовтня 2015 року FDA США затвердив T-VEC (Imlygic®) для лікування меланоми. T-VEC - це мутований та інженерний вірус простого герпесу (ВПГ-1 — причина герпесу). Зміни вірусу включають включення гена для GM-CSF та мутацію, яка запобігає зараженню вірусом не діляться клітин, зберігаючи при цьому його здатність інфікувати та відтворюватися в ракових клітині. Реплікація вбиває клітини і змушує їх вивільняти:
- більше вірусів, які поширюють інфекцію;
- пухлинні антигени, і
- GM-CSF, який притягує дендритні клітини до ділянки. Вони беруть пухлинні антигени і представляють їх Т-клітинам, які продовжують монтувати атаку проти вижили пухлинних клітин.
(Смерть пухлинних клітин від ВПГ не кваліфікує її як імунотерапію, але реакція Т-клітин, яка призводить, безумовно, робить.)
