5: Алкени і Алкіни
- Page ID
- 25250
Коли вуглець пов'язаний з одним або декількома електронегативними атомами, він приймає частковий позитивний заряд і є електрофільним. Такі електрофільні вуглеці можуть піддаватися реакціям нуклеофільної заміщення або елімінації, або обидва, залежно від структур реагуючих молекул, сили нуклеофіла та типу розчинника, в якому відбувається реакція. Тепер перейдемо до реакцій, які можуть зазнати багаті електронами види вуглецю.
Алкени і алкіни.
І алкени, і алкіни є «ненасиченими», а це означає, що вони містять подвійні або потрійні вуглецево-вуглецеві зв'язки. Термін ненасичений походить від того, що до цих молекул можна додати більше\(\mathrm{H}\) атомів через подвійні або потрійні зв'язки. Простий алкен містить пару вуглеців, пов'язаних подвійним зв'язком; цей подвійний зв'язок складається з сигма-зв'язку та pi зв'язку. Сигма-зв'язок утворена наскрізним перекриттям\(\mathrm{sp}^{2}\) гібридних орбіталів, а pi зв'язок - перекриттям з боку в бік p орбіталів. Пі зв'язок має дві частки електронної щільності вище і нижче площини молекули. Існує ряд наслідків такого розташування:
- отримана область молекули плоска (кажуть, що молекула має тригональну планарну геометрію),
- електронна щільність між двома вуглецями висока, оскільки в цій області є чотири електрони замість двох, і
- обертання навколо подвійного зв'язку обмежено (на відміну від обертання навколо одного зв'язку).
Обертання навколо подвійного зв'язку вимагає порушення перекриття pi зв'язку і її подальшої реформування. Як і у всіх явищах, що розривають облігації, крок розриву облігацій вимагає енергії; насправді значно більше енергії, ніж потрібно для обертання навколо одного зв'язку, де не відбувається розриву облігацій. Як ми побачимо, ці три фактори мають помітний вплив на поведінку алкенів.
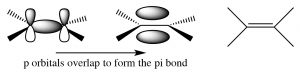
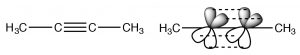
Алкіни - це сполуки, які містять потрійні зв'язки. Потрійний зв'язок складається з однієї сигма-зв'язку, утвореної з наскрізного перекриття sp-гібридних орбіталей і двох pi зв'язків, утворених з боку в бік перекриття. Вуглеці\(\mathrm{sp}\) -гібридизовані, а молекула лінійна в області потрійного зв'язку; знову обертання навколо потрійного зв'язку обмежене - два pi зв'язки повинні бути розірвані, щоб це відбулося (що вимагає введення енергії). Це розташування зв'язку призводить до дуже багатій електронами\(\mathrm{C-C}\) області з сигма-зв'язком всередині того, що виглядає як циліндр pi електронної щільності.
Неймінг Алкени
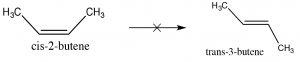
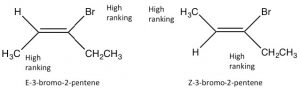
Оскільки алкени мають обмежене обертання навколо\(\mathrm{C=C}\) групи, вони можуть існувати як стереоізомери. Наприклад, в 2-бутені є метил і пов'язаний з кожним з подвійних зв'язків вуглецю (вуглець 2 і 3 молекули).\(\mathrm{H}\) Оскільки\(\mathrm{C=C}\) група є плоскою,\(\mathrm{CH}_{3}\) групи можуть бути або на одній («цис»), або протилежній («транс») сторонам подвійного зв'язку (\(\rightarrow\)); ця цис/транс-номенклатура подібна до тієї, яку ми використовували з циклогексановими кільцями. Оскільки групи, прикріплені до кожного вуглецю, ускладнюються, така номенклатура швидко збиває з пантелику. Щоб впоратися, звернемося до іншої встановленої схеми іменування; в цьому випадку конвенція Чан-Інгольд-Прелог ми раніше використовували з хіральними центрами. Це передбачає ранжування груп, пов'язаних з кожним вуглецем подвійного зв'язку. Якщо високі групи знаходяться разом (одна сторона), ім'я префіксується Z (від німецького слова для together: zusammen). Якщо вони знаходяться з протилежних сторін, вони маркуються E (entgegen; геть). Ізомери E та Z - це діастереоізомери: вони мають однакову зв'язок, але жоден з них не може накладатися на його дзеркальне відображення. У Е-3-бром-2-пентену\(\mathrm{CH}_{2} \mathrm{CH}_{3}\) групи\(\mathrm{CH}_{3}\) і ближче один до одного, ніж у Z-3-бром-2-пентену; в результаті вони мають різні фізико-хімічні властивості. Ці відмінності дозволяють відокремити ізомери E і Z (і цис/транс, оскільки вони є лише окремим випадком E/Z) один від одного.
Стійкість алкенів:
Реакції елімінації, які виробляють алкени, як правило, сприяють найбільш заміщеному алкену як основного продукту. Відносну стабільність різних алкенів можна визначити, реагуючи алкен з воднем і визначаючи зміну ентальпії (\(\Delta \mathrm{H}\)).
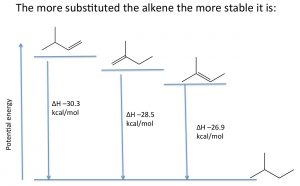
Наприклад, показано (\(\rightarrow\)), три різних алкени виробляють один і той же продукт, і тому відмінності в енергії, що виділяється, повинні виникати через те, що початкові алкени мають різні енергії. Чим більше алкільних груп прикріплено до подвійного зв'язку, тим стабільніше (менш реактивний) алкен, і тому виділяється менша кількість енергії. Молекулярна стабільність в алкенах пояснюється тими ж причинами, що і відносна стабільність карбокатіонів; алкільні групи стабілізують pi зв'язок шляхом гіперкон'югації та індукції.
