5.4: Окислення алкенів
- Page ID
- 25295
Існують різноманітні реагенти, які можуть призвести до окислення (тобто додавання кисню до обох вуглеців) алкену. [3] Ці реакції є синтетично корисними, оскільки вони дозволяють розміщувати функціональні групи на сусідніх вуглецях, і ці групи згодом можуть бути змінені. Реагенти, що використовуються в цих реакціях перетворення, є високоактивними, і більшість включають види з високим ступенем окислення, такі як перманганат (\(\mathrm{MnO}_{4}{ }^{-}\)) і або тетроксид осмію (\(\mathrm{OsO}_{4}\)), або містять нестабільні киснево-кисневі зв'язки (наприклад, озон\(\mathrm{O}_{3}\)) або перокси-кислота (див. Нижче). Загальним фактором цих реагентів є те, що вони здатні різними способами додавати кисень до\(\mathrm{C=C}\) зв'язку. Багато з результуючих реакцій досить складні, і ми не будемо вникати в їх механістичні деталі, крім випадків, коли це необхідно: наприклад, пояснити, чому виробляється та чи інша стереохімія.
Епоксидування:
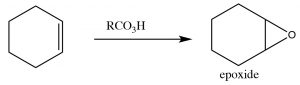
Епоксиди (також відомі як оксирани) (\(\rightarrow\)) - це тричленні кільцеві ефіри, і можуть утворюватися в результаті реакції алкену з пер-кислотою, тобто карбоновою кислотою з додатковим киснем (\(\leftarrow\)). Реакція відбувається за допомогою узгодженого (скоординованого) руху електронів. Результатом є те, що обидва вуглеці в початковому подвійному зв'язку в кінцевому підсумку пов'язані з одним і тим же\(\mathrm{O}\) атомом.
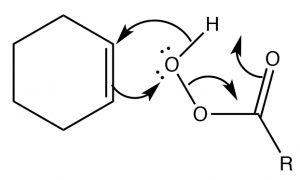
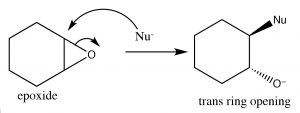
Нагадаємо, що раніше ми розглядали відносну стійкість кілець, і з'ясували, що їх стійкість залежить від розміру кільця і крутильного (затемнюючого) деформації. Вуглецеве кільце з трьома членами сильно напружене, оскільки кути зв'язку спотворюються від\(109^{\circ}\) кута, до якого вимагає\(\mathrm{sp}^{3}\) гібридизація; крім того, всі зв'язки затьмарюються. Результатом є те, що епоксиди схильні до нуклеофільної атаки при кільцевому вуглецевому (\(\rightarrow\)). \(\mathrm{S}_{\mathrm{N}} 2\)Реакція, яка протікає через атаку з тильного боку кільця, що призводить до виробництва транс-продукту. Такі реакції відкриття кільця можуть бути досягнуті цілим рядом нуклеофілів, включаючи воду. Реакція з водою призводить до транс-діолу. Загалом, за \(\mathrm{S}_{\mathrm{N}} 2\)умов відкриття кільця також є стереоспецифічним - тобто нуклеофіл буде атакувати найменш перешкоджений вуглець (\(\downarrow\)).
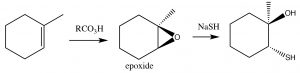
Епоксиди, як правило, реактивні, і з цієї причини можуть бути корисними як синтетичні проміжні продукти. У біологічних системах їх реактивність може призвести до хімічної модифікації ДНК, що призводить до мутацій (з цієї причини багато хто відомий як геноксичні або токсичні для генома). В якості захисту від таких епоксидів організми кодують ферменти, відомі як епоксидні гідролізи. [4]
CIS-діоли:
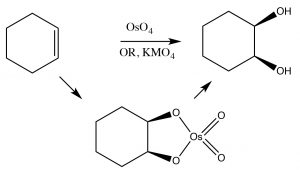
Алкени можуть бути окислені для отримання цис-діолів, використовуючи інший тип реагенту, який додає атоми через подвійний зв'язок через циклічний проміжний продукт. Наприклад, перманганат (\(\mathrm{MnO}_{4}{ }^{-}\)) і тетроксид осмію (\(\mathrm{OsO}_{4}\)), обидва з яких містять перехідні метали в станах високого окислення, можуть здійснити це перетворення (\(\rightarrow\)). Варто зазначити, що контролюючи умови реакції, ми можемо вибрати виробництво цис або транс-діолів. Коли ми перейдемо до більш складної органічної хімії, ми побачимо, що здатність вибирати та прогнозувати результати є основним компонентом органічної хімії.
Озоліз:
Інший тип окислення подвійного зв'язку алкенів передбачає реакцію з озоном (\(\mathrm{O}_{3}\)), високореактивним алотропом кисню. [5] Механізм досить складний, як показано нижче (не потрібно його запам'ятовувати!).
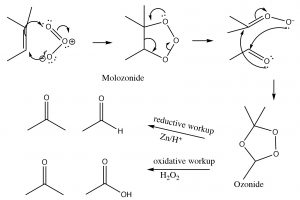
Зазвичай озон розщеплює подвійний зв'язок і реакція обробляється м'яким відновником, таким як олово (\(\mathrm{Sn}\)) [6], що призводить до отримання відповідних альдегідів або кетонів (\(\downarrow\)).
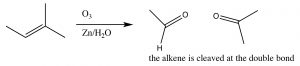
Як ми побачимо пізніше, реакція озонолізу може бути корисною для виявлення положення подвійного зв'язку всередині молекули, а також при синтезі альдегідів і кетонів.
