5.5: Реакції алкінів
- Page ID
- 25282
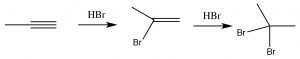
Як ви могли передбачити, алкіни часто поводяться подібно до алкенів. Потрійні зв'язані вуглеці - це багата на електрони область молекули, і ми очікуємо, що вони піддаватимуться електрофільному додаванню, подібно до алкенів. Так, наприклад, ми бачимо додавання Марковикова через потрійний зв'язок з\(\mathrm{HBr}\) (\(\rightarrow\)), єдина різниця полягає в тому, що якщо надлишок\(\mathrm{HBr}\) присутній, буде додано два, а не один - атом брому; по одному до кожного з спочатку потрійних зв'язків вуглецю. Інші реагенти поводяться подібним чином. Наприклад,\(\mathrm{Br}_{2}\) буде також додати через потрійний зв'язок, щоб дати спочатку дібромо, а потім з'єднання тетрабромо.
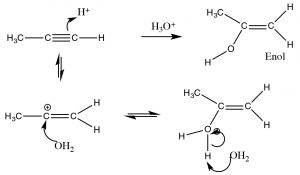
На відміну від цього, коли вода додається через потрійний зв'язок, ми знаходимо дещо інший результат. Хоча початкові кроки однакові: електрофіл (\(\mathrm{H}^{+}\)) додає до найменш заміщеного вуглецю, а нуклеофіл (\(\mathrm{H}_{2}\mathrm{O}\)) додає до виробленого карбокату. Це створює новий функціонал під назвою енол (комбінація алкового вену та спиртового масла). Зараз енол переживає те, що відомо як таутомерія: протон із спиртового фрагмента видаляється (водою як основа), а інший протон підхоплюється на алкеновому\(\mathrm{CH}_{2}\) вуглеці (\(\rightarrow\)). Як ми бачили багато разів, перш ніж цей тип реакції протонації/депротонації відбувається легко або на кисні, або на азоті, але це перший раз, коли ми бачили це на вуглеці; кето-енол таутомерія є важливою частиною реакцій карбонільних груп.
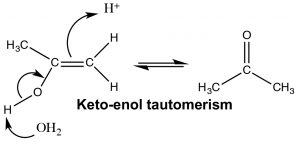
Кето-форми та енолу, здається, є різними сполуками, і ми можемо спокуситися класифікувати їх як структурні ізомери, але це не так. Кето- і енол- форми завжди існують в рівновазі один з одним, і хоча ми зазвичай пишемо структуру з карбонільною групою (кето-формою), завжди присутня невелика кількість енолової форми. Перехід між кето- і енол- формами нуклеотидних основ спочатку плутав Уотсона і Крика в їх моделюванні структури ДНК. [7]
Зменшення алкінів:
Додавання водню (\(\mathrm{H}_{2}\)) до алкінів може бути здійснено декількома способами. Повністю зменшити алкін до відповідного повністю насиченого алкану можна за рахунок додавання двох\(\mathrm{H}_{2}\) молекул. Насправді, при використанні каталізаторів, таких як\(\mathrm{Pd}\) (паладій) або\(\mathrm{Pt}\) (платина), реакція не може бути зупинена на проміжній стадії алкену. Існують, однак, спеціалізовані каталізатори, які дозволяють часткове гідрування алкену. Один з них відомий як каталізатор Ліндлара, який є менш ефективним (отруєним) каталізатором. Як і слід було очікувати (за аналогією з алкеновим відновленням), утворюється цис-гідрогенізований продукт (\(\downarrow\)).
![]()
Також можна зменшити алкін до транс-продукту, але для цього ми повинні використовувати інший метод; метод, який передбачає поетапне додавання компонентів відновлення. Умови для цього скорочення вимагають джерела протонів і окремого джерела електронів. Наприклад, розчин металу натрію (джерело електронів) в рідкому аміаку (джерело протонів) при низькій температурі (так як аміак кипить при\(-33^{\circ} \mathrm{C}\)), може бути використаний для зменшення алкіну, але оскільки реакція протікає за допомогою ступеневого (не узгодженого) додавання, утворюється продукт є транс-алкен: найбільш стабільний продукт (\(\rightarrow\)).
![]()
Кислотність термінальних алкінів:
Одна алкін-специфічна реакція включає кислотність протонів, прикріплених до sp гібридизованих вуглеців. \(\mathrm{pK}_{\mathrm{a}\)З таких протонів знаходиться навколо\(25\), що набагато нижче, ніж у алканів (\(> 55\)) або алкенів (\(\sim 45\)). Насправді «термінальні» алкінні протони можуть бути видалені сильними основами, такими як\(\mathrm{NH}_{2}-\) (амідний іон), оскільки\(\mathrm{pK}_{\mathrm{a}\) of\(\mathrm{NH}_{3}\) (аміак) є\(33\) (\(\downarrow\)).
![]()
Кислотність термінальних алкінних протонів можна пояснити ідеєю, що негативний заряд (одиночна пара на отриманому аніоні) знаходиться в sp гібридній орбіталі. Чим більше «s» характер у гібридної орбіти, тим ближче до ядра. Оскільки орбітальна sp більше «s», ніж будь-яка\(\mathrm{sp}^{2}\) або\(\mathrm{sp}^{3}\) орбітальна, то електрон аніону вуглецю утримується ближче до ядра і тому є більш стабільним, ніж якби вуглець був\(\mathrm{sp}^{2}\) або\(\mathrm{sp}^{3}\) гібридизований. Ефект схожий на ефективне пояснення ядерного заряду для тенденцій електронегативності по таблиці Менделєєва (тобто чому фтор є більш електронегативним, ніж кисень). Алкін-аніон дуже корисний, оскільки зараз він є вуглецевим нуклеофілом і буде атакувати електрофільні види вуглецю в\(\mathrm{S}_{\mathrm{N} 2\) реакції. Це перший приклад, який ми бачили утворення вуглецевих зв'язків (хоча ми побачимо набагато більше).
![]()
