5.1: Реакції алкенів - електрофільного додавання
- Page ID
- 25283
Подвійні зв'язані вуглеці алкену багаті електронами, тобто електронна щільність висока в області подвійного зв'язку. Тому «сигнальна» реакція алкенів передбачає початковий напад на електрофіл. Замість заміщення алкени піддаються електрофільному додаванню - реакції, в якій двокомпонентний реагент додає через подвійний зв'язок. Реакція починається з електрофільної атаки подвійним зв'язком на реагент, який виробляє карбокацію, яка потім піддається нуклеофільної атаки. У випадку несиметричних алкенів (де групи, прикріплені до подвійних зв'язаних вуглеців, не зовсім однакові), утворюється найбільш стійкий карбокат. Ця реакція є регіоселективною, тобто ми можемо передбачити орієнтацію додавання реагентів через подвійний зв'язок. Якщо ми позначимо реагент як\(\mathrm{E}\) (для електрофілу) або\(\mathrm{N}\) (для нуклеофіла), реакція буде протікати так, як зазначено нижче.
| Реагент | Електрофіл | Нуклеофіл | Типові умови |
| \(\mathrm{HBr}\) | \(\mathrm{H}^{+}\) | \(\mathrm{Br}^{-}\) | Низька температура |
| \(\mathrm{H}_{2}\mathrm{O}\) | \(\mathrm{H}^{+}\) | \(\mathrm{H}_{2}\mathrm{O}\)(при втраті\(\mathrm{H}^{+}\) після додавання) | Водна кислота/низька температура |
| \(\mathrm{ROH}\) | \(\mathrm{H}^{+}\) | \(\mathrm{ROH}\) | \(\mathrm{ROH} / \mathrm{H}_{3} \mathrm{O}^{+}\) |
| \(\mathrm{Br}_{2}\) | \(\mathrm{Br}^{+}\) | \(\mathrm{Br}^{-}\) | \(\mathrm{Br}_{2} / \mathrm{CCl}_{4}\) |
| \(\mathrm{BrOH}\) | \(\mathrm{Br}^{-}\) | \({}^{-} \mathrm{OH}\) | \(\mathrm{Br}_{2} / \mathrm{H}_{2} \mathrm{O}\) |
| \(\mathrm{BrOR}\) | \(\mathrm{Br}^{+}\) | \({}^{-} \mathrm{OR}\) | \(\mathrm{Br}_{2} / \mathrm{ROH}\) |
Проміжний карбокатіон - це третинна карбокація (а не первинна карбокація, яка буде вироблена шляхом додавання до\(\mathrm{=CH}_{2}\) кінця подвійного зв'язку). Ця модель реакції іменується як доповнення Марковінкова, після того, як людина [1], яка вперше виявила, що\(\mathrm{HBr}\) додає таким чином подвійний зв'язок. Ми можемо класифікувати багато реагентів як комбінації електрофілів та нуклеофілів і, таким чином, передбачити, як вони додадуться через подвійний зв'язок. Показані приклади таких реагентів (\(\uparrow\)). Замість того, щоб запам'ятовувати продукт кожного типу додавання через подвійний зв'язок, набагато продуктивніше писати механізм, визначаючи, яка частина є електрофілом, додаючи його, щоб дати найбільш стабільний карбокат, а потім нуклеофіл.
Додатки до алкенів оборотні:
Давайте тепер докладніше розглянемо додавання води через подвійний зв'язок. Така реакція може бути здійснена шляхом реагування алкену з розведеною сірчаною кислотою при низьких температурах. Першим кроком є додавання протона для отримання найбільш стабільного карбокації, який потім атакується водою (нуклеофілом). Кінцевим продуктом є спирт, який утворюється після перенесення протона у воду. У цьому випадку ми можемо розглядати протон (а точніше\(\mathrm{H}_{3}\mathrm{O}^{+}\)) як каталізатор, оскільки він регенерується в кінці послідовності реакції.
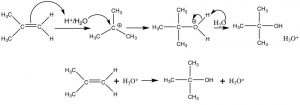
Кислотно-каталізоване додавання води через подвійний зв'язок
У цей момент ви можете запитати себе: ну чи не ми просто говорили про зворотну реакцію - тобто про усунення спиртів, щоб дати алкени?\(\mathrm{H}_{2}\mathrm{O}\) Дійсно, ми зробили! Багато органічних реакцій оборотні [2], це лише питання маніпулювання умовами. Точні умови реакції визначатимуть, яка реакція сприятлива.
Як і у випадку з більшістю реакцій додавання, додавання води через алкен є екзотермічним,\(\Delta \mathrm{H}\) тобто негативним, оскільки під час реакції утворюються міцніші (сигма) зв'язки і енергія виділяється в навколишнє середовище. Типова енергетична діаграма показана нижче.
Діаграма енергії реакції для додавання/усунення через подвійний зв'язок.
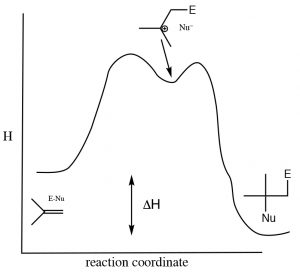
Це означає, що\(\Delta \mathrm{H}\) для усунення реакція повинна бути позитивною (тобто йде справа наліво на схемі вище). Питання тоді полягає в тому, чому коли-небудь виникає реакція на елімінацію? Щоб відповісти на це, ми повинні нагадати, що термодинамічний критерій реакції - це не просто негативна зміна ентальпії, а скоріше негативна зміна зміни Гіббса (\(\Delta \mathrm{G}\)). Нагадаємо, що\(\Delta \mathrm{G}=\Delta \mathrm{H}-\mathrm{T} \Delta \mathrm{S}\). Зміна ентропії також впливає на термодинамічну сприятливість реакції. У реакції елімінації дві молекули (алкен і вода) виробляються одна молекула спирту —зміна ентропії буде (Нагадаємо, що ентропія пов'язана з кількістю можливих механізмів системи. Оскільки дві молекули матимуть більше можливих аранжувань, ніж одна, ця реакція завжди буде супроводжуватися збільшенням ентропії системи). Щоб спонукати рівновагу до зсуву вправо (реакція додавання) нам потрібно збільшити температуру, що збільшить величину\(-\mathrm{T} \Delta \mathrm{S}\)\) терміну, зробивши\(\Delta \mathrm{G}\) більш негативним (якщо припустити,\(\Delta \mathrm{S}\) що позитивно). В основному додавання в подвійні зв'язки здійснюють при більш низьких температурах, в той час як реакції елімінації передбачають нагрівання реакційного розчину. Ще одним способом впливу на стан рівноваги є зміна відносних концентрацій реагентів або продуктів. Оскільки вода є реагентом, збільшення концентрації води зміщує положення рівноваги в бік продукту додавання, одночасно знижуючи концентрацію води, сприяє реакції елімінації.

Специфічні реагенти для додавання через подвійний зв'язок, які зменшують проблему карбокації
Проблема багатьох із цих простих реакцій додавання до подвійного зв'язку полягає в тому, що вони генерують карбокати, які, як ми вже бачили, можуть призвести до подальших реакцій, що призводить до перебудови скелета та виробництва рацемічних сумішей (а не одного стереоізомера). Для вирішення цього питання був розроблений ряд реактивів, які мінімізують цю проблему. Наприклад, реагент, який включає в себе ртутний ацетат (\(\mathrm{Hg}(\mathrm{OAc})_{2}\)) та борогідрид натрію (\(\mathrm{NaBH}_{4}\)) як проміжний продукт\(\mathrm{H}_{2}\mathrm{O}\), може бути використаний для додавання (або спирту) через подвійний зв'язок (\(\downarrow\)).
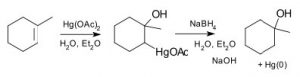
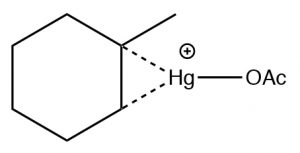
Реакція включає стабілізований ртуттю катіон (\(\rightarrow\)), який запобігає небажаним перебудовам. Продукт все ще є продуктом Марковникова (див. Вище), але часто формується більш чисто, тобто без небажаних альтернатив.
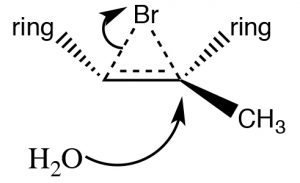
Інший набір реакцій, які можуть бути використані для обмеження молекулярних перебудов і призводять до стереоспецифічних продуктів, - це ті, які починаються з додавання брому через подвійний зв'язок. Найпростіша з цих супутніх реакцій - це додавання\(\mathrm{Br}_{2}\) самого себе; оскільки\(\mathrm{Br}\) є великим поляризованим атомом, молекула брому може стати поляризованою і взаємодіяти з подвійним зв'язком, як показано (\(\downarrow\)), утворюючи іон бромонію (а не карбокацію).
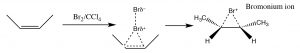
Іон бромонію тепер може піддаватися нуклеофільній атаці на будь-якому вуглеці (оскільки в цьому прикладі вони однакові, тобто приєднані до однакових груп), щоб отримати продукт додавання транс-дибромо. Транс-продукт утворюється тому, що другий етап - це\(\mathrm{S}_{\mathrm{N}} 2\) реакція з бромідним нуклеофілом, атакуючим вуглець зі зворотного боку.
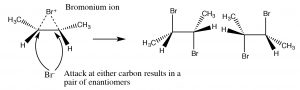
Додавання\(\mathrm{Br}_{2}\) здійснюється за допомогою реакційного розчинника, такого як чотирихлористий вуглець, який не перешкоджає реакції. Якщо в якості розчинника використовується вода або спирт, то атака на іон бромонію відбувається від розчинника, який діє як нуклеофіл на другому етапі.
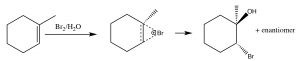
Знову ж таки, додавання є трансом, але тепер вхідний нуклеофіл (\(\mathrm{H}_{2}\mathrm{O}\)) буде атакувати вуглець, який є найбільш карбокаційним, тобто він є найбільш стабілізованим, як показано тут\(\rightarrow\). Реакція буває як регіоспецифічної, так і стереоспецифічної.