5.3: Зменшення алкенів-
- Page ID
- 25296
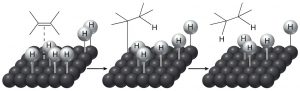
Історичне значення «відновлення» передбачало реакції з воднем (\(\mathrm{H}_{2}\)), і навпаки, окислення означало реакцію з киснем (\(\mathrm{O}_{2}\)). Це має сенс з точки зору, що вуглець трохи більш електронегативний, ніж водень, так що\(\mathrm{C-H}\) зв'язок поляризується як\(\mathrm{C}^{\partial-}\) і\(\mathrm{H}^{\partial+}\). Тому додавання водню до а\(\mathrm{C=H}\) збільшить (трохи) негативний заряд на вуглець. (Аналогічно,\(\mathrm{C-O}\) зв'язок поляризується\(\mathrm{C}^{\partial+}\) і\(\mathrm{O}^{\partial-}\), так що додавання більшої кількості кисню до вуглецю збільшує кількість позитивного заряду на вуглець.) Навіть сьогодні ми називаємо додавання водню через pi зв'язки як зменшення. Однак алкени нормально не реагують з воднем; зазвичай для реакції необхідний каталізатор (як правило, перехідний метал). Загалом, каталізатор подається у вигляді дрібнодисперсного порошку, адсорбованого на інертну речовину, таку як деревне вугілля. Найбільш поширеними каталізаторами є платина або паладій на вугіллі (\(\mathrm{Pt} / \mathrm{C}\)або\(\mathrm{Pt} / \mathrm{C}\)). Зазвичай відновлюване речовина розчиняють в розчиннику, додають каталізатор, а потім через суміш барботируют водень. Каталізатор адсорбує як\(\mathrm{H}_{2}\) і алкен на його поверхні, і ця взаємодія послаблює як\(\mathrm{H}_{2}\) зв'язок, так і зв'язок пі. Потім водень мігрує до адсорбованого алкену і додає через подвійний зв'язок. Реакція є стереоспецифічною в тому, що обидва Н додаються з однієї і тієї ж сторони - додавання синів. Це можна побачити більш чітко, якщо ми використовуємо дейтерій замість водню - обидва\(\mathrm{D}\) додаються з тієї ж сторони.