5.2: Додавання «Анти-Марковникова» по подвійних облігаціях
- Page ID
- 25269
У той час як заголовок для цього розділу називається доповненням «антимарковніков», це не означає, що механізм реакції насправді інший. У двох прикладах, які ми обговоримо тут, різниця полягає лише в тому, що перше додавання до подвійного зв'язку не є H, що, як ми побачимо, робить здається, що ми додали певний реагент протилежним способом звичайного додавання. Наприклад, якщо ми хочемо додати воду через подвійний зв'язок, щоб дати анти-Марковникова продукт використовується інший набір реагентів: кислотно-лужний комплекс Льюїса\(\mathrm{BH}_{3}\) і ефір тетрагідрофуран (\(\mathrm{THF}\)), а потім розчин перекису водню в основі. Цей реагент додає через подвійний зв'язок у напрямку, який можна було б очікувати, тобто електрофіл (кислота Льюїса) бор додає до найменш заміщеного вуглецю, але в той же час водень додає до найбільш заміщеного вуглецю з тієї ж сторони молекули.
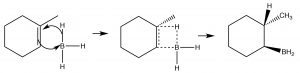
Механізм син-додавання\(\mathrm{BH}_{3}\) поперек подвійного зв'язку
Цей процес відбувається в два рази більше, а потім вид бору замінюється реакцією з перекисом водню і гідроксидом натрію.
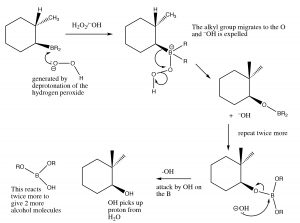
Механізм видалення борових частинок з подвійного зв'язку
Загальна реакція, схоже, додала стихії води в антимарковинковском напрямку. Ця реакція не тільки регіоспецифічна, але і є стереоспецифічною. \(\mathrm{H}\)І\(\mathrm{OH}\) додаються на тій же (цис) стороні подвійного зв'язку, і це називається syn-додаванням.
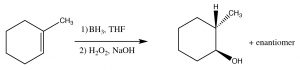
Антимарковников складання\(\mathrm{HBr}\) поперек подвійного зв'язку.
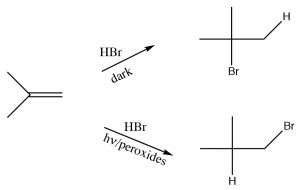
Інша реакція, яка, здається, порушує те, що ми дізналися про регіохімію додавання через подвійні зв'язки, - це реакція\(\mathrm{HBr}\) алкену з присутністю світла або пероксидів. На відміну від реакції, про яку ми говорили раніше, в умовах світла і в присутності пероксидів\(\mathrm{HBr}\) додає в зворотному напрямку. Тут явно відбувається щось інше: реакція протікає іншим\(\mathrm{Br}\) механізмом. Підказка полягає в наявності пероксидів, які майже завжди означають, що реакція протікає через радикальний механізм, а не полярний механізм.
Радикали - це види з непарними електронами, і, як такі, дуже реактивні. Реакція починається з стадії ініціації, на якій перекис (який містить слабкий\(\mathrm{O–O}\) зв'язок) гомолітично розривається, щоб дати два радикали кисню. Вони\(\mathrm{HBr}\) реагують з, абстрагуючи водень і залишаючи бромний радикал. Відзначимо, що оксі радикал реферує\(\mathrm{H}\) і немає\(\mathrm{Br}\), тому що\(\mathrm{Br}\) є більш стійким радикалом, ніж\(\mathrm{H}\). Бромний радикал - це великий поляризуючий вид, який може допомогти стабілізувати непарний електрон. Водневий радикал насправді є атомом водню, він дуже нестійкий і реактивний.
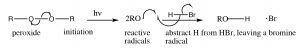
Примітка: коли механізм включає одиночні електрони, що рухаються (як при розщепленні гомолітичного зв'язку або будь-якої реакції радикального виду), ми використовуємо те, що називається стрілкою рибальського гачка - лише з однією головою, а не типовою стрілкою, яка позначає рух двох електронів.

Отриманий бромний радикал тепер реагує з подвійним зв'язком алкену, щоб отримати найбільш стабільний проміжний продукт, який є (так само, як і в карбокатіонів) третинним. Вуглецеві радикали демонструють ті ж тенденції стабільності, що і карбокати, з тієї причини, що вони також є дефіцитом електронів і можуть бути стабілізовані тими ж механізмами, що і карбокати (індукція та гіперкон'югація). Отриманий вуглецевий радикал тепер абстрагує Н з іншої молекули HBr, щоб отримати продукт додавання проти Марковникова, плюс ще один бромний радикал, який може почати цикл знову. Це називається радикальною ланцюговою реакцією - оскільки вона виробляє інші реактивні форми, які можуть продовжувати ланцюгову реакцію.
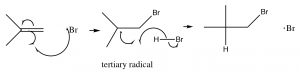
Примітка: Незважаючи на те, що ця реакція виробляє інший продукт додавання, ніж типове додавання\(\mathrm{HBr}\) через подвійний зв'язок, принципи, що керують реакцією, однакові. Перше додавання дає найбільш стабільний проміжний продукт; різниця полягає в тому, що бром додає першим.
