11: Стратегії синтезу стероїдів
- Page ID
- 24264
Основні скелетні риси в стероїдних кільцях зображені двома малюнками, показаними на малюнку 11.1. Така ж система нумерації зберігається навіть при описі структур деталей, отриманих як синтетичні проміжні продукти.
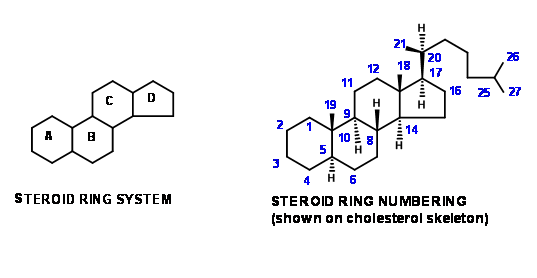
Ця конвенція допомагає нам стежити за розвитком структурних особливостей за допомогою довгих синтетичних схем. Студенти повинні також ознайомитися з іншою конвенцією, за якою слідують хіміки класифікувати синтетичні схеми, спочатку розвивалися для стероїдів. Подібні описи зустрічаються і в алкалоїдної хімії. «\(AB \rightarrow ABC \rightarrow ABCD\)Підхід» означатиме, що скелет нафталіну (ароматичний або відповідний пергідро- скелет) обраний як SM. Кільце С потім будується на кільцях AB. Кільце D потім утворюється кільцевим замиканням. Прикладом до цієї стратегії є синтез Бехмана (1940 р.). Такі описи не вказують жодних деталей, таких як шаблони заміщення на СМ або синтетичні проміжні продукти, а також не проливають світло на стереохімічні деталі. Ці деталі обговорюються в синтетичних схемах.
Синтез Бехмана (1940) Еквіленіна
Цей класичний синтез використовує хімію нафталінового кільця. Як кільце AB було обрано 1-нафтиламін-2-сульфонову кислоту (рис. 11.2). Сульфонові
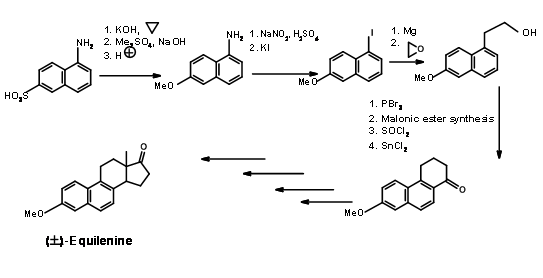
кислотний фрагмент був перетворений в фенол і захищений як метиловий ефір. Амінний фрагмент був перетворений в йодид шляхом діазотизації. Кільця C і D потім були побудовані на кільцях AB.
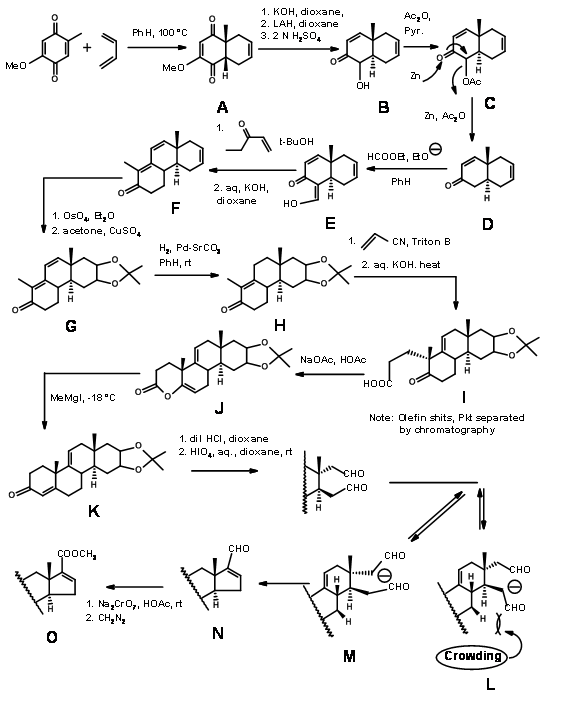
Синтез холестерину Вудворда:
Синтез холестерину Вудворда (J.Am. Хім. Соц., 73, 2403, 3547, 3548 (1951); там же, 74, 4223 (1952) (рис. 11.3) можна охарактеризувати як\(C \rightarrow CD \rightarrow BCD \rightarrow ABCD\) Підхід. Оскільки кільце D залишається D-homo до останнього кроку побудови кільця, а необхідне 5-членне кільце було отримано лише після скорочення кільця, його також можна назвати\(C \rightarrow BC \rightarrow ABC \rightarrow ABCD\) Підходом. Пам'ятайте, що ця молекула має 8 асиметричних центрів і тому може мати 28 (256) оптичних ізомерів. Цей синтез передбачав синтез всього одного набору діастереомерів. Цей стереоспецифічний синтез включив усі стереоточки стерео- та регіоспецифічним чином. Кільце D забезпечує якір для варіацій ланцюга. Подвійна зв'язок на кільці С дозволила відкрити для синтезу кортизону. Легенди на стрілках показують реакції.

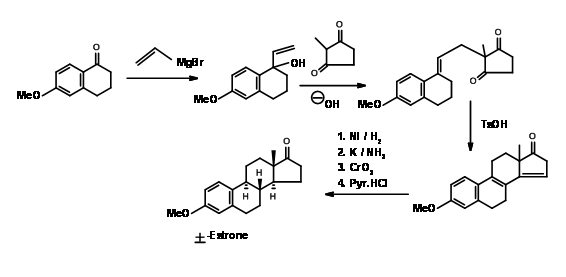
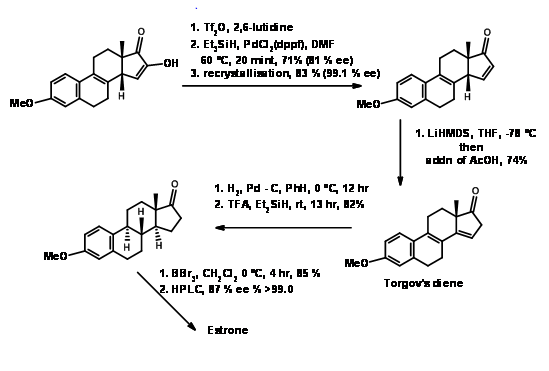
Синтез естрону
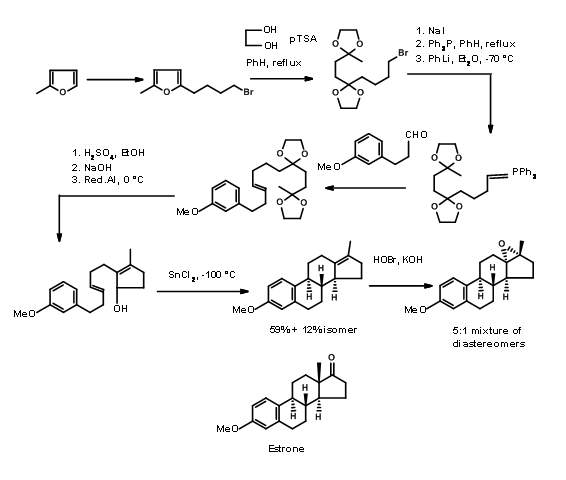
Естрон залучив кілька хіміків як мішень для виконання нових методологій на цьому комплексі, але корисний стероїд. Дуже популярний метод введення кільця D з подальшою циклізацією кільця С в синтезі стероїдів був введений Торговим (1950, 63). Його синтез естрону показаний на малюнку 11.4. Його процедура для\(AB \rightarrow ABD \rightarrow ABCD\) підходу стала дуже популярною. Пізніше було розроблено кілька модифікацій для подальшого вдосконалення цієї методології.
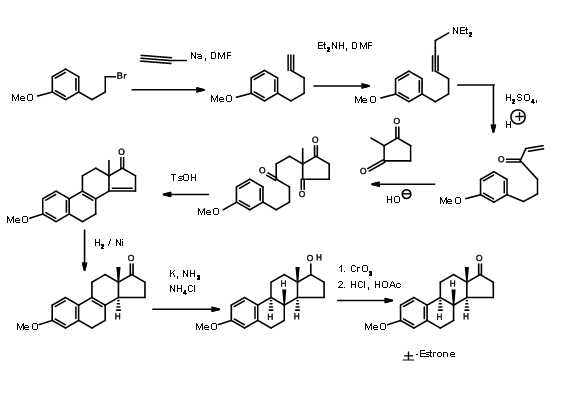
Бартлет використовував механістичне перетворення в своєму синтезі Естрону. Він застосував циклізацію біогенетичного типу для свого\(\ce{A -> AD -> ABCD}\) підходу, показаного на малюнку 11.5. Фуранове кільце служило маскованим 1,4-дикетоном, необхідним для кільця D. Також зверніть увагу на перетворення перестановки, що використовується для стереоспецифічного введення кутової метильної групи в положенні С13 на останньому етапі синтезу.
Хьюз (1960) покладався на альдол перетворення для його A AD ABCD підхід. Тут він використав надійні протоколи скорочення, розроблені декількома працівниками для контролю стереохімії на кільцевих переходах (рис. 11.6)
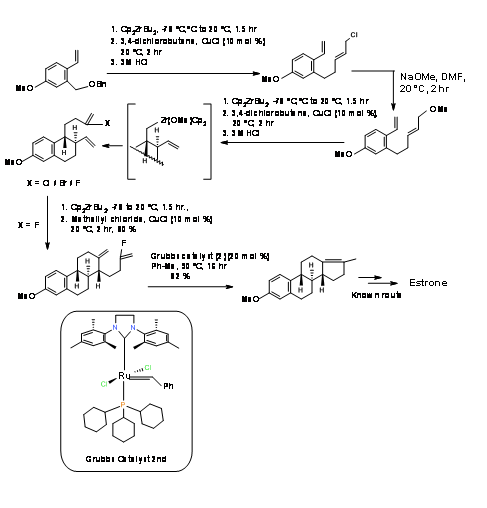
Герман та ін., (J. Org. Chem., 73, 6202 (2008)) спробував послідовну стратегію Media:Ring Closure Reactions (RCR) для стереоспецифічного синтезу естрону. Ці працівники покладалися на каталізатор C P 2 ZrB U 2, який широко вивчався у своїй лабораторії, і розробили короткий 9-ступінчастий синтез з відомого дієну (A AB ABC ABCD підхід) (рис. 11.7). Циклізація кільця В протікала задовільно. Цилізація кільця С була чутливою до галогену. Після декількох спроб циклізація пройшла добре з вінілфторидом. Формування кільця D за допомогою каталізатора Zr виявилося невдалим. Закриття кільця D кільця було нарешті здійснено за допомогою каталізатора Media: Grubbs другого покоління. Про остаточну модифікацію D-кільця вже повідомляв Bartlett P.A і т.д., (J. Am. Хім. Soc., 95, 7501 (1973) тим самим завершуючи формальний синтез естрону.
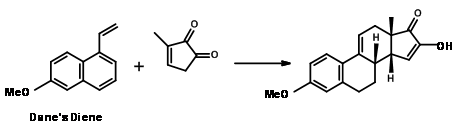
Марко Веймар та ін., (J. Org. Chem., 75, 2718 (2010)) повідомили про дуже успішну трансформацію DA для формування кільця CD з diene датчана як кільце AB і D кільце як dienoplile (рис. 11.8) (AB ABCD підхід; див. посилання цитуються для подібних підходів).
Ключем до успіху цієї стратегії став безметалевий хіральний каталізатор, який вони успішно адаптували шляхом впровадження трьох ділянок H-склеювання. Каталізатором, який працював ефективно, був медіа:аксіально хіральна амідинова сіль 11,9.
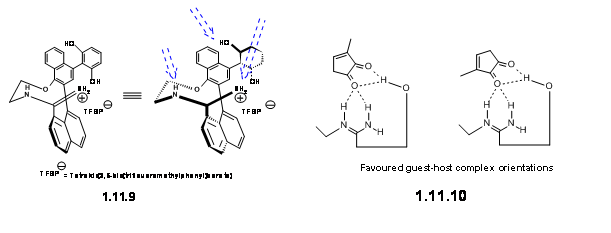
Вони припустили, що цей ліганд утворив комплекс «Хост-гість» з діенопліллю, як зображено в 11.10.
У цих умовах реакція Дільса-Альдера протікала з відмінною врожайністю. Ця сполука була перетворена в естрон, як показано на малюнку 11.11
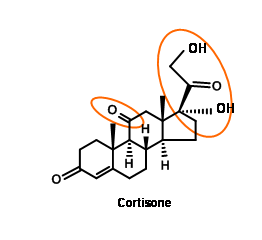
Синтез кортизону
Кортизон привернув увагу кількох хіміків-синтетиків, адже цей диво-препарат був доступний лише в найдрібніших кількостях з тваринних джерел. Дві складні особливості в структурі кортизону були кето- група при С11 і 1,2,3- картина оксигенації на двовуглецевому бічному ланцюзі при C17.
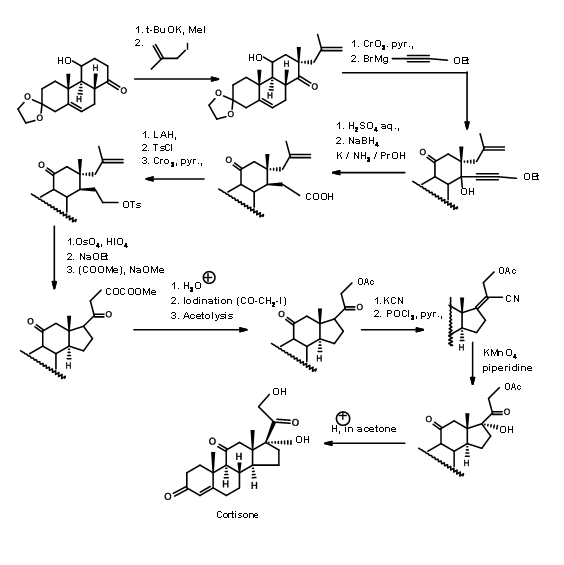
Сарретт (Джей Ам. Хім. Соц., 74, 4974 (1952); Дж. Хім. Соц., 76, 5031 (1954)) використовував підхід ABC ABCD. Його стартова молекула мала всі особливості, необхідні для кілець A, B і C кортизону. Він мав групу C11 —OH та зручно розміщений кетон для побудови кільця D. Вони використовували відомі стереоелектронні обмеження аніонних реакцій на жорсткому 6-членному кільці для побудови транс-кільцевого переходу C/D (рис. 11.12). Ця велосипедизація має дві примітні особливості. Олефін служив маскованим кетоном. На відміну від синтезу холестерину Вудворда (рис. 11.3), який мав конкуруючу ділянку для формування аніонів, в цій схемі можливий лише один аніон, що призводить до передбачуваного продукту.
Цікавий новий підхід в синтезі стероїдів прийшов від Y. Horiguchi (J. Org. Хім., 51, 4325 (1986)). Це можна описати як CD BCD ABCD підхід. Зверніть увагу, що оксигенація C11 та вуглеці, необхідні для кільця A, пройшли один етап окислення, як це передбачено в їх ретроаналізі, показаному на малюнку 11.13.
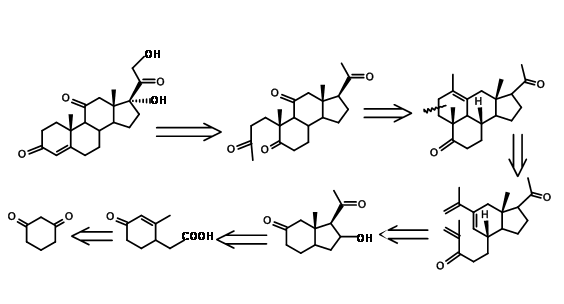
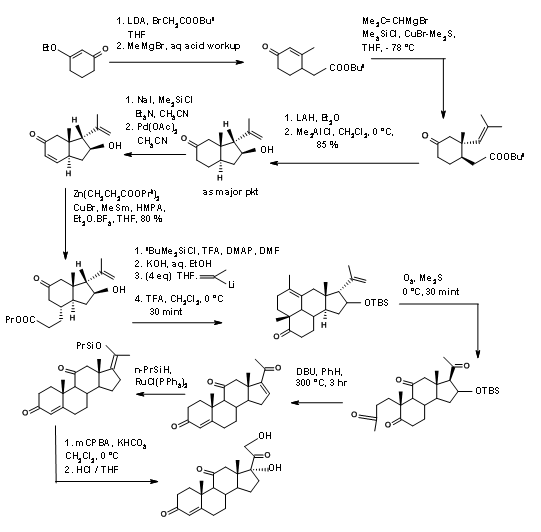
Детальна синтетична схема Хоригучі показана на малюнку 11.14. У цьому синтезі цікава стратегія формування A, а також D кільця.
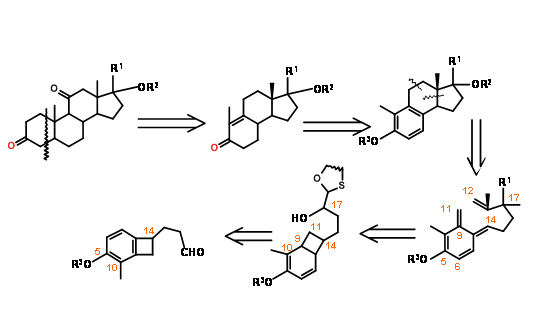
Ретроаналіз Немото (J. Org. Хім., 55, 5625 (1990)) забезпечив цікаве електроциклічне відкриття кільця - стратегія циклододавання для підходу B BCD ABCD (рис. 11.15).
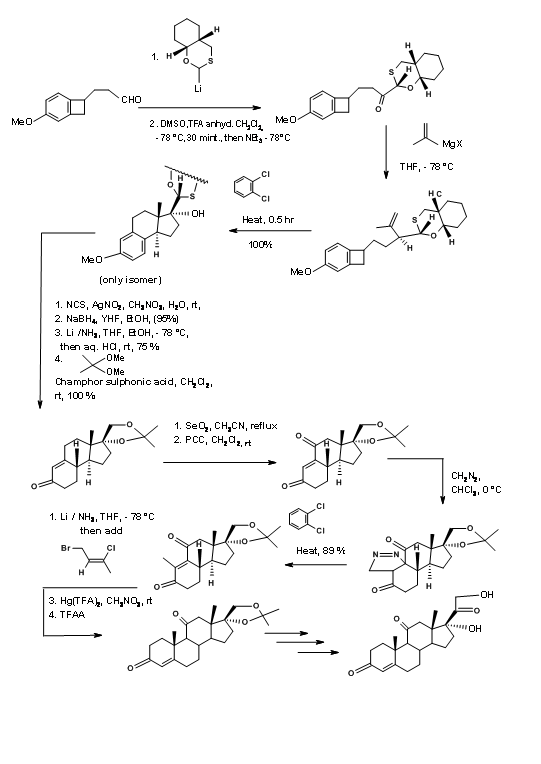
Синтетична схема показана на малюнку 11.16. Зверніть увагу на універсальний хіральний допоміжний на першому кроці, який служить декільком корисним цілям формування зв'язків на додаток до направлення трьох асиметричних центрів на C/D кільцях.
Захоплення для освоєння стероїдних скелет як і раніше триває не зменшується.