9: Стратегії синтезу резерпіну
- Page ID
- 24271
Будова Резерпіна було вирішено до 1953 року. Група Р.Б. Вудворда повідомила про перший синтез Reserpine в 1956 році (J.Am. Хім. Соц., 78, 2023, 2657 (1956); Тетраедр, 2, 1 (1958)). Його науковий аналіз чітко відображав аспекти ретроаналізу, який тільки розвивався в той час. Цей синтез викликає захоплення тим, як він використовував конформаційний аналіз та стереоелектронні ефекти для точного розвитку стереоточок у цій надзвичайно складній проблемі для того часу. Він визнав, що E-кільце має щільний масив з 5 асиметричних центрів у шестичленному кільці E. Його відключення резерпіну призвело його до ключового проміжного C. Ми могли б формалізувати його ретроаналіз, як показано на малюнку 9.1.
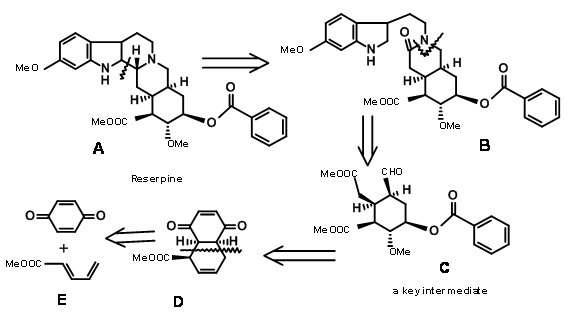
Ще один блискучий шматок конформаційного аналізу можна було побачити в тому, як він перетворив Ізорезерпін в резерпін шляхом введення конформаційного штаму в інакше зручну молекулу.
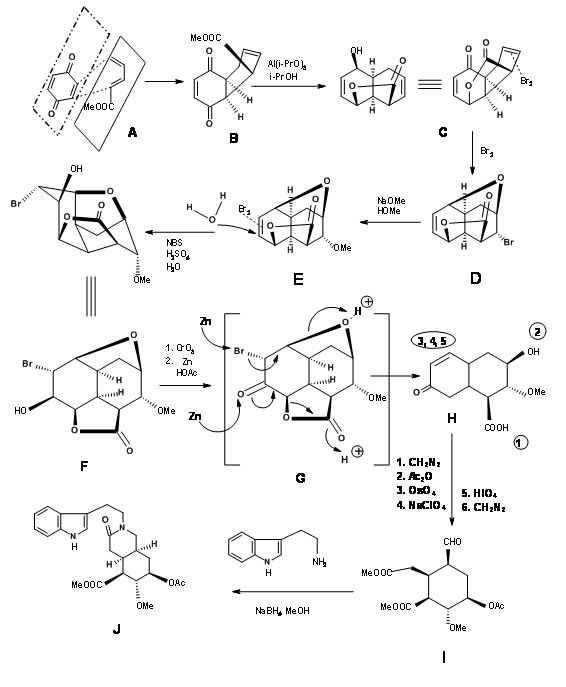
Синтез альдегіду Вудворда (9.1C): У виконанні колуна групою Вудворда (рис. 9.2) всі необхідні вуглеці для кільців D/E та трьох з п'яти асиметричних центрів були створені однією реакцією Дільса-Альдера (9.2B). Зверніть увагу, що проста дисиметрія в одному компоненті - метилакрилаті - може точно розмістити три асиметричні центри поспіль правильним чином. Ця реакція циклоприєднання розвинула увігнуту фазу та опуклу фазу1 у продукті, яка керувала подальшими модифікаціями цього проміжного продукту. Гідридний реагент на наступному етапі доставив гідрид з менш утрудненої опуклої фази, помістивши групу —OH у увігнуту фазу. Це сприяло утворенню п'ятичленного лактонового кільця (9,2С). Альтернативне шестичленне лактонове кільце імовірно було більш напруженим. Бромування на 9.2C молекулярним бромом утворило комплекс іонів бромонію з опуклої фази, тоді як група —OH могла увійти з увігнутої фази, утворюючи ефір (9.2D). Обробка метоксидом натрію витіснила бром з опуклої фази, можливо шляхом елімінації — додавання (9.2E). Наступний комплекс іонів бромонію знову виходив з опуклої фази, причому молекула води, що надходить з увігнутої фази, щоб забезпечити транс-діааксіальне відкриття бромонієвого комплексу (9.2F). Після одного етапу окислення молекула тепер була встановлена для складної реакції подвійного елімінації, при цьому цинк атакував два центри. Атака в центрі броміду відкрила ефірне кільце, тоді як інша атака на карбонільну групу відкрила лактонове кільце. Ця складна Тандемна реакція розмістила всі п'ять асиметричних центрів. Відкриття ненасиченого кільця дало ключу проміжний 9.2I.
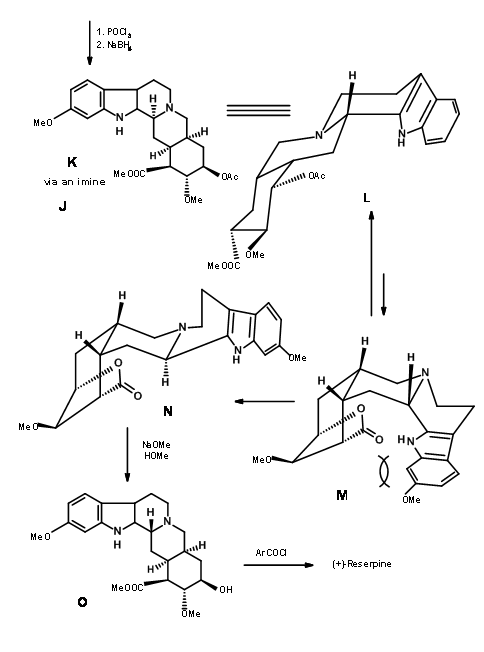
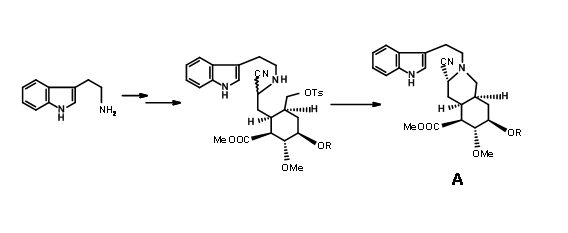
Завершення A, B, C, D і E кілець: Конденсація 9.2I з о-метокситриптаміном з подальшою конденсацією Піктет-Шпенглера призвела до утворення ізорезерпіну, а не Резерпіну. Вудворд міркував, що це було пов'язано з тим, що кільця C, D і E в все-транс-геометрії мали всі замінники в стабільній екваторіальній орієнтації в Ізорезерпіні. Вудворд виконав ізомеризацію на С3 геніальним способом. Водний луг гідролізував функції ацетат-ефіру, який був ніж лактонізований в умовах DCC. Таким чином, нестабільне всеосне кільце Е було заблоковано в якості лактону (9.2M). Це змусило молекулу перебувати в переповненому нестабільному стані. На каталізованої кислотою ізомеризації з високим кипінням карбонової кислоти, положення С3 ізомеризується до конфігурації резерпіну. При переетерифікації правильний ізомер утворився з вільним —OH, готовим до остаточного ацилювання.
Г. Metha синтез E кільце: G Metha і т.д., (J. chem. Soc., Perkin Trans. 1, 1319 (2000)) контролював стереохімію на кільці E через систему гептану велосипеда [2.2.1], як показано на малюнку 9.3.
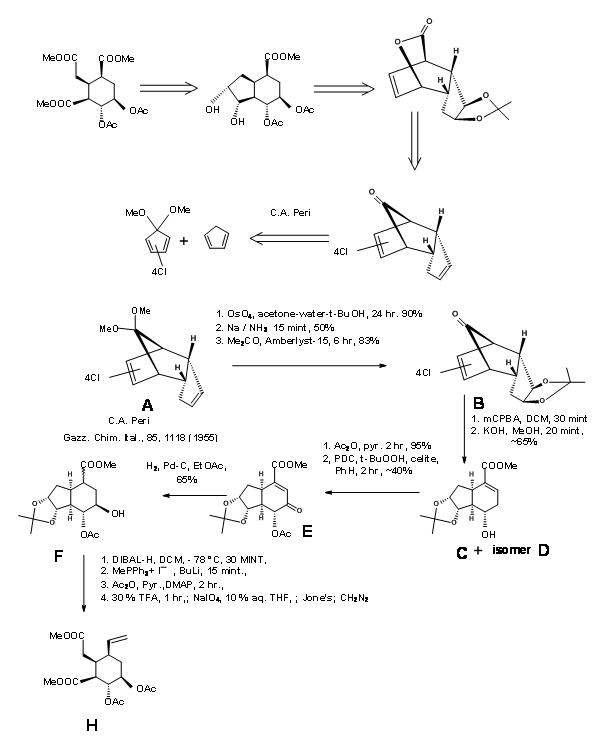
Синтез лелеки: Лелека Гілберт (J.Am. Хім. Soc., 127, 16255 (2005) аргументував, що стереохімія на C3 в (AB ABDE ABCDE) шляху циклізації Вудворда можна контролювати, якщо спочатку може бути сформований проміжний проміжний 9.4. Потім це орієнтувало б подібне до стільця складання ланцюга троса (потенційне кільце С) для осьової атаки на іон імінію, щоб дати стереоселективне закриття кільця C/D з утворенням резерпіну. Вони аргументували, що проміжний 9,5 буде служити ключовим проміжним.
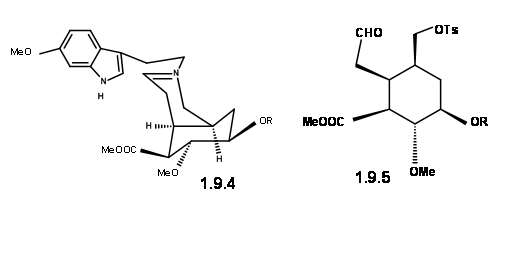
9.4 (ліворуч) і 9.5 (праворуч)
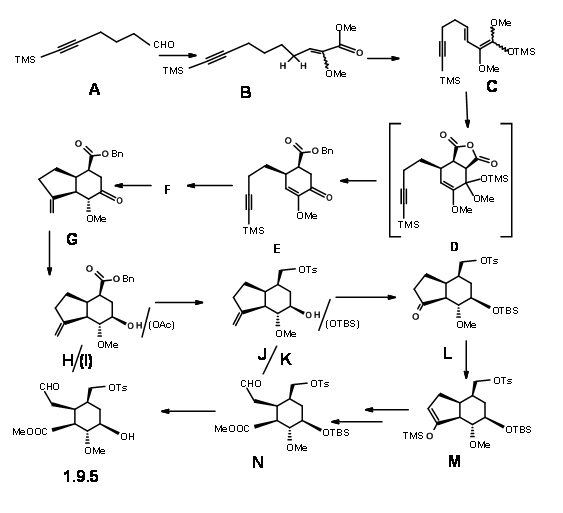
Після деяких невдалих спроб школа Лелеки завершила синтез 9.5 за допомогою маршруту, показаного на малюнку 9.6. Конденсація гексинала 9.6A з енолатом літію метилметокси ацетату з подальшим бензолсульфонілхлоридом і подальшим нагріванням з DBU дали кон'югований метокси-ефір з (Z) ізомером 9.6B як домінуючим продуктом. Триметилсилілхлорид захопив дієн кетен ацеталь 9.6C без очищення проміжного продукту. Реакція D.A з малеїновим ангідридом з подальшим водним THF дала декарбоксильовану кислоту, яка була етерифікована, щоб дати 9.6E. Вільнорадикальна циклізація з трибутилстананом при рефлюксі т-бутанолу та подальше обстеження призвело до епімерної суміші, яка була врівноважений з основою до потрібного ізомеру 9.6G. Зменшення кето- групи з L-селектридом дало осьовий спирт. Цей алкоголь був перевернутим шляхом мезилювання та лікування ацетатом цезію, щоб дати 9,6I. Зменшення за допомогою LAH, селективне тозилювання первинного спирту та силілювання вторинного спирту та озонолізу дало 9,6 л через 9.6K. Відкриття 5-членного кільця було досягнуто шляхом захоплення кінетичного енолату як похідної TMS 9.6M та озонолізу, а остаточна етерифікація дала 9.6N. Цей ключовий проміжний продукт також був синтезований за допомогою альтернативного більш ефективного маршруту.
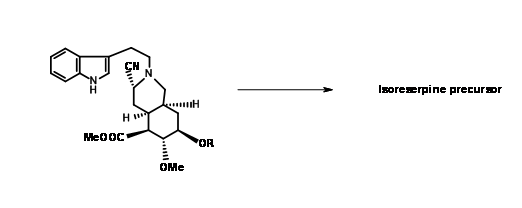
На жаль, конденсація 9,5 з попередником індолу дала ізорезерпін в якості основного продукту (рис. 9.7). Дослідники аргументували, що цей несподіваний результат, швидше за все, був обумовлений утворенням
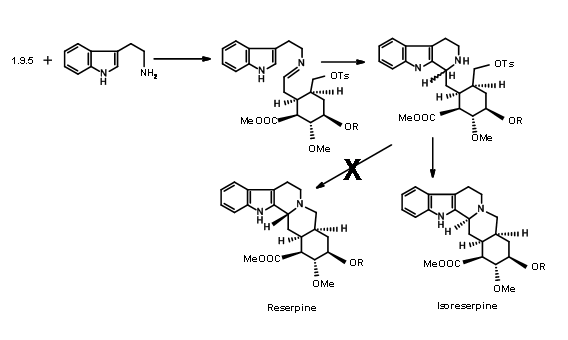
C кільце до циклізації. Для того, щоб керувати реакцією на формування кільця ДЕ, вони вирішили захопити проміжний імін як ціаноамін 9.8A. Це було досягнуто шляхом додавання в реакційну суміш надлишку ціаністого калію.
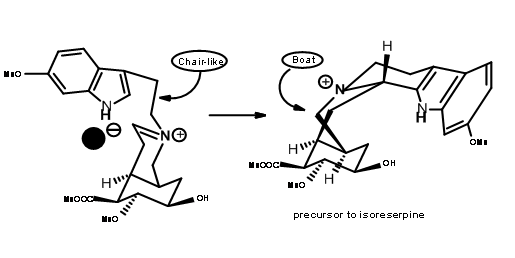
Очікуваний продукт 9.8A з осьовою ціано-групою був єдиним продуктом. Рефлюкс амінонітрилу в ацетонітрилі як розчинник знову дав (±) попередник метилізорезерпіну в якості основного продукту (рис. 9.9). Оскільки очікуване стільцеподібне складання та осьова атака фрагмента індолу на іонний фрагмент мінію виявилися на звукових стереоелектронних підставах, автори аргументували, що аніон ціаніду на α- фазі молекули утворив щільну іонну пару з іоном іммонію
за цих умов. Цей аніон запобігав осьовій атаці на стільцеподібне складання ланцюга, змушуючи човен, як конформація перед циклізацією, з подальшою осьовою атакою, щоб дати ізорезерпін як основний продукт.
У такому випадку, дозволяючи ціанідному зустрічному іону вирватися від впливу іона імінію за допомогою полярного розчинника, слід очистити місце реакції для крісло-осьової атаки. Коли нітриламін 9.8A лікували 10%
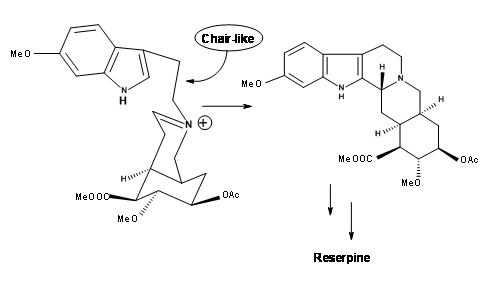
розчин 1 N HCl у розчиннику THF, попередником для (±) метил-резерпіну був продукт у виході 90%. Це врешті-решт було перетворено на резерпін відомими процедурами. На підставі цих результатів автори повідомили про ще один дуже короткий хіральний маршрут. Таким чином, наполегливість і критичні механістичні міркування в кожній точці невдачі приводили до успішного прямого синтезу правильного ізомеру.
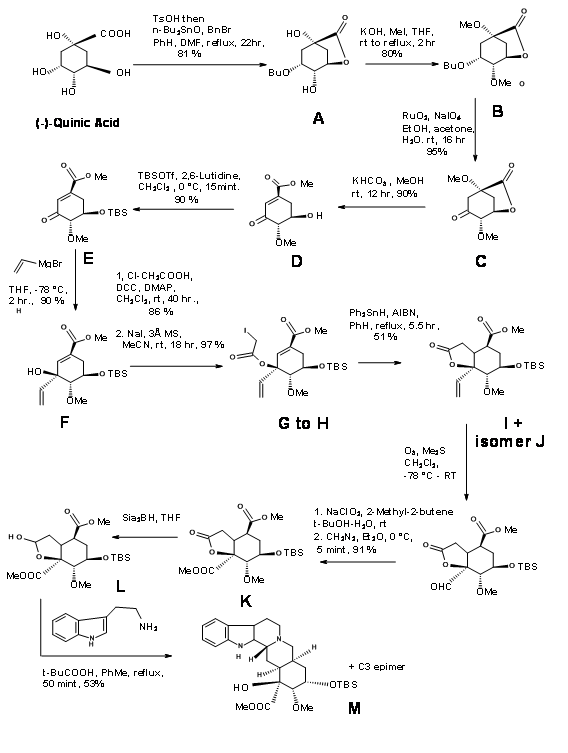
Ганессен та ін., (J.R.org. Хім., 62, 465 (1997) застосував підхід Chiron до ключового проміжного 9.10B, придатного для формування кільця CD в підході E ABE ABCDE, обговорюваному досі.
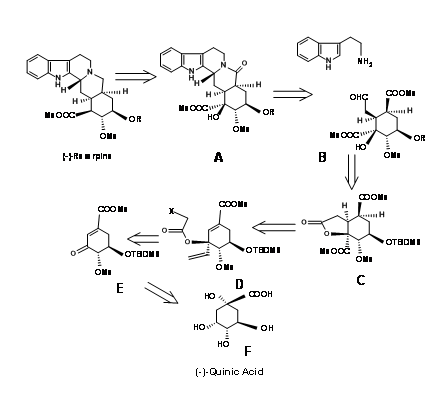
Хінна кислота 9.10F мала більшість хіральних центрів у належній орієнтації. Однак вона потребувала модифікації в потенційних центрах C20, C15 та C16. Ретроаналіз Ганессіана показаний на малюнку 9.10. Фактичний синтез показаний на малюнку 9.11. Лактонізація, з подальшим селективним бензиловим захистом та метилуванням інших груп OH дали сполуку B. Окислення супроводжувалося метанолізом лактонового кільця, що призвело до ліквідації, щоб дати кон'югатену кетон D. Захист C18 - OH як TBDMS з подальшим вінілуванням з використанням реагенту Гриньяра, розміщеного потенційна функція карбонової кислоти. Створений таким чином т-спирт забезпечив якір стереоспецифічне введення необхідних двох вуглецевих ланцюгів. Редуктивна циклізація вільних радикалів помістила вуглецевий ланцюг у правильну стереохімію. Правильний ізомер при C20 (I) потім був переміщений до наступного кроку. Цей ключовий проміжний L привів до попередників резерпіну та ізорезерпіну 9.11M та 9.11M 'у співвідношенні 1.4:1 відповідно. Ці кроки наведені на малюнку 9.11.