14.4: Реакції зневоднення спиртів
- Page ID
- 23550
Зневоднення спиртів з отриманням алкенів
Одним із способів синтезу алкенів є зневоднення спиртів - процес, в якому спирти проходять механізми Е1 або Е2, щоб втратити воду та утворювати подвійний зв'язок. Реакція зневоднення спиртів з утворенням алкену протікає шляхом нагрівання спиртів у присутності сильної кислоти, такої як сірчана або фосфорна кислота, при високих температурах.
Необхідний діапазон температури реакції зменшується зі збільшенням заміщення гідроксивмісного вуглецю:
- 1° спирти: 170° - 180° C
- 2° спирти: 100 °— 140° C
- 3° спирти: 25° - 80° C
Якщо реакція недостатньо нагріта, спирти не зневоднюються з утворенням алкенів, а вступають в реакцію один з одним, утворюючи ефіри (наприклад, синтез ефіру Вільямсона).

Спирти амфотерні; вони можуть виступати як кислотою, так і основою. Одинока пара електронів на атомі кисню робить групу —OH слабо основною. Кисень може пожертвувати два електрони протону з дефіцитом електронів. Таким чином, в присутності сильної кислоти R—OH діє як основа і протонує в дуже кислий іон алкілоксонію+OH2 (Значення pKA третинного протонованого спирту може йти до -3,8). Ця основна характеристика алкоголю необхідна для його реакції зневоднення з кислотою з утворенням алкенів.
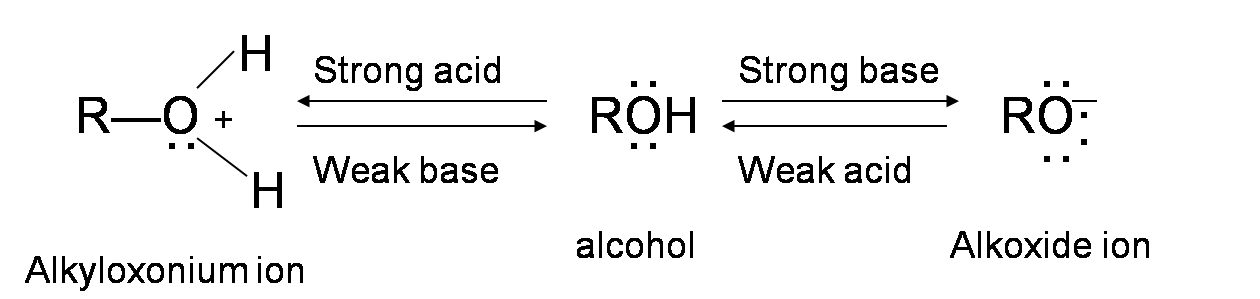
Механізм зневоднення алкоголю в алкен
Різні типи спиртів можуть зневоднюватися за допомогою дещо іншого механічного шляху. Однак загальна ідея кожної реакції зневоднення полягає в тому, що група —OH у спирті дарує два електрони H + від кислотного реагенту, утворюючи іон алкілоксонію. Цей іон діє як дуже хороша група, що залишає, щоб сформувати карбокацію. Потім депротонована кислота (основа) вступає в реакцію з воднем, що прилягає до карбокатіону, і утворює подвійний зв'язок.
Первинні спирти проходять бімолекулярну елімінацію (механізм Е2), тоді як вторинні та третинні спирти проходять одномолекулярну елімінацію (механізм Е1). Відносна реакційна здатність спиртів в реакціях дегідратації зараховується наступним чином:
Метанол < первинний < вторинний < третинний
Первинні спирти зневоднюються за допомогою механізму Е2. Гідроксильний кисень дарує два електрони протону з сірчаної кислоти (H 2 SO 4), утворюючи іон алкілоксонію. Потім сполучена основа, HSO 4 -, реагує з одним із сусідніх (бета) атомів водню, тоді як іон алкілоксонію виходить у узгодженому процесі, утворюючи подвійний зв'язок.

Вторинні та третинні спирти зневоднюються за допомогою механізму Е1. Подібно до реакції вище, вторинний і третинний —OH протонат з утворенням іонів алкілоксонію. Однак в цьому випадку іон виходить першим і утворює карбокат як проміжний проміжний проміжок реакції. Молекула води (яка є більш міцною основою, ніж HSO 4 - іон) потім абстрагує протон із сусіднього вуглецю, утворюючи подвійний зв'язок. Зверніть увагу в механізмі нижче, що утворюється алкен залежить від того, який протон абстрагується: червоні стрілки показують утворення більш заміщеного 2-бутену, тоді як сині стрілки показують утворення менш заміщеного 1-бутену. Нагадаємо, що згідно з Правилом Зайцева, тим більше заміщених алкенів утворюються переважно тому, що вони більш стійкі, ніж менш заміщені алкени. Крім того, транс-алкени є більш стабільними, ніж цис-алкени, а також є основним продуктом, що утворюється. Для наведеного нижче прикладу найбільш поширений транс-діастереомер 2-бутенового продукту.
Реакція зневоднення вторинного алкоголю
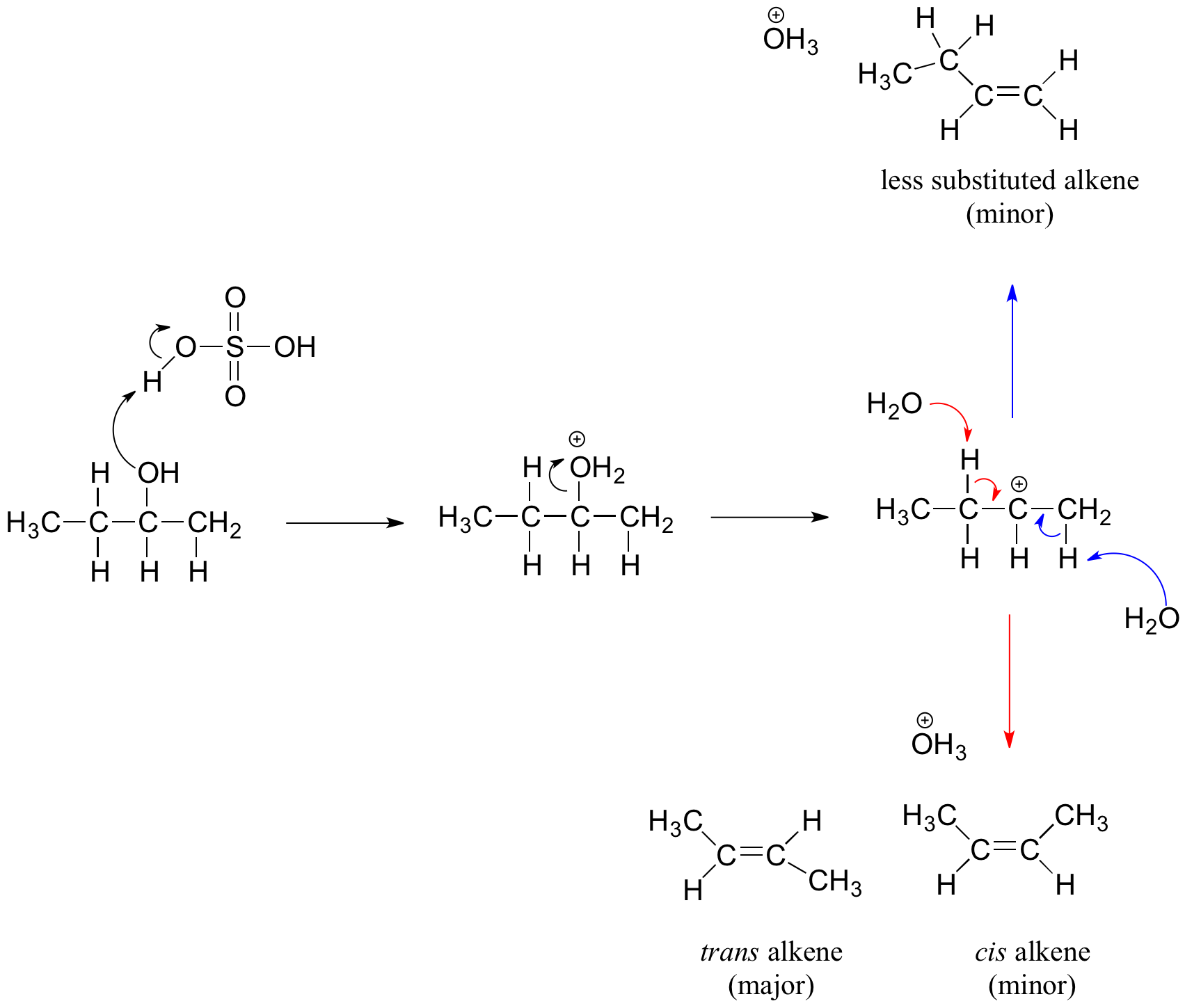
Механізм зневоднення третинного алкоголю аналогічний показаному вище для вторинного алкоголю.
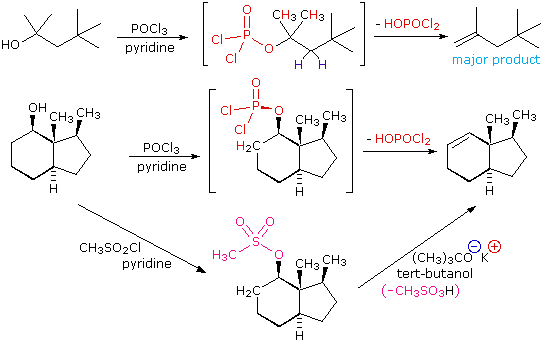
Елімінація E2 3º-спиртів у відносно некислих умовах може бути здійснена шляхом обробки оксихлоридом фосфору (PoCl 3) у піридині. Ця процедура також ефективна з перешкодженими 2º-спиртами, але для безперешкодних і 1º-спиртів і S N 2 хлорид-іонна заміна хлорофосфату проміжного продукту конкурує з елімінацією. Приклади цих і пов'язаних з ними реакцій наведені на наступному малюнку. Перше рівняння показує зневоднення 3º-алкоголю. Переважання незайцевого продукту (менш заміщеного подвійного зв'язку) передбачається через стеричну перешкоду атомів водню метиленової групи, що перешкоджає наближенню основи на цій ділянці. Другий приклад показує дві процедури елімінації, застосовані до одного і того ж 2º-алкоголю. Перший використовує однокроковий метод PoCl3, який добре працює в цьому випадку, оскільки заміщення SN2 затримується стеричною перешкодою. Другий метод - ще один приклад, в якому проміжний ефір сульфонату надає галогеноподібну реакційну здатність спирту. У кожному випадку аніонна вихідна група є кон'югатною основою сильної кислоти.
Проблеми практики (він же вправи)

.jpg)
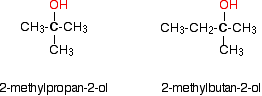
Вправи
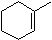
6. Починаючи з циклогексанолу, опишіть, як ви б готували циклогексен.
7. При зневодненні 1-метилциклогексанолу який продукт віддають перевагу?

8.
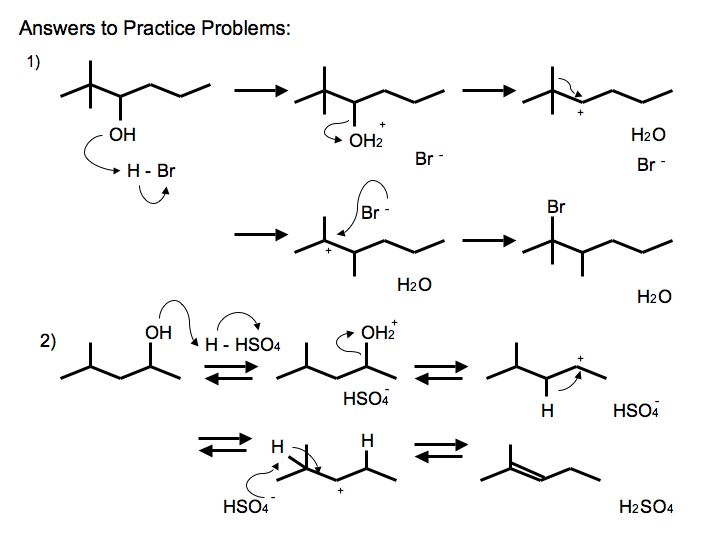
При зневодненні цього діолу отриманий продукт є кетоном. Намалюйте механізм його формування. (Підказка про перестановку відбувається)

9.
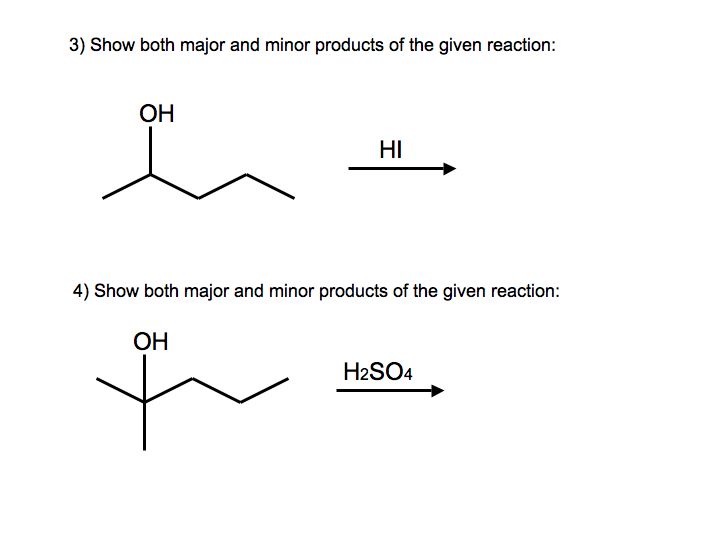
Намалюйте стрілку штовхає механізм для каталізованої кислотою зневоднення наступного спирту, переконайтеся, що намалюйте обидва потенційні механізми. Припустимо відсутність перестановки для перших двох механізмів продукту. Який з цих двох, ймовірно, буде основним продуктом? Якщо сталася перестановка, намалюйте очікуваний основний продукт.

Відповідь
-
6. H 2 SO 4 з теплом, так як немає побоювань щодо перестановки C +
7. Більш заміщений алкен віддається перевагу, оскільки більше заміщених алкенів порівняно менші за енергією.
8.
Ця реакція відома як перебудова Пінаколу.

Зверніть увагу, як карбокатіон після перестановки резонансний стабілізується киснем
9. Примітка: Хоча механізм є повчальним для першої частини цієї відповіді. Карбокатіонная перестановка відбулася б і визначатиме основні та другорядні продукти, як пояснено у другій частині цієї відповіді.

Основним продуктом цього механізму був би більш сильно замінений алкен, або продукт, утворений з червоних стрілок.
Примітка: З вторинним карбокатом, що примикає до третинного вуглецевого центру, 1,2 гідридний зсув (перестановка) відбудеться з утворенням третинного карбокатіону, а сполука нижче буде основним продуктом. Мінорний продукт - це той же продукт, що і той, що утворився з червоних стрілок.

Дописувачі та атрибуція
- Джеффрі Ма