14.10: Реакції алкоксидів
- Page ID
- 23451
Вступ
Атом водню гідроксильної групи є іонізуючим і може бути замінений іншими замінниками, як показано в реакціях нижче. Перша реакція показує прості спирти з натрієм (і гідридом натрію). Друга реакція показує ізотопний обмін, що виникає при змішуванні спирту з оксидом дейтерію (важкою водою). Цей обмін, який каталізується кислотою або основою, є швидким у звичайних умовах, оскільки важко уникнути слідів цих каталізаторів у більшості експериментальних систем.
2 R—O—H + 2 Na 2 R—O (—) Na (+) + Н 2 2 R—O (—) Na (+) + Н 2 |
Р—О— Н + Д 2 О Р—О— Д + Д —О— Н Р—О— Д + Д —О— Н |
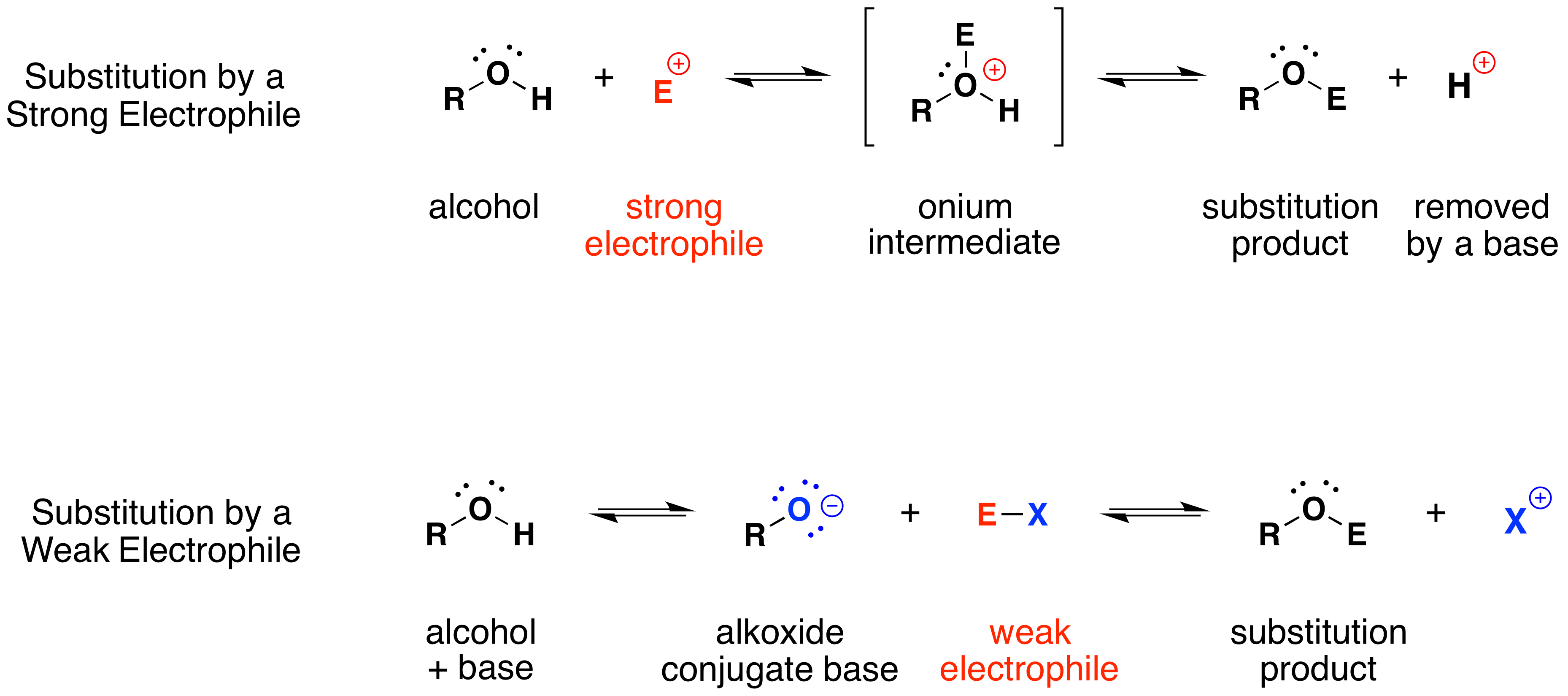
Механізм, за допомогою якого протікають ці реакції заміщення, простий. Атом кисню спирту нуклеофільний, тому він схильний реагувати з електрофілами. Отриманий проміжний «оній» потім втрачає протон до основи, утворюючи продукт заміщення. Якщо сильного електрофілу немає, то нуклеофільність кисню може посилюватися шляхом перетворення в його кон'югатну основу (алкоксид). Потім цей потужний нуклеофіл реагує зі слабкими електрофілами. Ці дві варіації механізму заміщення проілюстровані на наступній схемі.
Синтез ефіру Вільямсона
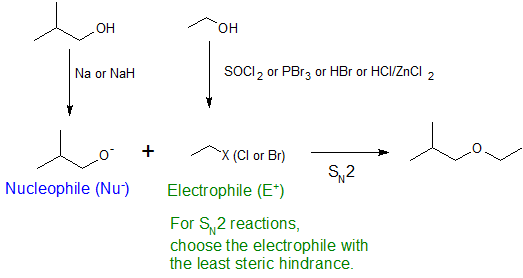
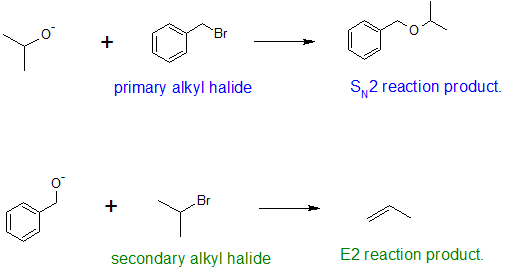
Алкілзаміщення гідроксильної групи створює ефіри. Ця реакція дає приклади як сильного електрофільного заміщення (перше рівняння нижче), так і слабкого електрофільного заміщення (друге рівняння). Остання реакція S N 2 відома як синтез ефіру Вільямсона і, як правило, використовується лише з 1º алкілгалогенідних реагентів, оскільки сильна основа алкоксиду призводить до елімінації Е2 з алкілгалогенідами 2º та 3º.
Вправа
16. Покажіть, як би ви використовували синтез ефіру Вільямсона для виготовлення 1-етокси-2-метилпропану з ізобутилового спирту та етанолу.
- Відповідь
-
16.