14.6: Реакції окислення спиртів
- Page ID
- 23465
Окислювачі
Зазвичай показаний окислювач - це розчин натрію або дихромата калію (VI), підкислений розведеною сірчаною кислотою. Якщо відбувається окислення, помаранчевий розчин, що містить іони дихромату (VI), відновлюється до зеленого розчину, що містить іони хрому (III). Електронно-напіврівняння для цієї реакції дорівнює
\[ Cr_2O_7^{2-} + 14H^+ + 6e^- \rightarrow 2Cr^{3+} + 7H_2O \tag{17.7.1}\]
- К 2 С р 2О 7 дихромат калію
- CrO 3 Триоксид хрому
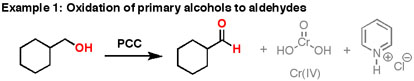
- Хлорохромат піридинію (PCC) - це більш м'яка версія хромової кислоти, яка підходить для перетворення первинного спирту в альдегід, не окислюючи його аж до карбонової кислоти. Цей реагент замінюється в лабораторіях періодінаном Dess‑Martin (DMP), який має ряд практичних переваг перед PCC, таких як отримання більш високих врожаїв і вимагає менш суворих умов реакції. DMP названий на честь Даніеля Деса і Джеймса Мартіна, який розробив його в 1983 році. Обидва реагенти використовуються поряд з Н 2, СО 4, Н 2 О.
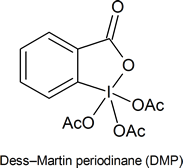
Первинні спирти
Первинні спирти можуть окислюватися або до альдегідів, або до карбонових кислот залежно від умов реакції. У разі утворення карбонових кислот спирт спочатку окислюється до альдегіду, який потім окислюється далі до кислоти.
Повне окислення до карбонових кислот
Потрібно використовувати надлишок окислювача і стежити, щоб альдегід, що утворився в міру напівфабрикату продукту, залишався в суміші. Спирт нагрівається під флюксом з надлишком окислювача. Коли реакція завершена, карбонова кислота переганяється. Повне рівняння окислення етанолу до етанової кислоти таке:
\[ 3CH_3CH_2OH + 2Cr_2O_7^{2-} + 16H+ \rightarrow 3CH_3COOH + 4Cr^{3+} + 11H_2O \tag{17.7.1}\]
Більш звичний спрощений варіант виглядає так:
\[ CH_3CH_2OH + 2[O] \rightarrow CH_3COOH + H_2O \tag{17.7.2}\]
Як варіант, можна було б написати окремі рівняння для двох стадій реакції - утворення етанолу з подальшим його окисленням.
\[ CH_3CH_2OH + [O] \rightarrow CH_3CHO + H_2O \tag{17.7.3}\]
\[ CH_3CHO + [O] \rightarrow CH_3COOH \tag{17.7.4}\]
Ось що відбувається на другому етапі:

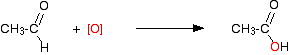
Часткове окислення до карбонових кислот

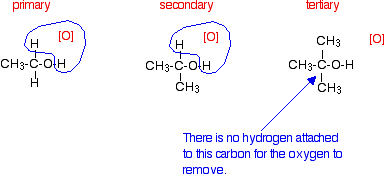
Вторинні спирти
Вторинні спирти окислюються до кетонів - і все. Наприклад, якщо підігріти вторинний спирт пропан-2-ол розчином дихромата натрію або калію (VI), підкисленим розведеною сірчаною кислотою, вийде утворився пропанон. Гра з умовами реакції не має ніякого значення для продукту. Використовуючи простий варіант рівняння і показуючи взаємозв'язок між структурами:


Якщо ви озирнетеся на другу стадію первинної спиртової реакції, ви побачите, що кисень «прорізаний» між вуглецем і воднем в альдегідній групі для отримання карбонової кислоти. При цьому такого водню немає - і реакції далі нікуди йти.
третинні спирти
Третинні спирти не окислюються підкисленим розчином натрію або дихромата калію (VI) - реакції немає. Якщо ви подивитеся на те, що відбувається з первинними і вторинними спиртами, ви побачите, що окислювач видаляє водень з групи -ОН, а водень з атома вуглецю, приєднаного до -ОН. Третинні спирти не мають атома водню, прикріпленого до цього вуглецю.
Ви повинні бути в змозі видалити ці два конкретних атоми водню, щоб встановити подвійний зв'язок вуглець-кисень.
Окислення первинних спиртів PCC - детальніше
Хлорохромат піридинію (PCC) є більш м'якою версією хромової кислоти. 
PCC окислює спирти одним ступенем вгору по сходах окислення, від первинних спиртів до альдегідів і від вторинних спиртів до кетонів. На відміну від хромової кислоти, PCC не буде окислювати альдегіди до карбонових кислот. Схожий на або такий же, як:\(CrO_3\) і піридин (реагент Коллінза) також окислює первинні спирти до альдегідів. Ось два приклади PCC в дії.
- Якщо додати один еквівалент PCC до будь-якого з цих спиртів, ви отримаєте окислену версію. Побічними продуктами (ознаками сірого кольору) є Cr (IV), а також гідрохлорид піридинію.
- Потрібно бути обережним з кількістю води, присутньої в реакції. Якби вода була присутня, вона може додати альдегіду, щоб зробити гідрат, який може бути додатково окислений другим еквівалентом PCC, якщо він присутній. Це не викликає занепокоєння з кетонами, оскільки немає Н безпосередньо пов'язаного з С.
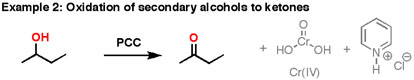
Як це працює? Реакції окислення такого роду насправді є своєрідною реакцією елімінації. Ми переходимо від одного зв'язку вуглець-кисень до подвійного зв'язку вуглець-кисень. Реакція елімінації може відбутися тому, що ми ставимо хорошу групу виходу на кисень, а саме хром, який буде витіснений, коли сусідній зв'язок С-Н розривається з основою.
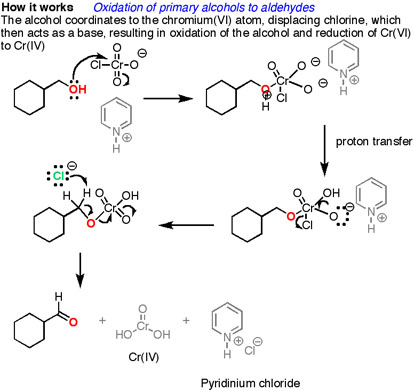
На першому етапі кисень на хромі вступає в реакцію з гідроксигрупою спирту, утворюючи зв'язок Cr-O. По-друге, протон на (тепер позитивний) ОН переноситься в один з киснів хрому, можливо, через посередництво солі піридинію. Потім іон хлориду витісняється в реакції, що нагадує реакцію елімінації 1,2, утворюючи те, що відомо як ефір хромату.
Подвійний зв'язок C-O утворюється, коли основа видаляє протон на вуглець, що прилягає до кисню. [осторонь: Я намалював основу як Cl - хоча, звичайно, є й інші види, які також можуть виступати в якості основи тут (наприклад, алкоголь). Також можна використовувати піридин як основу тут, хоча лише дуже низькі концентрації депротонованої форми будуть присутні в цих кислих умовах.] Електрони з зв'язку C-H рухаються, утворюючи зв'язок C-O, і в процесі розривають зв'язок O-Cr, і Cr (VI) стає Cr (IV) в процесі (намальований тут як O=Cr (OH) 2).
Примітки з реального життя: Якщо ви в кінцевому підсумку використовуєте PCC в лабораторії, не забудьте додати молекулярні сита або целіт або якусь іншу тверду речовину на дно колби, тому що в іншому випадку ви отримаєте неприємну коричневу смолу, яка є справжнім головним болем для очищення. Токсичність та безлад, пов'язані з хромом, стимулювали розвиток інших альтернатив, таких як TPAP, IBX, DMP та безліч інших акуратних реагентів, про які ви, як правило, не дізнаєтеся до закінчення школи.
Приклади
Вправи
11. Намалюйте спирт, з якого були б отримані наступні кетони/альдегіди, якщо б окислюватися. Який окислювач можна використовувати?
(а) (б)
(б)
12. Показані продукти окислення 1-пропанолу і 2-пропанолу хромовою кислотою у водному розчині.
- Відповідь
-
11. Будь-який окислювач, здатний окислювати спирт до кетону, буде працювати, наприклад, реагент Джонса (CrO 3, H 2 SO 4, H 2 O), PCC або періодінан Dess-Martin.
(а)

(b) Оскільки це первинний спирт, існують деякі запобіжні заходи, необхідні для уникнення утворення карбонової кислоти. Більш м'які окислювачі, такі як періодінан Dess-Martin, а також PCC (немає води для утворення карбонової кислоти) працювали б.

12. Відповіді співвідносяться з питанням.