6.1: Хиральність
- Page ID
- 23606
Мета навчання
- розпізнавати і класифікувати молекули як хіральні або ахіральні і ідентифікувати площини симетрії
Стереоізомери - це ізомери, які відрізняються просторовим розташуванням атомів, а не порядком атомної зв'язності. Одним з найцікавіших їх типів ізомерів є стереоізомери дзеркального зображення, непереборний набір двох молекул, які є дзеркальним відображенням один одного. Існування цих молекул визначається поняттям, відомим як хіральність.
Вступ
Органічні сполуки, молекули, створені навколо ланцюга атома вуглецю (більш відомий як вуглецевий кістяк), відіграють важливу роль у хімії життя. Ці молекули отримують своє значення з енергії, яку вони несуть, головним чином у формі потенційної енергії між атомними молекулами. Оскільки така потенційна сила може бути широко вплинута через зміни в розміщенні атомів, важливо зрозуміти поняття ізомера, молекули, що розділяє таку ж атомну складову, як інша, але відрізняється структурним розташуванням. Дана стаття буде присвячена конкретним ізомерам під назвою стереоізомери і його властивості хиральності (рис. 1).
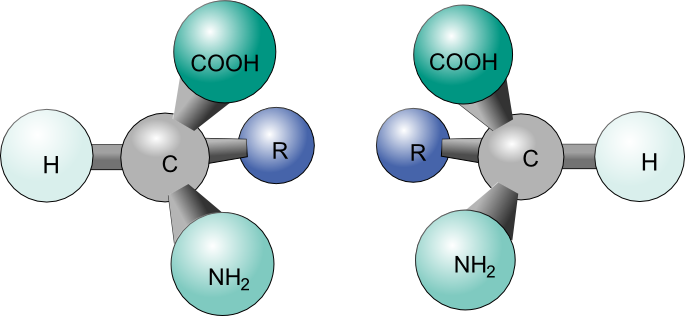
Поняття стероїзомерії та хіральності мають велике значення в сучасній органічній хімії, оскільки ці ідеї допомагають зрозуміти фізичні та теоретичні причини утворення та структури численних органічних молекул, основної причини енергії, вбудованої в ці необхідні хімічні речовини. На відміну від більш відомої конституційної ізомерії, яка розвиває ізотопні сполуки просто різними атомними зв'язками, стереоізомерія, як правило, підтримує рівні атомні зв'язки та порядки будівельних блоків, а також має однакову кількість атомів і типів елементів.
Що ж робить стереоізомери такими унікальними? Щоб відповісти на це питання, учень повинен вміти мислити і уявляти себе не просто двовимірними зображеннями, а й тривимірним простором. Це пов'язано з тим, що стереоізомери є ізомерами, оскільки їх атоми відрізняються від інших в плані просторового розташування.
Просторове розташування
Перш за все, потрібно розуміти поняття просторового розташування, щоб зрозуміти стереоізомерію і хіральність. Просторове розташування атомів стосується того, як різні атомні частинки і молекули розташовані в просторі навколо органічної сполуки, а саме її вуглецевого ланцюга. У цьому сенсі просторове розташування органічної молекули відрізняється іншим, якщо атом зміщений в будь-якому тривимірному напрямку навіть на один градус. Це відкриває дуже широку можливість різних молекул, кожна з яких має своє унікальне розміщення атомів у тривимірному просторі.
стереоізомери
Стереоізомери, як уже згадувалося вище, містять різні типи ізомерів всередині себе, кожен з яких має різні характеристики, які додатково відокремлюють один одного як різні хімічні утворення, що мають різні властивості. Тип під назвою ентаніомер - це раніше згадані стереоізомери дзеркального зображення, і вони будуть детально пояснені в цій статті. Інший тип, діастереомер, має різні властивості і буде введений згодом.
Багато синонімів хірального вуглецю
Майте на увазі - всі наступні терміни можуть бути використані для опису хірального вуглецю.
хіральний вуглець = асиметричний вуглець = оптично активний вуглець = стерео вуглець
енантіомери
Цей тип стереоізомеру є істотним дзеркально-зображним, непереборним типом стереоізомеру, введеного на початку статті. На малюнку 3 представлений прекрасний приклад; зверніть увагу, що сіра площина посередині знищує дзеркальну площину.
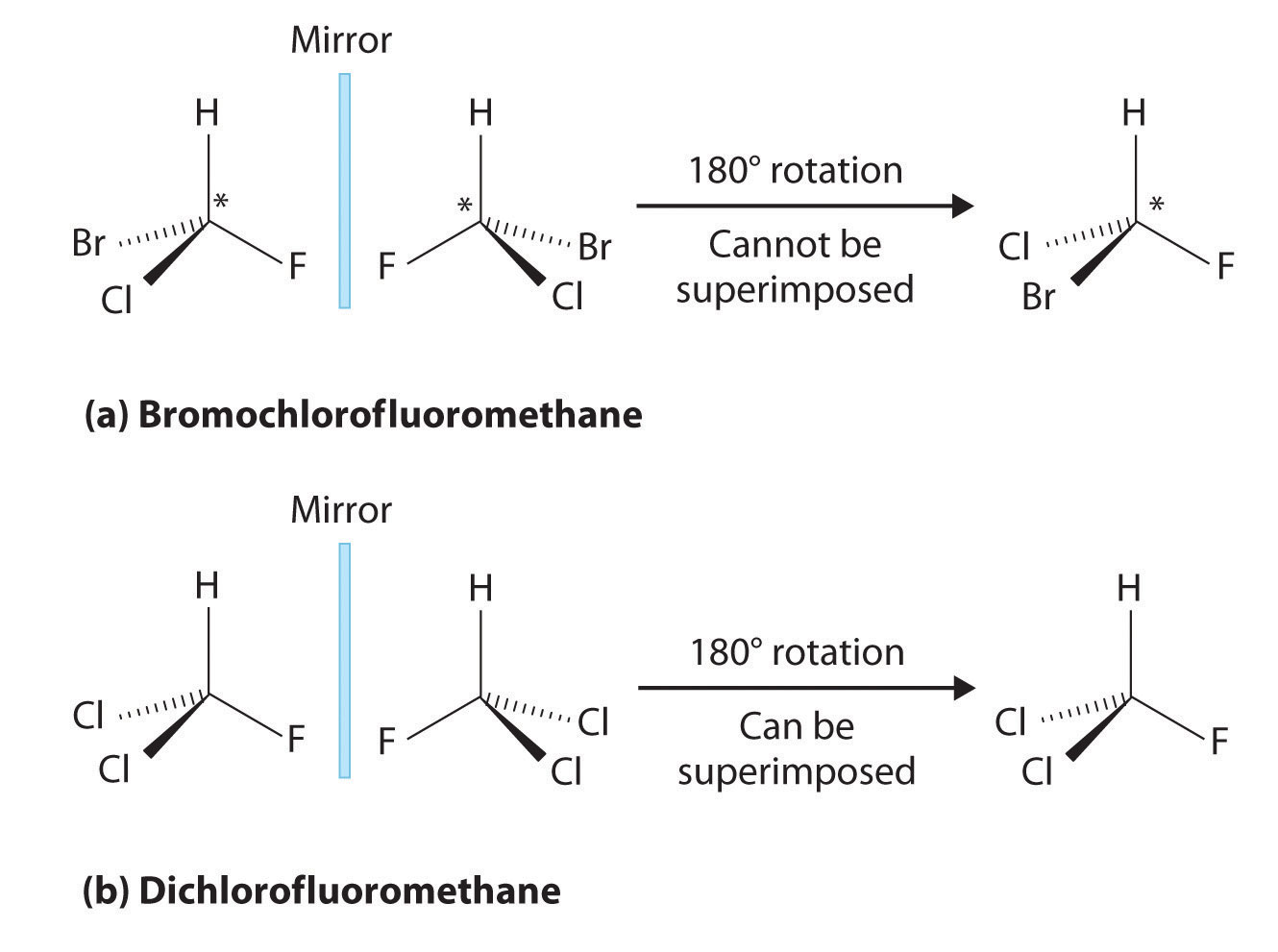
Зверніть увагу, що навіть якщо перевернути ліву молекулу праворуч, атомне просторове розташування не буде рівним. Це еквівалентно відносинам лівої руки - правої руки, і влучно називають «передаванням» в молекулах. Це може бути дещо неінтуїтивно зрозумілим, тому ця стаття рекомендує читачеві спробувати приклад «руки». Покладіть обидві долоні вгору, а руки поруч один з одним. Тепер переверніть обидві сторони на іншу. Одна рука повинна бути показана тильною стороною руки, в той час як інша показує долоню. Вони не однакові і непереборні.
Ось де концепція хіральності входить як одна з найважливіших та визначальних ідей стереоізомерії.
хіральність
Хіральність по суті означає «дзеркальне зображення, неналежні молекули», і сказати, що молекула є хіральною, означає сказати, що її дзеркальне відображення (воно повинно мати одне) не те саме, що вона сама. Чи є молекула хіральною чи ахіральною, залежить від певного набору умов перекриття. На малюнку 4 показаний приклад двох молекул, хіральної та ахіральної відповідно. Зверніть увагу на виразну характеристику ахіральної молекули: вона має два атоми одного елемента. У теорії та реальності, якщо створити площину, яка проходить через два інших атоми, вони зможуть створити те, що відомо як бісекційна площина: Зображення по обидва боки плану такі ж, як і інші (рис. 4).
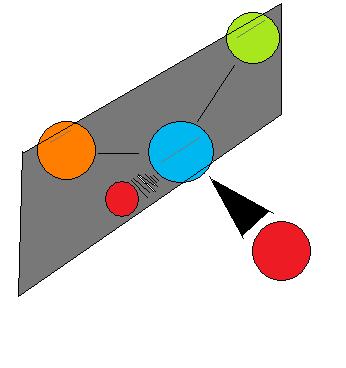
У цьому випадку молекула вважається «ахіральною». Іншими словами, щоб відрізнити хіральну молекулу від ахіральної молекули, потрібно шукати існування бісекційної площини в молекулі. Всі хіральні молекули позбавлені бісекційної площини, будь то простий або складний.
Як універсальне правило, жодна молекула з різними оточуючими атомами не є ахіральними. Хіральність - це проста, але важлива ідея для підтримки концепції стереоізомерії, яка використовується для пояснення одного типу свого роду. Хімічні властивості хиральної молекули відрізняються від її дзеркального відображення, і в цьому полягає значення хилярности по відношенню до сучасної органічної хімії.