5.4: Ізомерія
- Page ID
- 18669
Цей розділ піде про ізомерію в координаційних сполуках. Ви можете знати ізомерію вже з ваших занять органічної хімії. Тут ми застосуємо ізомерію до координаційної хімії. Деякі форми ізомерії в органічній та координаційній хімії однакові, але є деякі форми ізомерії, які відбуваються лише в координаційній хімії.
Давайте спочатку коротко розглянемо визначення ізомерії: ізомерія - це коли два або більше сполук мають однакові емпіричні формули, але різні структури.
Визначення: Ізомерія
Коли два або більше сполук мають однакові емпіричні формули, але різні структури, їх називають ізомерами.
Ми розрізняємо два основних типи ізомеризмів: конституційний ізомерія і стереоізомерія. У чому різниця? У конституційній ізомерії зв'язки не знаходяться між однаковими атомами.
Визначення: Конституційні ізомери
У конституційних ізомерах зв'язки не знаходяться між однаковими атомами.
У стереоізомерії зв'язки знаходяться між одними і тими ж атомами, але ліганди знаходяться на різних координаційних ділянках.
Визначення: Стереоізомери
У стереоізомерах зв'язки знаходяться між однаковими атомами, але ліганди знаходяться на різних координаційних ділянках.
Форми конституційної ізомерії
Гідрат ізомерія
По-перше, давайте більш уважно розглянемо гідратну ізомерію. У гідратної ізомерії в одному ізомері водний ліганд знаходиться в першій координаційній сфері, а в іншому ізомері - у другій координаційній сфері. Молекула води у другій координаційній сфері визначається лише для твердого стану, але не в розчині. Це пояснюється тим, що в розчині молекула води стане частиною розчинника. Ось кілька прикладів гідратних ізомерів.
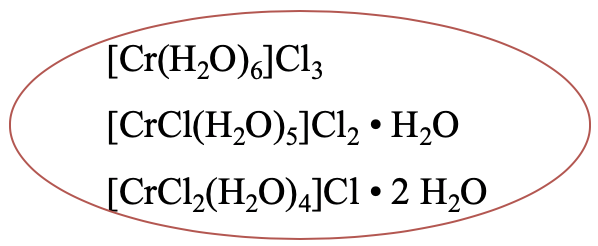
У комплексі [Cr (H 2 O) 6] Cl 3 знаходяться шість аква-лігандів в першій координаційній сфері (рис.5.4.1). В одному ізомері гідрату всього п'ять молекул води в першій координаційній сфері, шоста - у другій координаційній сфері. Один хлоридний аніон перемістився з другої в першу координаційну сферу. Існує третій ізомер гідрату, який має чотири аква-ліганди в першій координаційній сфері та дві молекули води у другій координаційній сфері. Два хлороліганди зараз знаходяться в першій координаційній сфері, а один - у другій координаційній сфері. Більше гідратних ізомерів було б можливо теоретично, але чомусь природа їх не робить.
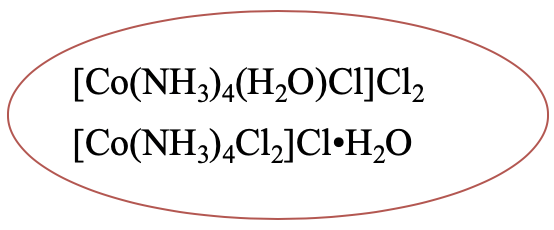
Іншим прикладом є [Co (NH 3) 4 (H 2 O) Cl] Cl 2. Він має гідратний ізомер, в якому один аква-ліганд перемістився в другу координаційну сферу, а один хлоридний аніон перемістився з другої в першу координаційну сферу (рис.5.4.2).
Іонізація Ізомерія
Друга форма ізомерії - ізомерія іонізації. При цьому іон рухається з першої в другу координаційну сферу і/або навпаки.

Наприклад, в з'єднанні [Co (NH 3) 5 NO 3] SO 4 є нітратний іон в першій координаційній сфері, а сульфат-іон - в другій координаційній сфері (рис.5.4.3). До цієї сполуки існує ізомер іонізації, в якому сульфат-іон зараз знаходиться в першій координаційній сфері, а нітрат - у другій координаційній сфері.
Координація ізомерії
Ще однією формою конституційної ізомерії є координаційна ізомерія. У цій ізомерії ліганди пов'язані з різними іонами металів. Природно, це означає, що дана форма ізомерії може існувати тільки в тому випадку, якщо хоча б один ізомер має два помітних іона металу.
Наприклад, з'єднання Pt (NH 3) 2 Cl 2 має два різних координаційних ізомери. На перший погляд вони зовсім не здаються ізомерами. Однак ми можемо переконатися, що вони мають ту ж емпіричну формулу, що і перша сполука (рис.5.4.4).
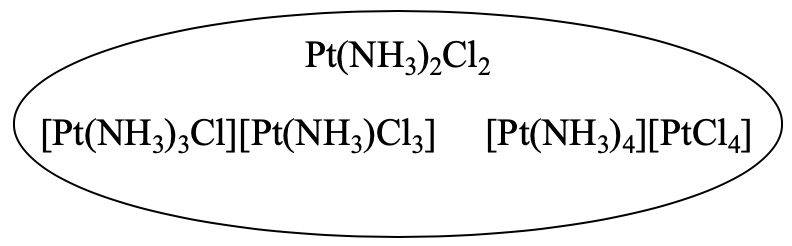
[Pt (NH 3) 3 Cl] [Pt (NH 3) Cl 3] має два атоми Pt, чотири одиниці NH 3 та чотири атоми Cl. Це робить Pt 2 (NH 3) 4 Cl 4. Цю формулу можна розділити на 2, щоб дати Pt (NH 3) 2 Cl 2. Тепер ми можемо легко побачити, що дві сполуки є ізомерами. Третій ізомер також має два атоми Pt, чотири одиниці NH 3 та чотири атоми хлору, тому він також повинен бути ізомером.
Чому вони координаційні ізомери? Це відбувається тому, що в першому комплексі всі ліганди пов'язані з одним і тим же атомом металу, тоді як в двох інших ліганди пов'язані з різними атомами металів. У цих сполуках один атом Pt належить до складного катіону, а інший - до складного аніону. У другому ізомері три амінових ліганда і один хлорліганд пов'язані з першим атомом Pt, а один амін і три хлороліганда пов'язані з другим атомом Pt. У третьому ізомері чотири амінових ліганди пов'язані з першим атомом платини, а чотири хлороліганда належать до другого атома платини.
Координаційна ізомерія можлива і для іонів металів різних елементів.
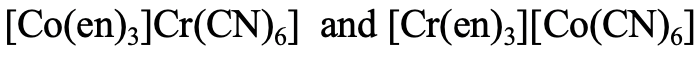
У наведеному прикладі (рис. 5.4.5) перший ізомер має пов'язаний з Co етилендіамін і ціанід, пов'язаний з Cr, тоді як у другому ізомері етилендіамін пов'язаний з Cr, а ціаноліганд пов'язаний з Co.
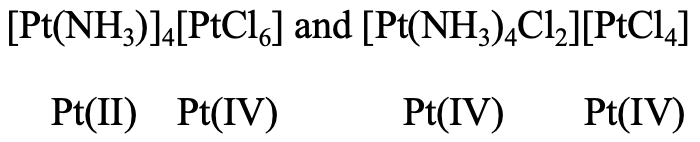
Далі, в координації ізомерів іони металів можуть перебувати в різних станах окислення. Ми бачимо, що в двох зображених ізомерах є складні катіони, і складні аніони з Pt в різних станах окислення (рис.5.4.6). У першому ізомері Pt (II) робить складний катіон, що має чотири амінових ліганди, прикріплені до нього. Pt (IV) є частиною комплексу аніону, оточеного шістьма хлорлігандами. У другому ізомері Pt (IV) утворює комплексний катіон, що має чотири амін і два хлороліганди в першій координаційній сфері, а Pt (II) утворює комплексний аніон, що має чотири хлороліганди.
Ізомерія зчеплення
Ізомерія зв'язків, яку також називають амбідентатною ізомерією, - це ізомерія, яку можна спостерігати для лігандів, які мають більше одного реактивного кінця. У двох зв'язкових ізомерах ліганди будуть зв'язуватися різними кінцями з металом. Який кінець є реактивним, залежить від ефективних взаємодій HOMO-LUMO. М'які донорські атоми мають тенденцію зв'язуватися з м'якими металами, а тверді донорські атоми мають тенденцію зв'язуватися з твердими металами Також велику роль може зіграти розчинник.
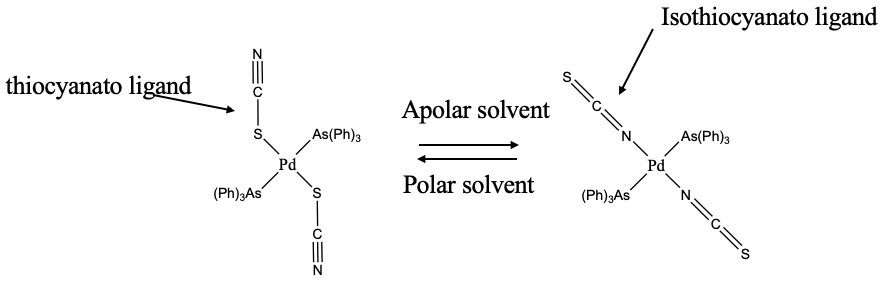
Прикладом амбідентатного ліганда є тіоціанатний аніон (рис.5.4.7). Він може зв'язуватися або з сіркою, або з азотним кінцем до іона металу. Коли він зв'язується з S-кінцем, його називають тіоціанато-лігандом, коли він зв'язується з N-кінцем, його називають ізотіоціанато лігандом. Який атом зв'язується з металом, може залежати від розчинника. У наведеному прикладі тіоцианат зв'язується з S до Pd в полярних розчинниках, але з N в полярних розчинниках. Ми могли б спробувати раціоналізувати чому. Можливість полягає в тому, що в полярних розчинниках більш електронегативний атом N може брати участь у водневому зв'язку, що неможливо в аполярних розчинниках. Стеричні аргументи також можуть зіграти певну роль. Ви можете бачити, що ліганди трифеніл арсин досить громіздкі. Коли ліганд зв'язується з азотом, то він зв'язується лінійно, уникаючи стеричного втручання з одним з арсинових лігандів. Так може бути, що в аполярних розчинниках стеричні взаємодії домінують в поведінці, тоді як в полярних розчинниках розчинник-ліганд взаємодії знаходяться під контролем.
Можливо навіть, що два, однакові амбідентатні ліганди зв'язуються протилежними кінцями з металом в одній і тій же молекулі.
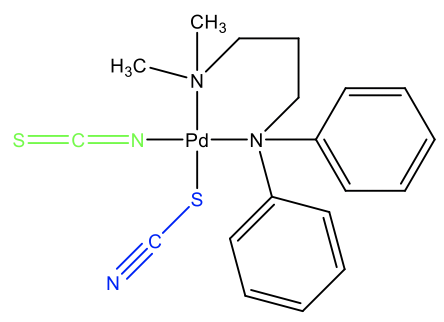
Прикладом може служити показаний комплекс (рис.5.4.8). У цій молекулі є тіоціанато і ізоціанато ліганд, що зв'язується з Pd. Які аргументи ми мали б пояснити цей амбідентний ізомерія? Подумайте про це на мить. Ми бачимо, що дві метильні групи набагато менш громіздкі, ніж дві фенільні групи. Коли тіоцианат зв'язується з S-атомом, то він може відігнатися від двох громіздких фенільних груп. Другий тіоціанатний аніон зв'язується з атомом N, оскільки між метильними групами та лінійним ізотіоціанатним лігандом немає значних перешкод. Така поведінка вказує на те, що термодинамічно взаємодія Pd-N сильніша, але лише трохи сильніша, оскільки інші фактори, такі як стеричні перешкоди, можуть легко змінити поведінку.
Тіо- і ізотіоціанато ліганди - не єдині приклади амбідентатних лігандів.
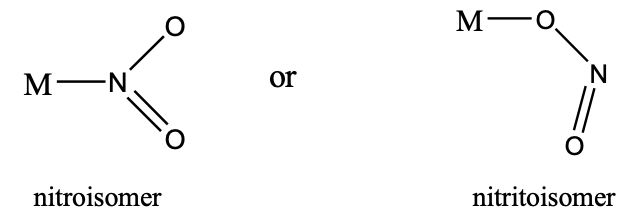
Інший приклад - нітрит-аніон. Він може або зв'язуватися з N- кінцем або O-кінцем з металом. У першому випадку він називається нітроізомером, в останньому називається нітритоізомером (рис.5.4.9). Нітритоізомери, як правило, більш стабільні.
Стереоізомери (конфігураційні ізомери)
Тепер обговоримо другий основний тип ізомерії: стереізомерія. Як згадувалося раніше, в стереоізомерії зв'язки знаходяться між тими ж атомами, але позиції, при яких зв'язуються ліганди, координаційні ділянки, різні. Існує два основних типи стереоізомерії: діастереомерія і енантіомерія (рис.5.4.10).
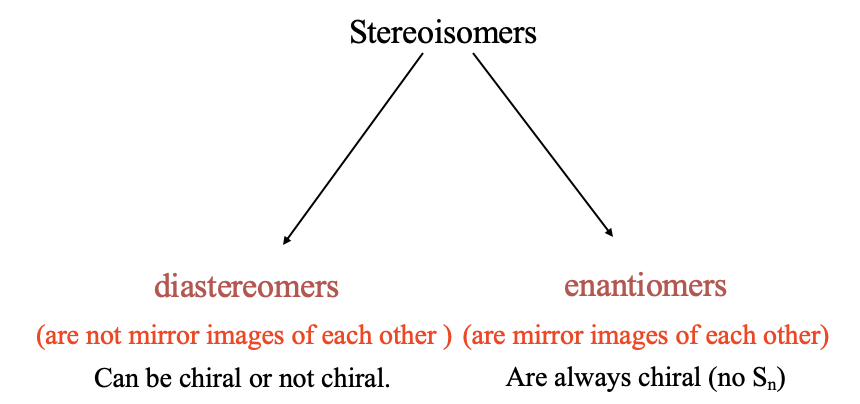
У діастереомерії діастереомери не є дзеркальним відображенням один одного.
Визначення: Діастереомери
Діастереомери - це стереоізомери, які не є дзеркальним відображенням один одного. Вони можуть бути хіральними або не хіральними.
В енантіомеризмі енантіомери є дзеркальним відображенням один одному. Енантіомери - це завжди хіральні молекули.
Визначення: енантіомери
Стереоізомери, які є дзеркальним відображенням один одного. Вони завжди хіральні.
Діастереомери можуть бути хіральними, але не обов'язково повинні бути хіральними. Пам'ятайте, молекула є хіральною, коли вона не має неправильної осі обертання.
Приклад - Діастереомери та енантіомери
Візьмемо приклад з органічної хімії, щоб проілюструвати різницю між енантіомерізмом та діастереомерізмом.
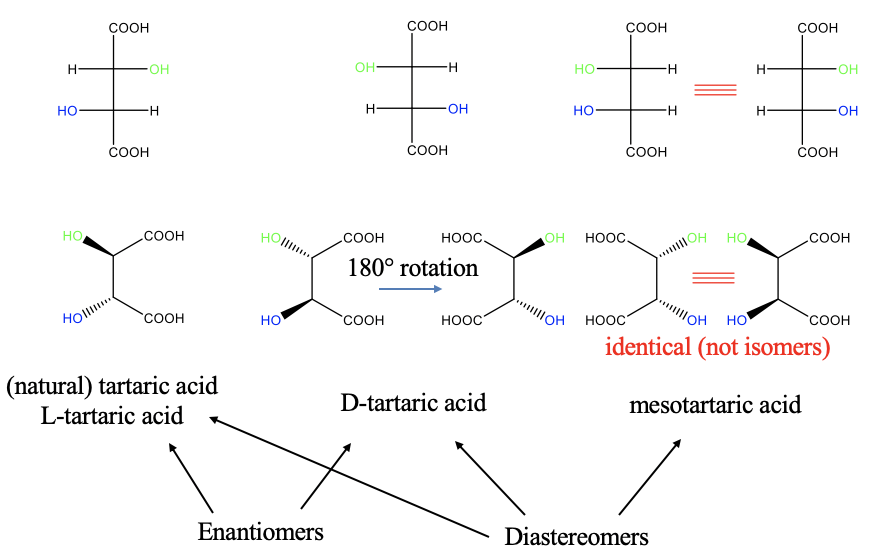
Вгорі (у верхньому лівому куті рис. 5.4.11) ви бачите проекцію Фішера ізомер сполуки, званої винною кислотою, вона називається L-винною кислотою. Перша група OH зверху вказує вліво, а друга вказує вправо. Це натуральна форма винної кислоти. Реальна структура L-винної кислоти зображена нижче (зліва внизу). Ви можете побачити групу OH, яка вказує праворуч у проекції Фішера, вказує на нас, тоді як інша, яка вказує ліворуч у проекції Фішера, вказує на нас.
У ізомері D-винної кислоти перша група ОН в проекції Фішера вказує вліво, а друга - вправо. Для реальної структури це означає, що перша OH-група вказує на нас, а друга вказує на нас. Ці два ізомери є дзеркальним відображенням один одного, і таким чином вони є енантіомерами. Можливо, ви не відразу побачите в реальній структурі, що ці два є дзеркальними зображеннями, але ви можете побачити це, коли обертаєте молекулу навколо осі зв'язку C-C так, щоб групи карбонових кислот вказували вліво (рис.5.4.11). Ви бачите це зараз?
Існує третій ізомер, який є так званою мезотартраріновой кислотою. Ми можемо намалювати його проекцію Фішера з обома групами OH, що вказують на праву сторону (рис.5.4.11). У реальній структурі тепер обидві гідроксо групи вказують на фронт. Чи є ця молекула дзеркальним відображенням однієї з двох попередніх молекул? Ні, це не так! Тому це діастеромер щодо двох інших. На перший погляд здається, що ми можемо намалювати іншу молекулу, яка є дзеркальним відображенням мезотатраринової кислоти. Він мав би дві гідроксогрупи, що вказують ліворуч у проекції Фішера, і дві гідроксогрупи, що вказують на нас у реальній структурі. Однак дві молекули можна обертати так, щоб вони накладалися, і тому вони є не ізомерами, а однаковими молекулами.
Ціс-транс-ізомерія
Давайте тепер обговоримо деякі поширені форми стереоізомерії. Цис-транс-ізомерія є одним дуже поширеним стереоізомерізмом. Він виникає, коли два, однакові ліганди знаходяться в сусідніх або протилежних положеннях. Наприклад, в квадратному площинному комплексі два ліганди можуть бути суміжними або в протилежних положеннях. Коли в сусідньому положенні, кут зв'язку становить 90°, і ми маємо цис-ізомер, коли в протилежному положенні кут зв'язку становить 180°, і ми маємо транс-ізомер.
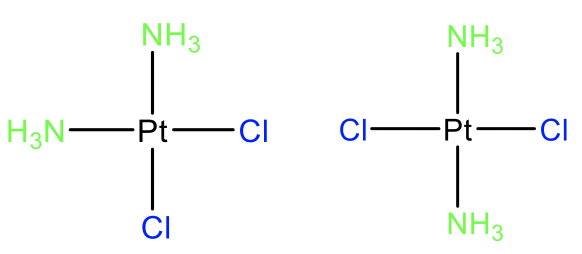
Ймовірно, найвідомішим прикладом цис-ізомера в координаційній хімії є цис-платина, яка є протираковим препаратом (рис. 5.4.12). Його транс-ізомери не мають цих фармацевтичних властивостей, показуючи, що цис-транс-ізомерія може мати глибокий вплив на властивості молекули. Загальна цис-транс-ізомерія в комплексах Pt (II) вивчалася найбільш інтенсивно, але цис-транс-ізомерія також відома іншими іонами металів d 8 в квадратних плоских комплексах. Ми також можемо запитати, чи цис- та транс-ізомери є діастереомерами або енантіомерами. Давайте розглянемо на прикладі цис- і транс-платини, щоб відповісти на це питання. Зрозуміло, що ці два ізомери не є дзеркальним відображенням один одного, тому вони повинні бути діастеромерами. Як правило, цис- і транс-ізомери є діастереомерами.
CIS-транс-ізомерія виходить за межі квадратних плоских комплексів, а також відомий іншими формами, наприклад, тригональної біпірамідної формою, і восьмигранної формою. У цис-ізомері восьмигранного комплексу два ліганди займають позиції на одній грані октаедра, тоді як в транс-ізомері вони займають протилежне положення октаедра.
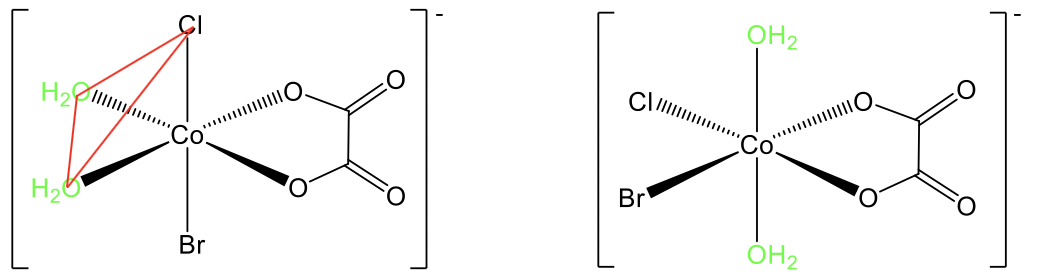
Наприклад, в комплексі діаквабромохлорооксалато кобальту (1-) є відомі цис і транс-ізомери (рис.5.4.13). У транс-ізомері два акваліганди стоять у протилежному положенні, а між ними є кут 180°. У цис-ізомері вони знаходяться в сусідньому положенні, а кут дорівнює 90°. Ми бачимо, що два ліганди знаходяться на одній трикутній грані октаедра, показаної червоним кольором.
Чи існують правила, які можуть допомогти нам вирішити, чи сформується цис- або транс-комплекс? Як ви можете підозрювати, найбільші ліганди зазвичай йдуть в транспозиції через стеричні аргументи відштовхування. Бідентатні ліганди зазвичай утворюють цис-ізомер, оскільки бідентатні ліганди зазвичай призначені для виготовлення п'яти- або шестичленних кілець з іоном металу. Чи є цис-транс-ізомери хіральними? Якщо ліганди прості, то їх зазвичай немає, але якщо вони більш складні, то можуть бути. У цьому контексті потрібно сказати, що ідеальні структури спостерігаються рідко. Наприклад, квадратний плоский комплекс рідко є ідеальною квадратною площиною, наприклад, тому що кути зв'язку можуть бути дещо спотворені від кута 90° через те, що ліганди мають нерівні стеричні вимоги. Невелике спотворення насправді може видалити один або багато елементів симетрії, що призводить до хиральності, однак такі невеликі відхилення зазвичай ігноруються.
Ізомерія Fac-MER
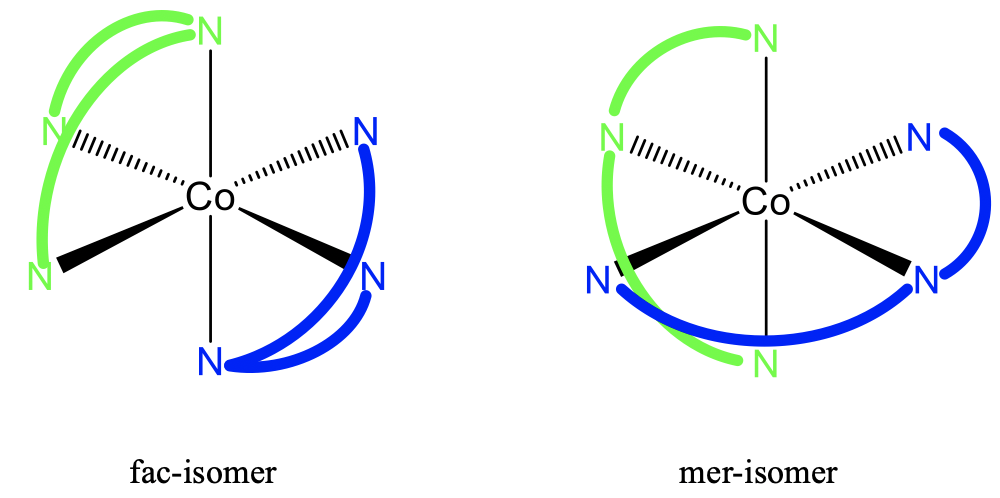
Ще одним поширеним типом стереоізомерії в координаційній хімії є фак-мер-ізомерія. Обличчя позначає обличчя та більше позначає meridional. У fac-ізомері ті ж ліганди знаходяться на загальній грані багатогранного комплексу, в мер-ізомері вони знаходяться на площині, яка розсікає багатогранник. Цей вид ізомерії дуже поширений для восьмигранних комплексів, але не обмежується такими.

Наприклад, комплекс триаммін трихлор-кобальт (III) має фак- і мер-ізомер. Ви можете бачити, що в fac-ізомері однакові ліганди знаходяться на двох протилежних трикутних гранях октаедра. У мер-ізомерах вони лежать на двох площинях, які розсікають октаедр. Ми можемо знову запитати, чи це діастереомери чи енантіомери? Відповідь: Вони не є дзеркальними відображеннями один для одного, тому вони не енантіомери, а діастереомери.
Ізомерія Fac-mer з тризубчастими лігандами
Ізомерія Fac-mer також поширена для октаедричних комплексів з тризубчастими лігандами, наприклад ліганду діетилентріаміну (рис.5.4.15).
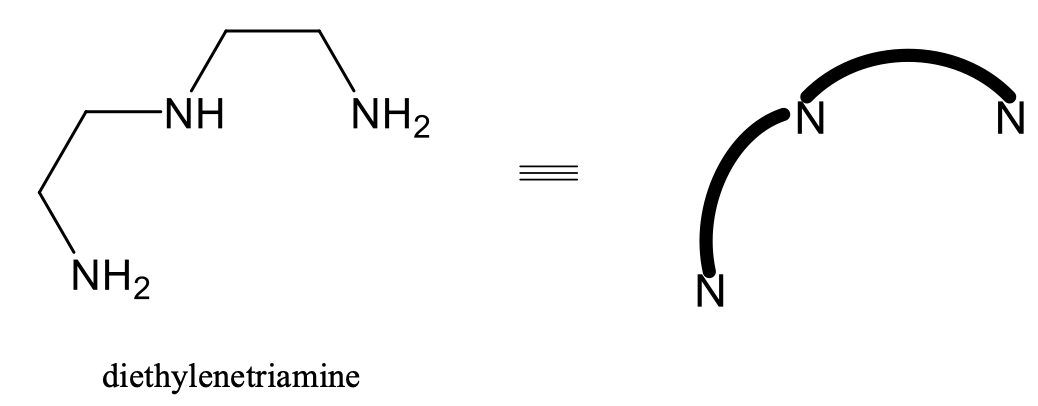
У цьому ліганді дві групи NH 2 і одна група NH з'єднані між собою двома етиленовими одиницями. З міркувань наочності в комплексах з цим лігандом часто зображується тільки N-донорний атом груп NH 2 і NH, а одиниці етилендіамміну спрощені у вигляді зігнутих ліній, що з'єднують N-атоми. Використовувати це спрощення ми будемо в наступному (рис.5.4.16).
Наведемо приклад біс (діетилентріамін) комплексів кобальту, які є фак-мер-ізомерами (рис.5.4.16). Один етилендіамінний ліганд показаний зеленим кольором, інший показаний синім кольором. Ви можете бачити, що лівий ізомер - це фак-ізомер з усіма трьома донорними атомами ліганду, розміщеними на одній грані октаедра. З правого боку знаходиться мер-ізомер, причому всі донорські атоми одного і того ж ліганду розміщені на площині, які бісекціонують октаедр. Також в цьому випадку два ізомери не є дзеркальним відображенням і є діастеромерами один до одного.
Триетилентетрамін комплекси
Існує ізомерія, подібна до фак-мерної ізомерії в октаедричних комплексах з тетрадентатним лігандом триетилентетраміну (рис.5.4.17).
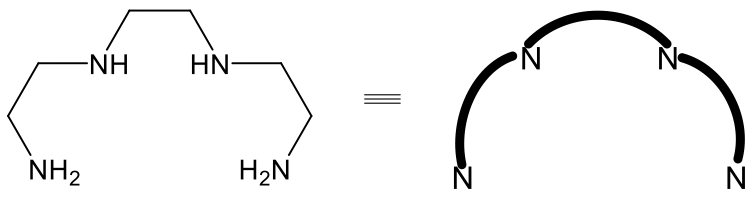
У цьому ліганді дві групи NH і дві групи NH 2 з'єднані чотирма етиленовими групами. Ми можемо знову зобразити ліганд у спрощеному вигляді, просто показуючи атоми-донори N та спростивши групи етилену у вигляді зігнутих ліній.
Однією з можливостей реалізувати восьмигранний комплекс з триетилентетраамінними лігандами є орієнтування всіх трьох кілець в одній площині, можна також сказати, що у нас є восьмигранний комплекс з трьома компланарними кільцями. Це показано нижче (рис.5.4.18).
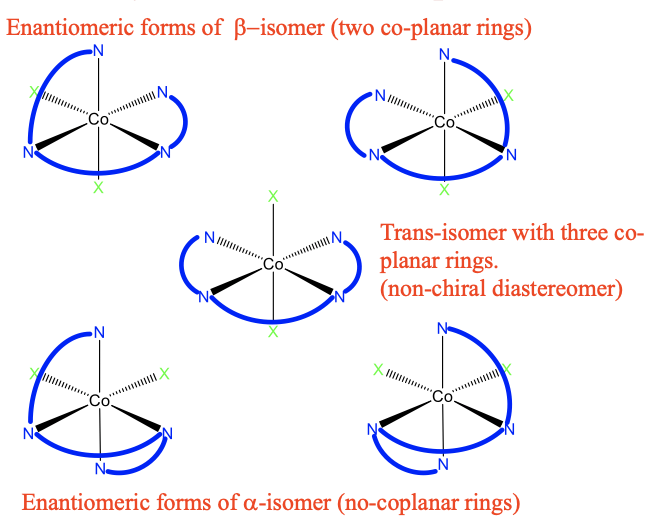
Три одиниці етилендіаміну складають три п'ятичленні кільця, які є спільними площинними один до одного. N-атоми займають загалом чотири вершини октаедра. Є два інших загальних ліганди X, розташовані в протилежних вершині октаедра. Тому цей ізомер називають транс-ізомером.
Ми можемо запитати, чи є ця молекула хіральною? Відповідь ні, тому що є дзеркальна площина, яка є спільною з трьома п'ятичленними кільцями. Крім цього транс-ізомера, існують також два цис-ізомери, один називається α -ізомером, інший називається β -ізомером. У β -ізомері зараз є тільки два співплощинних кільця, третє тепер поза площиною. Два ліганди X знаходяться в цис-положенні відносно один одного. Чи є транс-ізомер діастереомером або енантіомером до β -ізомеру? Вони явно не дзеркальні відображення один одному, тому повинні бути діастеромерами. Це β -ізомер хіральний? Так, це так! Немає неправильної осі обертання. Тому енантіомер повинен існувати, і цей енантіомер повинен бути дзеркальним відображенням β -форми. Ось воно! Природно, він також повинен мати два ко-плоских кільця, і два ліганда X в цис-позиції. Тому він також вважається β-ізомером.
Тепер обговоримо α -ізомерію. У α -ізомері більше немає двох лігандів співпланарних. Цей ізомер є діастеромером до транс- і β -форми, оскільки ізомери не є дзеркальними зображеннями. Також α -ізомер є хіральним. Тому повинен бути ще один α -ізомер, який є дзеркальним відображенням першого α -ізомера. Вона показана в правому нижньому кутку малюнка 5.4.18.
Номенклатура для пропелерних комплексів
Комплекси з двома і більше некомпланарними кільцями, які не є суміжними, завжди є хіральними і називаються «пропелерними комплексами». Існує спеціальна номенклатура пропелерних комплексів, про яку ми коротко розповімо далі.
Давайте спочатку розберемося, чому ці комплекси є пропелерними комплексами? Вони називаються так тому, що некомпланарні кільця орієнтовані відносно один одного аналогічно лопатям гвинта. Пропелер повинен мати принаймні дві лопаті, але також може мати більше, ніж це. Ми розрізняємо так звані гвинти для лівої руки та праворучні гвинти. Ліворукий гвинт має властивість віддалятися від вас в середовищі, як повітря або вода при обертанні проти годинникової стрілки.
Визначення: Ліворукий пропелер
Обертання проти годинникової стрілки переміщує лівий гвинт
Правий гвинт віддаляється від вас при обертанні за годинниковою стрілкою.
Визначення: Праворукий гвинт
Обертання за годинниковою стрілкою рухає правий гвинт
Кінчик однієї лопаті лівостороннього гвинта описує ліву спіраль, коли вона рухається, кінчик лопаті правостороннього гвинта описує правосторонній спіраль, як він віддаляється.
Визначення ручності «пропелерних комплексів»
Як ми можемо визначити подачу молекули пропелера? Визначимо його на прикладі трис (оксалато) феррату (III) аніону. Рис.5.4.19.
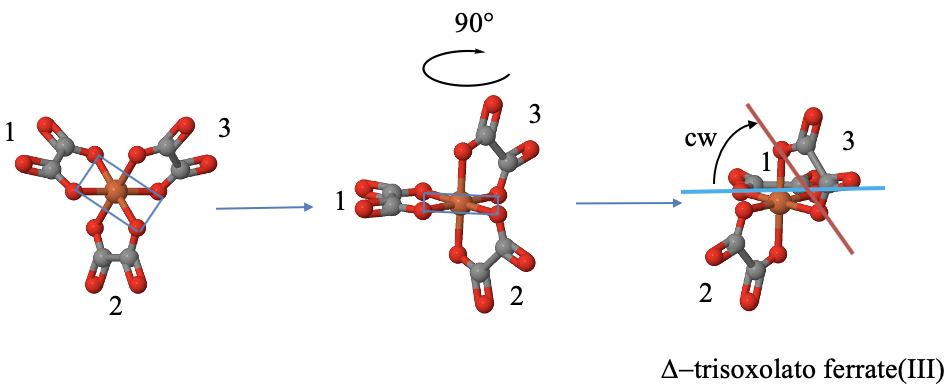
Це трилопатева молекула гвинта, оскільки вона має три п'ятичленні кільця між трьома оксолато лігандами та центром заліза. Кожне кільце вважається лезом. Жодне з кілець не є спільними площинними, і жодне з них не є суміжним, що означає, що кільця не мають донорського атома.
Для того щоб визначити ручність, ми можемо спочатку повернути молекулу так, щоб одне з кілець було орієнтоване горизонтально і вказувало на спину. Якщо у нас немає тривимірної моделі, нам потрібно зробити це в нашій свідомості. Як тільки це буде досягнуто, ми можемо провести горизонтальну лінію між двома донорськими атомами цього кільця. Далі ми можемо провести лінію між двома донорськими атомами іншого кільця. При необхідності подовжуємо лінію так, щоб лінія перетинала горизонтальну лінію. Далі визначаємо найменший кут між двома лініями, і обертаємо негоризонтальну лінію, поки вона не стане горизонтальною. Ми можемо це зробити тільки в своєму розумі. Якщо нам потрібно обертатися проти годинникової стрілки, то пропелер вважається лівостороннім, ми називаємо його\(\Lambda\) -ізомером. Якщо нам потрібно обертати за годинниковою стрілкою, то гвинт правосторонній, ми називаємо його\(\Delta\) -ізомер.
Визначення віддачі для молекул гвинта, що вимагають більше однієї етикетки
У деяких випадках координаційні сполуки мають множинні несуміжні, некомпланарні кільцеві комбінації, і для кожної комбінації необхідно визначати подачу. Прикладами можуть служити восьмигранні комплекси ЕДТА.
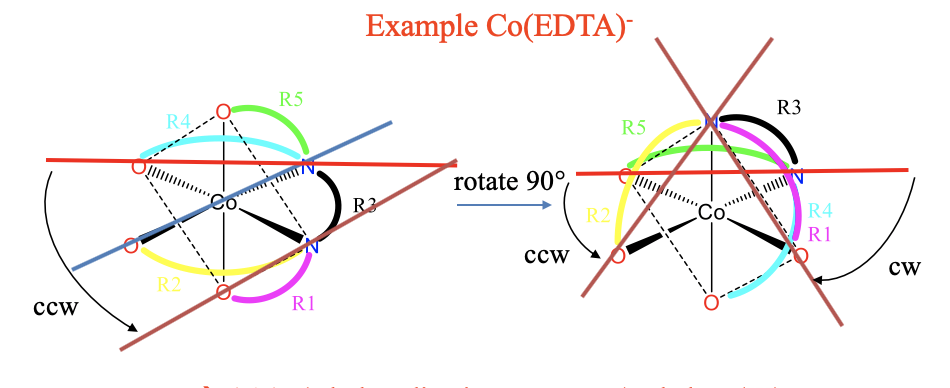
У цих комплексах є загалом п'ять різних кілець, які ми можемо позначити R1 до R5. Ви можете побачити різні кільця в різних кольорах (рис. 5.4.20) Для наочності ми скорочили зв'язки між атомами-донорами зігнутими лініями в різних кольорах. Кожен колір являє собою інший компонувальник, що робить різне кільце.
Ми розуміємо, що кільце R3 ділиться з усіма іншими кільцями, тому воно сусідить з усіма іншими кільцями і не потребує розгляду. R1 примикає до R2, а R3, але не суміжна і не співпланарна з R4 і R5. Тому потрібно розглянути комбінації R1-R4 і R1-R5. Далі R2 є компланарним з R3 і R4, і примикає до R3, але не є компланарним і не примикає до R5. Тому нам також потрібно розглянути комбінацію R2-R5. R4 і R5 є суміжними, тому розглядати цю комбінацію не потрібно. Ми знайшли всі необхідні нам комбінації.
Нам тепер потрібно повернути комплекс так, щоб одне відповідне кільце було орієнтоване горизонтально і вказувало на спину. Ми можемо, наприклад, вибрати кільце R4. На щастя, вже правильно орієнтований. Далі ми можемо з'єднати донорські атоми кільця R4 для отримання горизонтальної лінії. Тепер проведемо лінію між донорськими атомами кільця R1. Ми бачимо, що нам потрібно повернути горизонтальну лінію проти годинникової стрілки, щоб зробити її паралельною цій лінії, таким чином кільцева комбінація R1-R4\(\Lambda\) - це конфігурація.
Далі ми можемо визначити передачу R1-R5, спочатку переорієнтувавши молекулу так, щоб R5 вказував на спину. R1 також може бути обраний. Однак R5 є частиною двох відповідних кільцевих комбінацій, і тому ми можемо вбити двох птахів одним каменем, якщо виберемо R5. Ми можемо перемістити кільце R5 назад, обертаючи 90° проти годинникової стрілки навколо синьої осі, показаної на рис. 5.4.20. In проходить через атом O, атом кобальту та атом N. Ця вісь стоїть перпендикулярно квадрату, позначеному пунктирними лініями. Квадрат має чотири донорські атоми на чотирьох вершині, і ці донорські атоми рухаються на 90° проти годинникової стрілки під час обертання. Орієнтація кілець слідує за рухом донорських атомів. О-донорський атом кільця R5 рухається так, що R5 тепер горизонтальний, і вказує на спину. Далі ми можемо з'єднати між собою донорські атоми R5 і донорські атоми R1 лініями. Ми бачимо, що горизонтальну лінію потрібно повертати за годинниковою стрілкою так, щоб вона стала паралельною іншій. Тому конфігурація R1-R5\(\Delta\) - це конфігурація.
Для визначення комбінації R2-R5 комплекс не потрібно переорієнтувати заново. Ми можемо безпосередньо провести лінію через донорські атоми R2, і визначити напрямок обертання. Цього разу нам потрібно знову повернути проти годинникової стрілки, тобто комбінація R2-R5 знаходиться в\(\Lambda\) -конфігурації.
Загалом, ми маємо λΔλ- (етилендіамінтетрацетато) кобальтат (III). Зверніть увагу, що порядок позначення довільний, ми могли б назвати молекулу a λΔ-комплекс або Δλλ-комплекс також.
Вправа
Попрактикуємо це ще на одному прикладі.
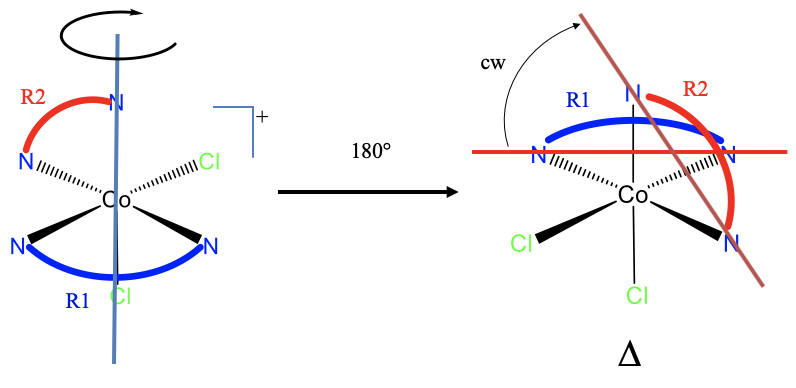
У чому проявляється врученість комплексу? Перш за все: чи відповідає він критеріям пропелерного комплексу? Відповідь - так. Є два кільця, R1 і R2, і вони обидва не компланарні, і несуміжні.
Щоб визначити ручність, нам потрібно спочатку перемістити молекулу так, щоб одне кільце було орієнтоване горизонтально і вказувало на спину. Ми могли б вибрати будь-який з них, але здається простіше повернути кільце R1, яке вказує спереду і орієнтується горизонтально на 180° навколо осі, яка визначається одним N і на атом Cl (показано синім кольором на рис. 5.4.21)), і орієнтована вертикально. Це обертання переміщує один з донорських атомів іншого кільця на 180°, що визначає нову орієнтацію кільця. Тепер ми можемо провести горизонтальну лінію через атом донора кільця 1, а лінію через донорські атоми кільця R2. Ми бачимо, що ми повинні обертатися за годинниковою стрілкою, а комплекс гвинтів праворуч.
Кільцеві Конформації
Крім ізомерії, також конформеризм впливає на структуру координаційного з'єднання. Для конкретного ізомеру може бути два або більше конформерів. Як приклад розглянемо кільце між іоном металу і етилендіаміновим лігандом (рис.5.4.22).
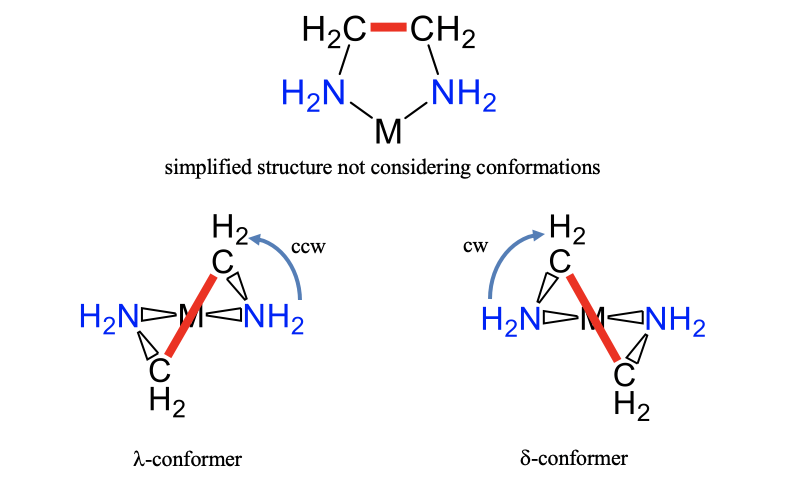
На відміну від часто використовуваних спрощених зображень, він не є площинним, через sp 3 -гібридизації атомів вуглецю і азоту. Можливі дві різні конформації, які відрізняються орієнтацією зв'язку C-C всередині кільця. Вони показані вище (рис.5.4.22). У конформації, показаній ліворуч, ми повинні обертати горизонтальну лінію думки, що проходить через два атоми донора азоту проти годинникової стрілки, щоб вона стала паралельною зв'язку C-C. Для іншого конформера нам потрібно повернути думку горизонтальну лінію за годинниковою стрілкою. Перший конформер ми називаємо\(\lambda\) -конформером, а другий\(\delta\) - конформером. У цьому випадку ми використовуємо малі літери для позначення конформеризму, а не ізомерії.
