17.6: Корозія
- Page ID
- 22482
- Визначте корозію
- Перерахуйте деякі методи, що застосовуються для запобігання або уповільнення корозії
Корозія зазвичай визначається як деградація металів внаслідок електрохімічного процесу. Освіта іржі на залізі, тьмяність на сріблі та синьо-зелена патина, яка розвивається на міді - все це приклади корозії. Загальна вартість корозії в США значна, з оцінками понад півтрильйона доларів на рік.
Статуя Свободи - визначна пам'ятка, яку визнає кожен американець. Статую Свободи легко ідентифікувати за висотою, стійкою і унікальним синьо-зеленим кольором. Коли ця статуя була вперше доставлена з Франції, її зовнішній вигляд не був зеленим. Він був коричневим, колір його мідної «шкіри». Так як же Статуя Свободи змінила кольори? Зміна зовнішнього вигляду стало прямим результатом корозії. Мідь, яка є основним компонентом статуї, повільно піддавалася окисленню з повітря. Окислювально-відновні реакції металу міді в навколишньому середовищі відбуваються в кілька етапів. Метал міді окислюється до оксиду міді (I) (\(\ce{Cu_2O}\)), який є червоним, а потім до оксиду міді (II), який є чорним.
\[\ce{2Cu(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)}} \nonumber \]
\[\ce{Cu2O(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{black}}{\ce{2CuO(s)}} \nonumber \]
Вугілля, в якому часто було багато сірки, інтенсивно спалювалося на початку минулого століття. В результаті триоксид сірки, вуглекислий газ і вода все вступили в реакцію з\(\ce{CuO}\).
\[\ce{2CuO(s)}+\ce{CO2(g)} + \ce{H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_2CO3(OH)2(s)}} \nonumber \]
\[\ce{3CuO(s)}+\ce{2CO2(g)}+\ce{H2O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)_2(OH)2(s)}} \nonumber \]
\[\ce{4CuO(s)}+\ce{SO3(g)}+\ce{3H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_4SO_4(OH)6(s)}} \nonumber \]
Ці три сполуки відповідають за характерну синьо-зелену патину, яку ми бачимо сьогодні. На щастя, утворення патини створило захисний шар на поверхні, запобігаючи подальшу корозію мідної обшивки. Освіта захисного шару - це форма пасивації, про яку йдеться далі в наступному розділі.
Мабуть, найбільш звичним прикладом корозії є утворення іржі на залізі. Залізо буде іржавіти, коли воно піддається впливу кисню і води. Основні етапи іржавіння заліза, як видається, передбачають наступне. Потрапивши в атмосферу, залізо швидко окислюється.
\[\textrm{anode: }\ce{Fe}_{(s)} \rightarrow \ce{Fe^{2+}}_{(aq)}+\ce{2e^-}\;\;\; E^\circ_{\ce{Fe^{2+}/Fe}}=\mathrm{−0.44\: V} \nonumber \]
Електрони зменшують кисень у повітрі в кислих розчинами.
\[\textrm{cathode: }\ce{O}_{2(g)}+\ce{4H^+}_{(aq)}+\ce{4e^-} \rightarrow \ce{2H_2O}_{(l)}\;\; E^\circ_{\ce{O_2/O_2}}=\mathrm{+1.23\; V} \nonumber \]
\[\textrm{overall: }\ce{2Fe}_{(s)}+\ce{O}_{2(g)}+\ce{4H^+}_{(aq)} \rightarrow \ce{2Fe^{2+}}_{(aq)}+\ce{2H_2O}_{(l)} \;\;\;E^\circ_\ce{cell}=\mathrm{+1.67\; V} \nonumber \]
Те, що ми називаємо іржею, - це гідратований оксид заліза (III), який утворюється, коли іони заліза (II) далі реагують з киснем.
\[\ce{4Fe^{2+}}_{(aq)}+\ce{O}_{2(g)}+(4+2x)\ce{H_2O}_{(l)} \rightarrow \ce{2Fe_2O_3} \cdot x\ce{H_2O}_{(s)}+\ce{8H^+}_{(aq)} \nonumber \]
Кількість молекул води є змінним, тому воно представлено x. На відміну від патини на міді, утворення іржі не створює захисного шару і тому корозія заліза триває, оскільки іржа відшаровується і піддає свіже залізо атмосфері.
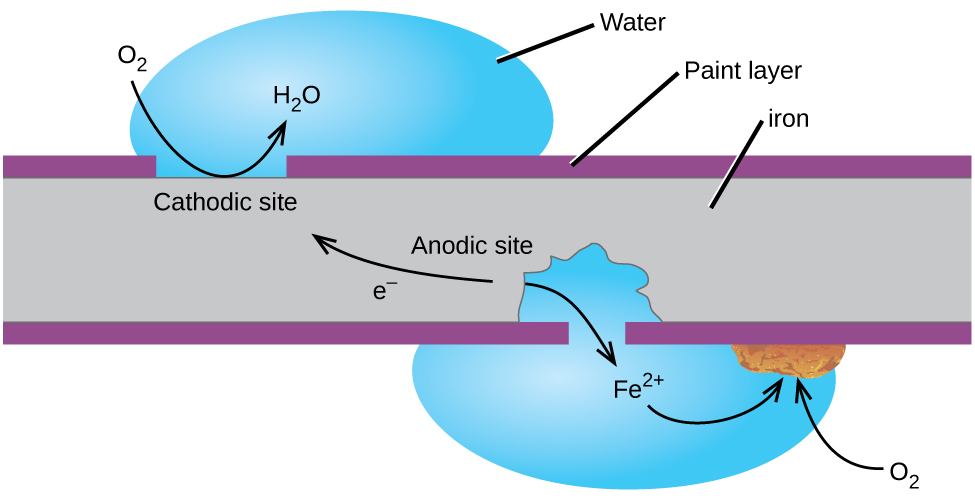
Один із способів уберегти залізо від корозії - тримати його пофарбованим. Шар фарби запобігає потраплянню води та кисню, необхідного для утворення іржі, з праскою. Поки фарба залишається цілою, праска захищена від корозії.
Інші стратегії включають легування заліза іншими металами. Наприклад, нержавіюча сталь - це переважно залізо з невеликою кількістю хрому. Хром має тенденцію збиратися біля поверхні, де утворює оксидний шар, який захищає залізо.
Оцинковане або оцинковане залізо використовує іншу стратегію. Цинк легше окислюється, ніж залізо, оскільки цинк має менший потенціал відновлення. Оскільки цинк має менший потенціал відновлення, він є більш активним металом. Таким чином, навіть якщо цинкове покриття подряпається, цинк все одно буде окислюватися перед праскою. Це говорить про те, що такий підхід повинен працювати з іншими активними металами.

Ще один важливий спосіб захисту металу - зробити його катодом в гальванічному елементі. Це катодний захист і може використовуватися для металів, відмінних від просто заліза. Наприклад, іржавіння підземних резервуарів та труб для зберігання заліза можна запобігти або значно зменшити, з'єднавши їх з більш активним металом, таким як цинк або магній. Це також використовується для захисту металевих деталей у водонагрівачах. Більш активні метали (менший потенціал відновлення) називаються жертовними анодами, оскільки вони звикають, коли вони роз'їдають (окислюються) на аноді. Захищається метал служить катодом, і тому не окислюється (не піддається корозії). Коли аноди належним чином контролюються та періодично замінюються, корисний термін служби резервуара для зберігання заліза може бути значно продовжений.
Резюме
Корозія - це деградація металу, викликана електрохімічним процесом. Щорічно витрачаються великі суми грошей на ремонт наслідків або запобігання корозії. Деякі метали, такі як алюміній і мідь, утворюють захисний шар при корозії на повітрі. Тонкий шар, який утворюється на поверхні металу, перешкоджає контакту кисню з більшою кількістю атомів металу і тим самим «захищає» залишився метал від подальшої корозії. Залізо роз'їдає (утворює іржу) при впливі води і кисню. Іржа, яка утворюється на металі заліза, відшаровується, оголюючи свіжий метал, який також роз'їдає. Одним із способів запобігання або уповільнення корозії є покриття металу. Покриття запобігає контакту води і кисню з металом. Фарба або інші покриття сповільнять корозію, але вони не ефективні після подряпин. Оцинковане або оцинковане залізо експлуатує той факт, що цинк швидше окислюється, ніж залізо. Поки покриття залишається, навіть якщо подряпати, цинк буде окислюватися перед праскою. Ще одним методом захисту металів є катодний захист. При цьому методі легко окислюється і недорогий метал, часто цинк або магній (жертовний анод), електрично з'єднаний з металом, який необхідно захистити. Більш активним металом є жертовний анод, і є анодом в гальванічному елементі. «Захищений» метал є катодом, і залишається неокисленим. Однією з переваг катодного захисту є те, що жертовний анод можна контролювати і замінювати при необхідності.
Глосарій
- катодний захист
- спосіб захисту металу за допомогою жертовного анода і ефективного виготовлення металу, який потребує захисту катода, запобігаючи тим самим його окислення
- корозії
- деградація металу за допомогою електрохімічного процесу
- оцинковане залізо
- метод захисту заліза шляхом покриття його цинком, який буде окислюватися перед залізом; оцинковане залізо
- жертовний анод
- більш активний, недорогий метал використовується в якості анода в катодному захисті; часто виготовляється з магнію або цинку
