8.4: Корозія та вибух
- Зрозумійте процес корозії.
- Зрозумійте процес вибуху.
Корозія - це гальванічний процес, в результаті якого метали руйнуються через окислення - зазвичай, але не завжди до їх оксидів. Наприклад, при впливі повітря залізо іржавіє, срібло тьмяніє, а мідь і латунь набувають синювато-зелену поверхню, звану патиною. З різних металів, схильних до корозії, залізо на сьогоднішній день є найважливішим у комерційному відношенні. За оцінками, 100 мільярдів доларів на рік витрачається лише в Сполучених Штатах на заміну залізовмісних об'єктів, зруйнованих корозією.
Вибухи можуть відбуватися в природі через великий приплив енергії. Більшість природних вибухів виникають внаслідок вулканічних процесів різного роду. Хімічні вибухи, як правило, включають швидку і бурхливу реакцію окислення, яка виробляє велику кількість гарячого газу. Порох був першим вибухівкою, який був виявлений і введений у використання. Іншими помітними ранніми розробками хімічної вибухової технології були розробка Фрідріхом Августом Абелем нітроцелюлози в 1865 році та винахід динаміту Альфреда Нобеля в 1866 році. Хімічні вибухи (як навмисні, так і випадкові) часто ініціюються електричною іскрою або полум'ям в присутності кисню. Випадкові вибухи можуть відбуватися в паливних баках, ракетних двигунів і т.д.
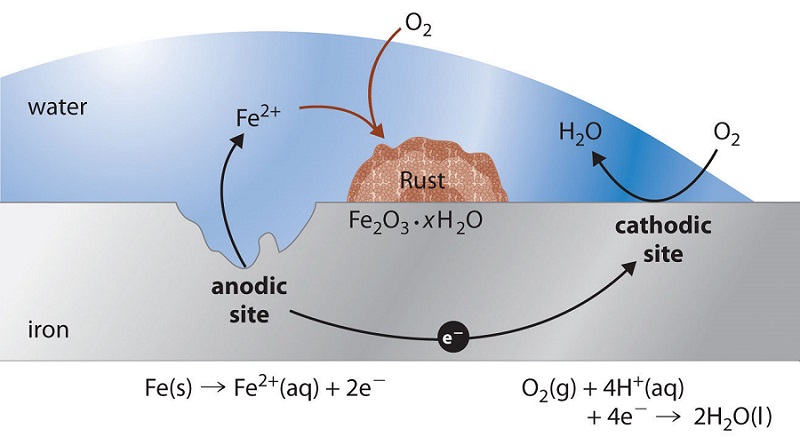
Іржавіння заліза
Мабуть, найбільш звичним прикладом корозії є утворення іржі на залізі. Залізо буде іржавіти, коли воно піддається впливу кисню і води. Основні етапи іржавіння заліза, як видається, передбачають наступне. Потрапивши в атмосферу, залізо швидко окислюється.
\ce{Fe(s) -> Fe^{2+}(aq) + 2e^{-}} \tag{cathode}
Електрони зменшують кисень у повітрі в кислих розчинами.
\ce{O2(g) + 4H^{+}(aq) + 4e^{-} -> 2H_2O(l)} \tag{anode}
\ce{2Fe(s) + O2(g) + 4H^{+}(aq) -> 2Fe^{2+}(aq) + 2H2O(l)} \tag{over all}
Те, що ми називаємо іржею, - це гідратований оксид заліза (III), який утворюється, коли іони заліза (II) далі реагують з киснем.
\ce{4Fe^{2+}(aq) + O2(g) + (4+2x)H2O(l) -> 2Fe2O3 \cdot x H2O(s) + 8H^{+}(aq)} \nonumber
Кількість молекул води є змінним, тому воно представлено x. На відміну від патини на міді, утворення іржі не створює захисного шару і тому корозія заліза триває, оскільки іржа відшаровується і піддає свіже залізо атмосфері.
Один із способів уберегти залізо від корозії - тримати його пофарбованим. Інші стратегії включають легування заліза іншими металами. Наприклад, нержавіюча сталь - це здебільшого залізо з невеликою кількістю хрому. Оцинковане або оцинковане залізо використовує іншу стратегію. Цинк легше окислюється, ніж залізо, оскільки цинк має менший потенціал відновлення. Оскільки цинк має менший потенціал відновлення, він є більш активним металом. Таким чином, навіть якщо цинкове покриття подряпається, цинк все одно буде окислюватися перед праскою. Це говорить про те, що такий підхід повинен працювати з іншими активними металами.
Статуя Свободи - визначна пам'ятка, яку визнає кожен американець. Статую Свободи легко ідентифікувати за висотою, стійкою і унікальним синьо-зеленим кольором. Коли ця статуя була вперше доставлена з Франції, її зовнішній вигляд не був зеленим. Він був коричневим, колір його мідної «шкіри». Так як же Статуя Свободи змінила кольори? Зміна зовнішнього вигляду стало прямим результатом корозії. Мідь, яка є основним компонентом статуї, повільно піддавалася окисленню з повітря. Окислювально-відновні реакції металу міді в навколишньому середовищі відбуваються в кілька етапів. Метал міді окислюється до оксиду міді (I) (\ce{Cu_2O}), який є червоним, а потім до оксиду міді (II), який є чорним.
\ce{2Cu(s)} +\ce{1/2 O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)} } \nonumber
\ce{Cu2O(s)} +\ce{1/2 O2(g)}\rightarrow \underset{\text{black}}{\ce{2CuO(s)} } \nonumber
Вугілля, в якому часто було багато сірки, інтенсивно спалювалося на початку минулого століття. В результаті триоксид сірки, вуглекислий газ і вода все вступили в реакцію з\ce{CuO}.
\ce{2CuO(s)} + \ce{CO2(g)} + \ce{H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu2CO3(OH)2(s)} } \nonumber
\ce{3CuO(s)} + \ce{2CO2(g)}+\ce{H2O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)2(OH)2(s)} } \nonumber
\ce{4CuO(s)} + \ce{SO3(g)}+\ce{3H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_4SO4(OH)6(s)} } \nonumber
Ці три сполуки відповідають за характерну синьо-зелену патину, яку ми бачимо сьогодні. На щастя, утворення патини створило захисний шар на поверхні, запобігаючи подальшу корозію мідної обшивки. Освіта захисного шару - це форма пасивації, про яку йдеться в інших місцях.

Срібні тьмяніють
Незважаючи на те, що монети металів, як відомо, стійкі до кисню в повітрі, срібло буде тьмяніти через\ce{H2S(g)}
\ce{2Ag(s) + H_2S(g) -> Ag2S(s) + H2(g)} \nonumber
Вибухові реакції
TNT є одним з найбільш часто використовуваних вибухових речовин для військових, промислових і гірничодобувних додатків. ТНТ був використаний спільно з гідравлічним розривом пласта, процесом, що використовується для видобутку нафти і газу з сланцевих пластів. Методика передбачає витіснення та детонування нітрогліцерину в гідравлічно індукованих переломах з подальшим пострілом свердловини з використанням гранульованого тротилу.
Тротил цінується частково через його нечутливість до ударів і тертя, зі зниженим ризиком випадкової детонації в порівнянні з більш чутливими вибуховими речовинами, такими як нітрогліцерин. Тротил плавиться при 80° C (176° F), набагато нижче температури, при якій він мимовільно детонує, дозволяючи його заливати або безпечно поєднувати з іншими вибуховими речовинами. ТНТ не поглинає і не розчиняється у воді, що дозволяє ефективно використовувати його у вологих середовищах. Для детонації тротил повинен спрацьовувати хвилею тиску від вибухової речовини стартера, званої вибуховим підсилювачем.
Хоча блоки тротила доступні в різних розмірах (наприклад, 250 г, 500 г, 1000 г), він частіше зустрічається в синергетичних вибухонебезпечних сумішах, що містять змінний відсоток тротилу плюс інші інгредієнти
При детонації тротил розкладається наступним чином:
\ce{2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C} \nonumber
\ce{2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C} \nonumber
Реакція екзотермічна, але має високу енергію активації в газовій фазі (~ 62 ккал/моль). Конденсовані фази (тверді або рідкі) показують помітно нижчі енергії активації приблизно 35 ккал/моль завдяки унікальним бімолекулярним шляхам розкладання при підвищеній щільності. Через виробництво вуглецю вибухи тротилового тротилу мають сажнистий вигляд. Оскільки тротил має надлишок вуглецю, вибухонебезпечні суміші з багатими киснем сполуками можуть давати більше енергії на кілограм, ніж лише тротил. Протягом 20 століття аматол, суміш тротилу з аміачною селітрою була широко використовуваною військовою вибуховою речовиною.
ТНТ може бути підірваний за допомогою ініціатора високої швидкості або шляхом ефективного струсу мозку. Протягом багатьох років ТНТ був орієнтиром для фігури нечутливості. ТНТ мав рейтинг рівно 100 за шкалою «F of I». Посилання з тих пір було змінено на більш чутливу вибухову речовину під назвою RDX, яка має F з I рейтинг 80.
ANFO (або AN/FO, для нітрату амонію/мазуту) є широко використовуваним об'ємним промисловим вибуховим речовиною. Його назва прийнято вимовляти як «ан-фо». Він складається з 94% пористої щебенової аміачної селітри (\ce{NH4NO3}) (AN), яка діє як окислювач і абсорбент для палива, і 6% мазуту № 2 (FO). Паливний компонент ANFO, як правило, дизельне паливо, але замість нього використовувався гас, вугільний пил, гоночне паливо або навіть патока. Дрібно порошкоподібний алюміній у суміші чутливий до його детонування легше.
Хімія детонації ANFO - це реакція аміачної селітри з довголанцюговим алканом (\ce{C_nH_{$2n+2$}}) з утворенням азоту, вуглекислого газу та води.
\ce{NH4NO3 + C_nH2_{$n+2$} → xN2 + yH2O + zCO2} \nonumber
В ідеальній стехіометрично збалансованої реакції ANFO складається з приблизно 94,3% AN і 5,7% FO по\ (\ ce {вага. На практиці додається невеликий надлишок мазуту, оскільки недозування призводить до зниження продуктивності, тоді як передозування лише призводить до більшої кількості парів після вибуху. Коли умови детонації оптимальні, вищезгадані гази є єдиними продуктами. При практичному використанні таких умов неможливо досягти, а вибухи виробляють помірну кількість токсичних газів, таких як окис вуглецю та оксиди азоту (NOx).
\ce{NH4NO3 + C_nH_{$2n+2$} → vCO + wNOx + yH2O + zCO2} \nonumber
ANFO знайшов широке застосування у видобутку вугілля, видобутку кар'єрів, видобутку металів та цивільному будівництві в додатках, де його низька вартість та простота використання можуть переважити переваги інших вибухових речовин, таких як водостійкість, кисневий баланс, вища швидкість детонації або продуктивність у колони малого діаметру. ANFO також широко використовується для пом'якшення лавинної небезпеки.
Резюме
- Корозія та вибух є двома основними окислювально-відновними процесами.
- Наведено приклади корозії (зносу металу) та вибуху (з використанням тротилу та АНФО).
Дописувачі та атрибуція
- Template:ContribOpenStax
- Template:ContribAgnewM
- TextMap: Chemistry-A Central Science (Brown et al.)
- Wikipedia