22.7: Корозія
- Page ID
- 24215
Важливим аспектом використання деяких металів, зокрема заліза, є можливість корозії. Підраховано, що приблизно одна сьома всього виробництва заліза йде на заміну втраченого корозії металу. Іржа, мабуть, є гідратованою формою оксиду заліза (III). Формула приблизно Fe 2 O 3 •\(\tfrac{\text{3}}{\text{2}}\) H 2 O, хоча точна кількість води є змінним. (Зверніть увагу, що це приблизно на півдорозі між гідроксидом заліза (III), Fe (OH) 3 або ½ {Fe 2 O 3 • 3H 2 O] та безводним Fe 2 O 3).
Для іржі потрібно як кисень, так і вода, і вона, як правило, прискорюється кислотами, деформаціями в залізі, контактом з менш активними металами, а також наявністю самої іржі. Крім того, спостереження за іржавим об'єктом, таким як залізний цвях зі старої дерев'яної будівлі, показує, що іржа буде осідати в одному місці (біля головки нігтя), тоді як найбільша втрата металевого заліза відбудеться в іншому місці (поблизу точки). Ці факти говорять про те, що механізм іржавіння передбачає гальванічний елемент. Задіяні піврівняння
\[\text{2Fe}(S) \rightarrow \text{2Fe}^{2+}(aq) + \text{4}e^-\label{1} \]
\[\text{4}e^- + \text{4H}^+(aq) + \text{O}_2(g) \rightarrow \text{2H}_2\text{O}\label{2} \]
поступаючись повною реакцією:
\[\text{2Fe}(s) + \text{4H}^+(aq) + \text{O}_2(g) \rightarrow \text{2Fe}^{2+}(aq) + \text{2H}_2\text{O}\label{3} \]
Після того, як Fe 2+ (aq) утворюється, він може вільно мігрувати через водний розчин в інше місце на поверхні металу. У цей момент залізо може випасти в осад:
\[\text{4Fe}(s) + \text{O}_2(g) + \text{7 H}_2\text{O}(l) \rightarrow \text{2Fe}_2\text{O}_3 \cdot \frac{3}{2} \text{H}_2\text{O}(s) + \text{8H}^+(aq) \nonumber \]
Іони водню, звільнені цією реакцією, потім частково споживаються рівнянням\(\ref{2}\). Електрони, необхідні для напіврівняння,\(\ref{2}\) подаються з Рівняння\(\ref{1}\) через металеву провідність через залізо або за допомогою іонної провідності, якщо водний розчин містить значну концентрацію іонів. При цьому залізо іржавіє швидше при контакті з солоною водою, ніж у прісній.
Запропонований в попередньому пункті механізм передбачає, що деякі ділянки поверхні заліза стають катодними, тобто, що там відбувається відновлення кисню до води. Інші місця є анодними; відбувається окислення Fe до Fe 2+. Головний спосіб, яким можуть бути створені такі регіони, залежить від обмеження надходження кисню, оскільки кисень необхідний для катодної реакції, показаної в Рівнянні\(\ref{2}\). Наприклад, у випадку із залізним цвяхом біля голови утворюється іржа, оскільки є більше кисню. Велика частина втрат металу відбувається глибоко в деревині, правда, поблизу точки цвяха. У цьому місці Рівняння\(\ref{1}\), але не\(\ref{2}\) може відбутися.
Аналогічна ситуація виникає, коли крапля вологи прилипає до залізної поверхні (рис.\(\PageIndex{1}\)). Піттинг відбувається поблизу центру краплі, в той час як гідратований оксид заліза (III) відкладається біля краю.
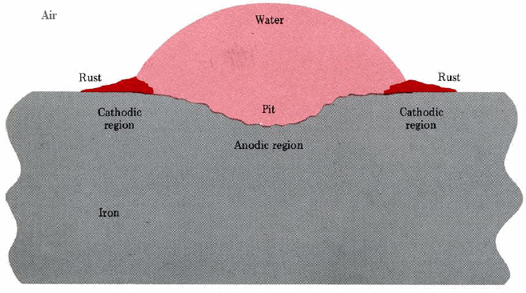
Другий спосіб, за допомогою якого можуть бути встановлені анодні та катодні області, передбачає наявність другого металу, який має більшу привабливість для електронів (менш легко окислюється), ніж залізо. Такий метал може стікати електрони, що залишилися в залізі при розчиненні Fe 2+. Цей надлишок електронів робить менш активний метал ідеальним місцем для рівняння\(\ref{2}\), і тому осередок встановлюється на перетині металів. Іржа може насправді покривати поверхню менш активного металу, тоді як ями утворюються в залізі.
Найголовніша методика запобігання іржі - просто виключити воду і кисень за допомогою захисного покриття. Це принцип, що лежить в основі мастила, змащення, фарбування або металевого покриття заліза. Покриття повинно бути повним, однак, інакше іржавіння може бути прискорене за рахунок виключення кисню з частини поверхні. Це особливо актуально, коли залізо покрито менш активним металом, таким як олово. Навіть щіпка в покритті на жерстяній банці дуже швидко іржавіє, оскільки олово стає катодним завдяки своєму більшому електродному потенціалу та виключенню кисню із заліза знизу.
Друга методика передбачає приведення залізного предмета в контакт з більш активним металом. Це називається катодним захистом, оскільки більш активний метал дарує електрони залізу, сильно гальмуючи Рівняння\(\ref{1}\). Як катодний захист, так і поверхневе покриття забезпечуються цинкуванням, процесом, при якому цинк покривається на сталь електролітичним способом або зануренням в розплавлений метал. Як і багато інших металів, цинк є самозахисним - він реагує з киснем і вуглекислим газом з повітря, утворюючи прилипле непроникне покриття гідроксикарбонату цинку, Zn 2 (OH) 2 CO 3. Якщо на цинковій пластині є подряпини, залізо все ще не може іржавіти, оскільки цинк буде переважно окислюватися. Утворився гідроксикарбонат потім покриє отвір, запобігаючи подальшому контакту кисню з залізом або цинком.
Третя методика застосовується до ситуацій (наприклад, автомобільного радіатора), коли водні розчини контактують із залізом. Інгібітори корозії включають хроматні солі та органічні сполуки, такі як трибнтиламін, (C 4 H 9) 3 N. Хромати, очевидно, утворюють непроникне покриття FeCrO 4 (s), як тільки будь-яке залізо окислюється до заліза (II). Трибутиламін, похідне аміаку, вступає в реакцію з органічними кислотами, що утворюються при розкладанні антифризу при високих температурах автомобільного двигуна. Вироблені солі трибутиламмонію нерозчинні і покривають внутрішню частину системи охолодження. Таким чином, трибутиламін нейтралізує кислоту, яка прискорить корозію і забезпечує поверхневе покриття, а також.
