16.8: Електрохімічна корозія
- Page ID
- 19173
Переконайтеся, що ви добре розумієте наступні основні ідеї. Особливо важливо, щоб ви знали точні значення всіх виділених термінів в контексті даної теми.
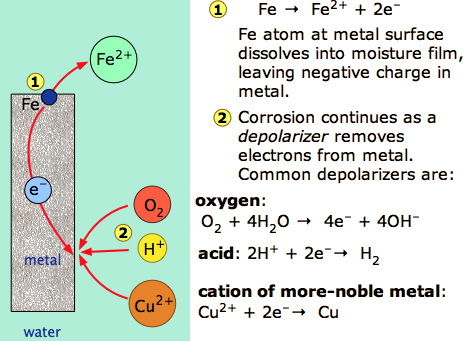
- Електрохімічна корозія металів виникає, коли електрони від атомів на поверхні металу переносяться на відповідний електронний акцептор або деполяризатор. Вода повинна бути присутньою, щоб служити середовищем для транспортування іонів.
- Найпоширенішими деполяризаторами є кисень, кислоти, катіони менш активних металів.
- Оскільки електрони протікають через сам металевий об'єкт, анодна і катодна області (дві половини електрохімічної комірки) можуть знаходитися в широко відокремлених місцях.
- Анодні області, як правило, розвиваються в місцях, де метал напружений або захищений від кисню.
- Контакт з іншим видом металу, як прямим, так і непрямим, може привести до корозії більш активного.
- Корозія сталі може гальмуватися цинкуванням, тобто покриттям її цинком, більш активним металом, розчинення якого залишає негативний заряд на металі, який гальмує подальше розчинення Fe 2+.
- Катодний захист із застосуванням зовнішнього джерела напруги широко використовується для захисту підземних споруд, таких як резервуари, трубопроводи та пірси. Джерелом може бути жертовний анод з цинку або алюмінію, або лінійний або фотоелектричний блок живлення.
Корозія може бути визначена як знос матеріалів хімічними процесами. З них найбільш важливою на сьогоднішній день є електрохімічна корозія металів, при якій процесу окислення М → М + е — сприяє наявність відповідного акцептора електронів, іноді згадуваного в науці про корозії деполяризатором.
У певному сенсі корозію можна розглядати як мимовільне повернення металів до своїх руд; величезна кількість енергії, яка споживалася при видобутку, переробці та виробництві металів у корисні об'єкти, розсіюється різними шляхами. Економічні аспекти корозії набагато більші, ніж більшість людей розуміють; орієнтовна вартість корозії лише в США становила 276 мільярдів доларів на рік. З цього близько 121 мільярда доларів було витрачено на боротьбу з корозією, залишивши різницю в 155 мільярдів доларів як чистий збиток для економіки. Комунальні послуги, особливо системи питної води та каналізації, зазнають найбільшого економічного впливу, при цьому автотранспортні засоби та транспорт є близькою секундою.
Корозійні клітини та реакції
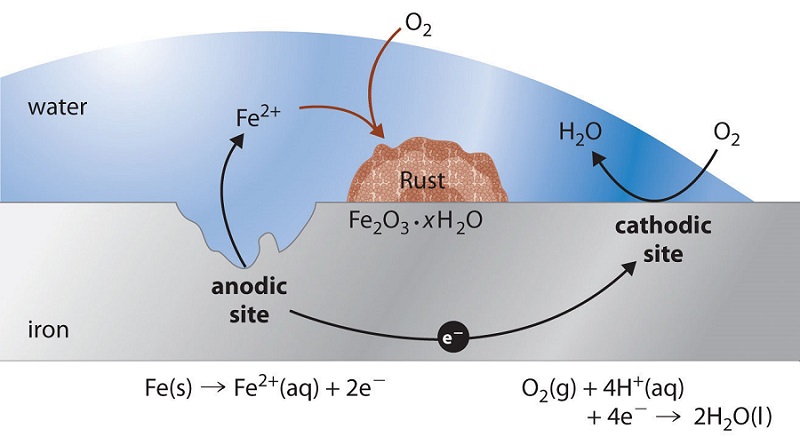
Особливою характеристикою більшості корозійних процесів є те, що етапи окислення і відновлення відбуваються в окремих місцях на металі. Це можливо тому, що метали є провідними, тому електрони можуть протікати через метал від анодної до катодної областей (рис.\(\PageIndex{1}\)). Наявність води необхідно для того, щоб транспортувати іони до і з металу, але тонкої плівки адсорбованої вологи може бути достатньо.
Корозійну систему можна розглядати як короткозамкнуту електрохімічну комірку, в якій анодний процес чимось схожий
\[\ce{Fe(s) \rightarrow Fe^{2+}(aq) + 2 e^{-}} \label{1.7.1}\]
і катодні кроки можуть включати зменшення кисню газу
\[ \ce{O_2} + \ce{2 H_2O} + \ce{4e^{-}} \rightarrow \ce{4 OH^{-}} \label{1.7.2}\]
або зменшення протонів
\[ \ce{H^{+} + e^{-}} \rightarrow \ce{1/2 H2(g)} \label{1.7.2b} \]
або зменшення іона металу
\[\ce{M^{2+} + 2 e^{–}} \rightarrow \ce{M(s)} \label{1.7.2c}\]
де\(\ce{M}\) знаходиться метал.
Які частини металу служать анодами та катодами, можуть залежати від багатьох факторів, як видно з нерегулярних моделей корозії, які зазвичай спостерігаються. Атоми в регіонах, які зазнали напруги, як це може бути вироблено при формуванні або механічній обробці, часто мають більш високі вільні енергії, і, таким чином, як правило, стають анодними.
Якщо одна частина металевого предмета захищена від атмосфери так, що її недостатньо\(\ce{O2}\) для побудови або підтримки оксидної плівки, ця «захищена» область часто буде місцем, на якому корозія найбільш активна. Те, що такі ділянки зазвичай приховані від очей, становить значну частину труднощів у виявленні та контролі корозії.

На відміну від анодних ділянок, які, як правило, локалізуються на конкретних ділянках поверхні, катодна частина процесу може відбуватися практично в будь-якому місці. Оскільки оксиди металів зазвичай є напівпровідниками, більшість оксидних покриттів не гальмують потік електронів на поверхню, тому практично будь-яка область, яка піддається впливу\(\ce{O2}\) або до якогось іншого акцептора електронів, може виступати катодом. Тенденція місць, позбавлених кисню, стати анодними, є причиною багатьох часто спостерігаються закономірностей корозії.
Іржаві автомобілі та плями для ванної кімнати
Кожен, хто володів старим автомобілем, бачив, як корозія виникає на стиках між частинами кузова та під плівками фарби. Ви також помітили, що як тільки починається корозія, вона має тенденцію харчуватися собою. Однією з причин цього є те, що одним з продуктів реакції відновлення О 2 є гідроксид-іон. Високий рН, що утворюється в цих катодних областях, має тенденцію руйнувати захисну оксидну плівку і навіть може пом'якшити або послабити плівки фарби, так що ці ділянки можуть стати анодними. Більший запас електронів сприяє більш інтенсивному катодному дії, яке породжує ще більше анодних ділянок і так далі.

Дуже поширеною причиною корозії є наявність двох різнорідних металів в контакті, як це може статися поблизу кріплення або на зварювальному з'єднанні. Волога збирається в місці з'єднання, виступаючи в ролі електроліту і утворюючи осередок, в якій два метали служать електродами. Волога і струмопровідні солі на зовнішніх поверхнях забезпечують зовнішній провідний шлях, ефективно коротко замикаючи осередок і виробляючи дуже швидку корозію; саме тому автомобілі так швидко іржавіють в місцях, де сіль кладуть на дороги, щоб розтопити лід.
Несхожа корозія металу може виникнути, навіть якщо два метали спочатку не знаходяться в безпосередньому контакті. Наприклад, в будинках, де для сантехніки використовується мідна трубка, завжди є невелика кількість розчиненого\(\ce{Cu^{2+}}\) у воді. Коли ця вода стикається зі сталевими трубопроводами або хромованим зливом раковини для ванної кімнати, більш благородна мідь буде пластинчастим на іншому металі, утворюючи нову корозійну комірку, що контактує з металами. У випадку з хромованою фурнітурою раковини ванної це призводить до утворення\(\ce{Cr^{3+}}\) солей, які випадають в осад у вигляді зеленуватих плям.
Контроль корозії
Оскільки для виникнення корозії повинні відбуватися як катодні, так і анодні кроки, запобігання будь-якого з них зупинить корозію. Найбільш очевидна стратегія - зупинити обидва процеси шляхом покриття об'єкта фарбою або іншим захисним покриттям. Навіть якщо це буде зроблено, швидше за все, знайдуться місця, де покриття зламано або не проникає, особливо якщо є отвори або гвинтові різьблення. Більш складним підходом є нанесення невеликого негативного заряду на метал, тим самим ускладнюючи реакцію:
\[\ce{M -> M^{2+} + 2 e^{-}}.\]
Спосіб захисту 1: Жертвенні покриття
Одним із способів подачі цього негативного заряду є нанесення покриття з більш активного металу. Таким чином, дуже поширеним способом захисту сталі від корозії є покриття її тонким шаром цинку; цей процес відомий як гальванізація. Цинкове покриття, будучи менш благородним, ніж залізо, має тенденцію до вибіркової корозії. Розчинення цього жертовного покриття залишає позаду електрони, які концентруються в залізі, роблячи його катодним і тим самим гальмуючи його розчинення.
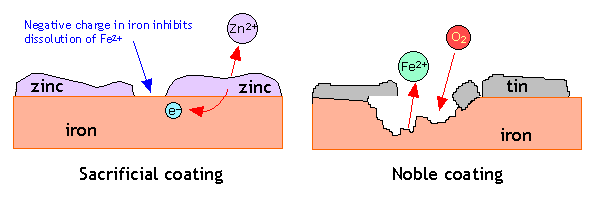
Ефект обшивки заліза менш активним металом забезпечує цікавий контраст. Звичайна бляшана банка (праворуч) - хороший приклад. Поки олов'яне покриття залишається цілим, все добре, але вплив навіть крихітної частини основного заліза у вологу атмосферу ініціює корозію. Електрони, що виділяються із заліза, надходять у олово, роблячи залізо більш анодним, тому тепер олово активно сприяє корозії заліза! Ви, напевно, спостерігали, як жерстяні банки дуже швидко розпадаються, коли їх залишають на відкритому повітрі.
Спосіб захисту 2: Катодний захист
Більш складна стратегія полягає в підтримці постійного негативного електричного заряду на металі, так що його розчинення як позитивні іони гальмується. Оскільки вся поверхня примусова в катодний стан, цей метод відомий як катодний захист. Джерелом електронів може бути зовнішній джерело живлення постійного струму (зазвичай використовується для захисту нафтопроводів та інших похованих конструкцій), або це може бути корозія іншого, більш активного металу, такого як шматок цинку або алюмінію, закопаного в землю поблизу, як показано на ілюстрації похованого резервуар для зберігання пропану нижче.

