14.2: рН і pH
- Page ID
- 22819
- Поясніть характеристику водних розчинів як кислих, основних або нейтральних
- Експрес-концентрації іонів гідронію та гідроксиду за шкалами рН та pH
- Виконайте розрахунки, що стосуються рН та pH
Як обговорювалося раніше, іони гідронію і гідроксиду присутні як в чистій воді, так і у всіх водних розчині, а їх концентрації обернено пропорційні, що визначаються іонним продуктом води (\(K_w\)). Концентрації цих іонів у розчині часто є критичними детермінантами властивостей розчину та хімічної поведінки інших його розчинених речовин, і для опису цих концентрацій у відносному вираженні була розроблена специфічна лексика. Розчин є нейтральним, якщо містить однакові концентрації іонів гідронію та гідроксиду; кислим, якщо він містить більшу концентрацію іонів гідронію, ніж гідроксидні іони; і основним, якщо він містить меншу концентрацію іонів гідронію, ніж гідроксидні іони.
Загальним засобом вираження величин, значення яких можуть охоплювати багато порядків, є використання логарифмічної шкали. Одна з таких масштабів, яка дуже популярна для хімічних концентрацій і констант рівноваги, заснована на p-функції, визначеної як показано, де «X» - це цікава величина, а «log» - логарифм base-10:
\[\mathrm{pX=−\log X} \label{1} \]
Отже, рН розчину визначається, як показано тут, де [H 3 O +] - молярна концентрація іона гідронію в розчині:
\[\mathrm{pH=-\log[H_3O^+]}\label{\(\PageIndex{2}\)} \]
Перевпорядкування цього рівняння для виділення молярності іонів гідронію дає еквівалентний вираз:
\[\mathrm{[H_3O^+]=10^{−pH}}\label{\(\PageIndex{3}\)} \]
Аналогічно, молярність гідроксид-іонів може бути виражена у вигляді p-функції, або pOH:
\[\mathrm{pOH=-\log [OH^−]}\label{\(\PageIndex{4}\)} \]
або
\[\mathrm{[OH^-]=10^{−pOH}} \label{\(\PageIndex{5}\)} \]
Нарешті, зв'язок між цими двома концентраціями іонів, вираженими у вигляді p-функцій, легко виводиться з\(K_w\) виразу:
\[K_\ce{w}=\ce{[H_3O^+][OH^- ]} \label{\(\PageIndex{6}\)} \]
\[-\log K_\ce{w}=\mathrm{-\log([H_3O^+][OH^−])=-\log[H_3O^+] + -\log[OH^-]}\label{\(\PageIndex{7}\)} \]
\[\mathrm{p\mathit{K}_w=pH + pOH} \label{\(\PageIndex{8}\)} \]
При 25° С значення\(K_w\) дорівнює\(1.0 \times 10^{−14}\), і так:
\[\mathrm{14.00=pH + pOH} \label{\(\PageIndex{9}\)} \]
Молярність іонів гідронію в чистій воді (або будь-якому нейтральному розчині) знаходиться\( 1.0 \times 10^{-7}\; M\) при 25° C, тому рН і pH нейтрального розчину при цій температурі становлять:
\[\mathrm{pH=-\log[H_3O^+]=-\log(1.0\times 10^{−7}) = 7.00} \label{10} \]
\[\mathrm{pOH=-\log[OH^−]=-\log(1.0\times 10^{−7}) = 7.00} \label{11} \]
І так, при цій температурі кислі розчини - це ті, у яких молярність іонів гідронію більша, ніж\( 1.0 \times 10^{-7}\; M\) і гідроксид-іонна молярність менше\( 1.0 \times 10^{-7}\; M\) (що відповідає значенням рН менше 7,00 і значенням pH більше 7,00). Базовими розчинами є ті, у яких молярність іонів гідронію менше, ніж\( 1.0 \times 10^{-7}\; M\) і молярність гідроксиду іонів більша\( 1.0 \times 10^{-7}\; M\) (що відповідає значенням рН більше 7,00 і значенням pH менше 7,00).
Оскільки\(K_w\) константа автоіонізації залежить від температури, ці кореляції між значеннями рН та кислотними/нейтральні/основними прикметниками будуть відрізнятися при температурах, відмінних від 25° C. наприклад, молярність гідронію чистої води при 80° C становить 4,9 × 10 −7 М, що відповідає значенням рН і pH:
\[\begin{align*} pH &=-\log[\ce{H_3O^+}] \\[4pt] &= -\log(4.9\times 10^{−7}) \\[4pt] &=6.31 \label{12} \end{align*} \]
\[\begin{align*} pOH &=-\log[\ce{OH^-}]\\[4pt] & =-\log(4.9\times 10^{−7}) \\[4pt] &=6.31 \label{13}\end{align*} \]
При цій температурі нейтральні розчини виявляють рН = pH = 6,31, кислі розчини виявляють рН менше 6,31 і pH більше 6,31, тоді як основні розчини виявляють рН більше 6,31 і pH менше 6,31. Це відмінність може бути важливим при вивченні певних процесів, що відбуваються при нестандартних температурах, таких як ферментні реакції в теплокровних організмах. Якщо не зазначено інше, посилання на значення рН вважаються значеннями при стандартній температурі (25° C) (табл.\(\PageIndex{1}\)).
| Класифікація | Відносні концентрації іонів | рН при 25 °C |
|---|---|---|
| кислотні | [H 3 O +] > [О −] | рН < 7 |
| нейтральний | [Н 3 О +] = [ОН −] | рН = 7 |
| основні | [Н 3 О +] < [ОН −] | рН > 7 |
\(\PageIndex{1}\)На малюнку показані співвідношення між [H 3 O +], [OH −], pH та pH, і наведено значення цих властивостей при стандартних температурах для деяких поширених речовин.
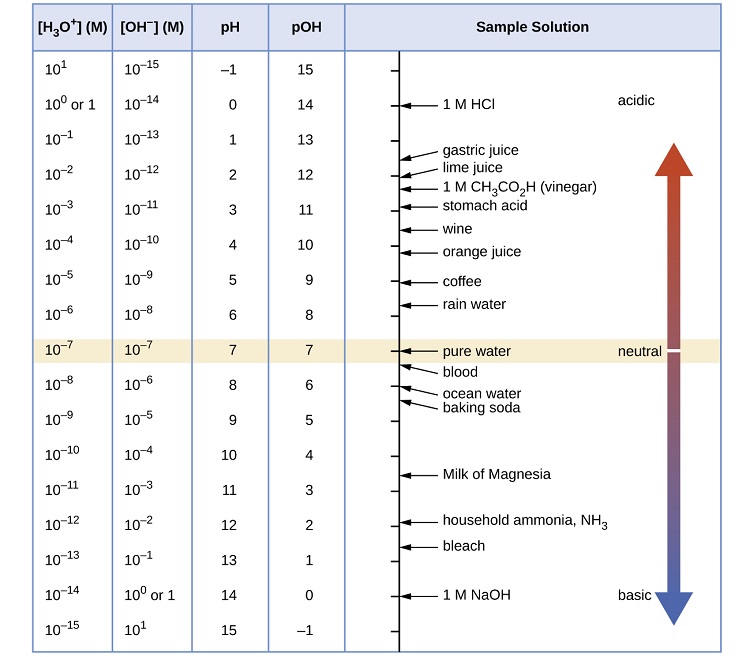
Що таке рН шлункової кислоти, розчину HCl з концентрацією іонів гідронію\(1.2 \times 10^{−3}\; M\)?
Рішення
\[\begin{align*} pH &=-\log [H_3O^+] \\[4pt] &= -\log(1.2 \times 10^{−3}) \\[4pt] &=−(−2.92) \\[4pt]&=2.92 \end{align*} \nonumber \]
Вода, що піддається впливу повітря, містить вугільну кислоту, H 2 CO 3, внаслідок реакції між вуглекислим газом і водою:
\[\ce{CO2(aq) + H2O (l) \rightleftharpoons H2CO3(aq)} \nonumber \]
Насичена повітрям вода має концентрацію іонів гідронію, спричинену\(\ce{CO_2}\) розчиненням\(2.0 \times 10^{−6}\; M\), приблизно в 20 разів більше, ніж у чистої води. Розрахуйте рН розчину при 25 °С.
- Відповідь
-
5.70
Розрахуйте концентрацію іонів гідронію крові, рН якої становить 7,3 (слаболужна).
Рішення
\[\mathrm{pH=-\log[H_3O^+]=7.3} \nonumber \]
\[\mathrm{\log[H_3O^+]=−7.3} \nonumber \]
\[\mathrm{[H_3O^+]=10^{−7.3}} \nonumber \]
або
\[[\ce{H_3O^+}]=\textrm{antilog of} −7.3 \nonumber \]
\[[\ce{H_3O^+}]=5\times 10^{−8}\;M \nonumber \]
(На калькуляторі візьміть антилог, або «зворотний» журнал, значення −7.3, або обчислити 10 −7.3.)
Обчисліть концентрацію іонів гідронію розчину з рН −1,07.
- Відповідь
-
12 М
Наука про навколишнє середовище
Звичайна дощова вода має рН між 5 і 6 завдяки наявності розчиненого СО 2, який утворює вугільну кислоту:
\[\ce{H2O (l) + CO2(g) ⟶ H2CO3(aq)} \label{14} \]
\[\ce{H2CO3(aq) \rightleftharpoons H^+(aq) + HCO3^- (aq)} \label{15} \]
Кислотний дощ - це дощова вода, яка має рН менше 5, завдяки різноманітним неметалевим оксидам, включаючи CO 2, SO 2, SO 3, NO та NO 2, розчиняються у воді і вступають в реакцію з нею, утворюючи не тільки вугільну кислоту, але сірчану кислоту та азотну кислоту. Освіта і подальша іонізація сірчаної кислоти показані тут:
\[\ce{H2O (l) + SO3(g) ⟶ H2SO4(aq)} \label{16} \]
\[\ce{H2SO4(aq) ⟶ H^+(aq) + HSO4^- (aq)} \label{17} \]
Вуглекислий газ природним чином присутній в атмосфері, оскільки ми та більшість інших організмів виробляємо його як відхідний продукт обміну речовин. Вуглекислий газ також утворюється, коли пожежі виділяють вуглець, що зберігається в рослинності, або коли ми спалюємо деревину або викопне паливо. Триоксид сірки в атмосфері природним чином виробляється вулканічною активністю, але він також походить від спалювання викопного палива, що має сліди сірки, і від процесу «випалу» руд сульфідів металів в процесах переробки металів. Оксиди азоту утворюються в двигунів внутрішнього згоряння, де високі температури дозволяють азоту і кисню в повітрі хімічно поєднуватися.
Кислотні дощі є особливою проблемою в промислових районах, де продукти згоряння і виплавки виділяються в повітря, не позбавляючись від оксидів сірки та азоту. У Північній Америці та Європі до 1980-х років він відповідав за знищення лісів та прісноводних озер, коли кислотність дощу фактично вбивала дерева, пошкодила ґрунт та зробила озера непридатними для життя для всіх, крім самих кислотолерантних видів. Кислотні дощі також роз'їдають скульптурні і фасади будівель, які виготовлені з мармуру і вапняку (рис.\(\PageIndex{2}\)). Правила, що обмежують кількість оксидів сірки та азоту, які можуть виділятися в атмосферу промисловістю та автомобілями, зменшили тяжкість пошкодження кислотою як природних, так і техногенних середовищ у Північній Америці та Європі. Зараз це зростаюча проблема в промислових районах Китаю та Індії.

Що таке pH і рН 0,0125-М розчину гідроксиду калію, КОН?
Рішення
Гідроксид калію є добре розчинною іонною сполукою і повністю дисоціює при розчиненні в розведеному розчині, даючи [ОН −] = 0,0125 М:
\[\mathrm{pOH=-\log[OH^− ]=-\log 0.0125} \nonumber \]
\[=−(−1.903)=1.903 \nonumber \]
РН можна дізнатися з\(\ce{pOH}\):
\[\mathrm{pH+pOH=14.00} \nonumber \]
\[\mathrm{pH=14.00−pOH=14.00−1.903=12.10} \nonumber \]
Концентрація іонів гідронію оцту становить приблизно\(4 \times 10^{−3}\; M\). Які відповідні значення pH і pH?
- Відповідь
-
РН = 11,6,
рН = 14,00 - пН = 2,4
Кислотність розчину зазвичай оцінюється експериментально шляхом вимірювання його рН. PoH розчину зазвичай не вимірюється, оскільки він легко обчислюється з експериментально визначеного значення рН. РН розчину можна безпосередньо виміряти за допомогою рН-метра (рис.\(\PageIndex{3}\)).

РН розчину також можна візуально оцінити за допомогою кольорових індикаторів (рис.\(\PageIndex{3}\)).

Резюме
Концентрація іона гідронію у розчині кислоти у воді\( 1.0 \times 10^{-7}\; M\) більша за 25 °С. Концентрація гідроксид-іона у розчині основи у воді більша\( 1.0 \times 10^{-7}\; M\) за 25 °С. Концентрацію Н 3 О + у розчині можна виражати як рН розчин;\(\ce{pH} = -\log \ce{H3O+}\). Концентрація ОН − може бути виражена у вигляді poH розчину:\(\ce{pOH} = -\log[\ce{OH-}]\). У чистій воді рН = 7,00 і pH = 7,00
Ключові рівняння
- \(\ce{pH}=-\log[\ce{H3O+}]\)
- \(\ce{pOH} = -\log[\ce{OH-}]\)
- [Н 3 О +] = 10 −рН
- [ОН −] = 10 −поН
- рН + pH = р К ш = 14.00 при 25 °C
Глосарій
- кислотні
- описує розв'язок, у якому [H 3 O +] > [OH −]
- основні
- описує розв'язок, у якому [H 3 O +] < [OH −]
- нейтральний
- описує розв'язок, у якому [H 3 O +] = [OH −]
- рН
- логарифмічна міра концентрації іонів гідронію в розчині
- Ох
- логарифмічна міра концентрації гідроксид-іонів у розчині
