14.3: Відносні сили кислот і основ
- Page ID
- 22778
- Оцініть відносні сили кислот і підстав відповідно до їх констант іонізації
- Раціоналізувати тенденції кислотно-основної міцності стосовно молекулярної структури
- Провести розрахунки рівноваги для слабких кислотно-основостійних систем
Ми можемо ранжувати сильні сторони кислот за ступенем їх іонізації у водному розчині. Реакція кислоти з водою дається загальним виразом:
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
Вода - це основа, яка реагує з кислотою\(\ce{HA}\),\(\ce{A^{−}}\) є кон'югатною основою кислоти\(\ce{HA}\), а іон гідронію - кон'югатна кислота води. Сильна кислота дає 100% (або дуже майже так)\(\ce{H3O+}\) і\(\ce{A^{−}}\) коли кислота іонізується у воді; Малюнок\(\PageIndex{1}\) перераховує кілька сильних кислот. А слабка кислота дає невеликі кількості\(\ce{H3O+}\) і\(\ce{A^{−}}\).
| Шість сильних кислот | Шість сильних основ | ||
|---|---|---|---|
| \(\ce{HClO4}\) | хлористої кислоти | \(\ce{LiOH}\) | гідроксид літію |
| \(\ce{HCl}\) | соляна кислота | \(\ce{NaOH}\) | гідроксид натрію |
| \(\ce{HBr}\) | бромна кислота | \(\ce{KOH}\) | гідроксид калію |
| \(\ce{HI}\) | воднева кислота | \(\ce{Ca(OH)2}\) | гідроксид кальцію |
| \(\ce{HNO3}\) | азотна кислота | \(\ce{Sr(OH)2}\) | гідроксид стронцію |
| \(\ce{H2SO4}\) | сірчана кислота | \(\ce{Ba(OH)2}\) | гідроксид барію |
Відносні сили кислот можуть бути визначені шляхом вимірювання їх констант рівноваги у водних розчині. У розчині тієї ж концентрації сильніші кислоти іонізуються більшою мірою, і так дають більш високі концентрації іонів гідронію, ніж у більш слабких кислот. Константа рівноваги для кислоти називається константою кислотно-іонізації, К а. Для реакції кислоти\(\ce{HA}\):
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
запишемо рівняння для константи іонізації як:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
де концентрації знаходяться в рівновазі. Як зазначається в розділі про константи рівноваги, хоча вода є реагентом в реакції, вона також є розчинником, тому її активність має значення 1, що не змінює значення\(K_a\).
Поширеною помилкою є стверджувати, що молярна концентрація розчинника певним чином бере участь у законі рівноваги. Ця помилка є результатом нерозуміння термодинаміки розчину. Наприклад, часто стверджують, що K a = K eq [H 2 O] для водних розчинів. Це рівняння є неправильним, оскільки є помилковою інтерпретацією правильного рівняння K a = K eq (\(\textit{a}_{H_2O}\)). Тому що\(\textit{a}_{H_2O}\) = 1 для розведеного розчину, K a = K eq (1), або K a = K eq.
Чим\(K_a\) більше кислоти, тим більша концентрація\(\ce{H3O+}\) і\(\ce{A^{−}}\) відносно концентрації неіонізованої кислоти,\(\ce{HA}\). Таким чином, сильніша кислота має більшу постійну іонізації, ніж слабша кислота. Константи іонізації збільшуються в міру збільшення сильних сторін кислот.
Наступні дані про константах кислотно-іонізації вказують на порядок міцності кислоти:\(\ce{CH3CO2H} < \ce{HNO2} < \ce{HSO4-}\)
\[ \begin{aligned} \ce{CH3CO2H}(aq) + \ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \quad &K_\ce{a}=1.8×10^{−5} \\[4pt] \ce{HNO2}(aq)+\ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) &K_\ce{a}=4.6×10^{-4} \\[4pt] \ce{HSO4-}(aq)+\ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) & K_\ce{a}=1.2×10^{−2} \end{aligned} \nonumber \]
Ще однією мірою міцності кислоти є її відсоткова іонізація. Відсоток іонізації слабкої кислоти - це відношення концентрації іонізованої кислоти до початкової концентрації кислоти, що дорівнює 100:
\[\% \:\ce{ionization}=\ce{\dfrac{[H3O+]_{eq}}{[HA]_0}}×100\% \label{PercentIon} \]
Оскільки співвідношення включає початкову концентрацію, відсоток іонізації для розчину даної слабкої кислоти змінюється в залежності від початкової концентрації кислоти, і фактично зменшується зі збільшенням концентрації кислоти.
Розрахуйте відсоток іонізації 0,125- М розчину азотної кислоти (слабкої кислоти), при рН 2,09.
Рішення
Відсоток іонізації для кислоти становить:
\[\ce{\dfrac{[H3O+]_{eq}}{[HNO2]_0}}×100 \nonumber \]
Хімічне рівняння дисоціації азотної кислоти таке:
\[\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{NO2-}(aq)+\ce{H3O+}(aq). \nonumber \]
Так як\(10^{−pH} = \ce{[H3O+]}\), ми знаходимо\(10^{−2.09} = 8.1 \times 10^{−3}\, M\), що, так що відсоток іонізації (Equation\ ref {Percention}) є:
\[\dfrac{8.1×10^{−3}}{0.125}×100=6.5\% \nonumber \]
Пам'ятайте, логарифм 2.09 вказує на концентрацію іонів гідронію лише з двома значущими цифрами.
Розрахуйте відсоток іонізації 0,10 М розчину оцтової кислоти з рН 2,89.
- Відповідь
-
1,3% іонізований
Ми можемо ранжувати сили основ за їх схильністю до утворення гідроксидних іонів у водному розчині. Реакція основи Бронстеда-Лоурі з водою дається:
\[\ce{B}(aq)+\ce{H2O}(l)⇌\ce{HB+}(aq)+\ce{OH-}(aq) \nonumber \]
Вода - це кислота, яка вступає в реакцію з основою,\(\ce{HB^{+}}\) є кон'югатною кислотою основи\(\ce{B}\), а гідроксид-іон - кон'югатною основою води. Сильна база дає 100% (або дуже майже так) OH - і HB +, коли вона реагує з водою; На малюнку\(\PageIndex{1}\) наведено кілька сильних основ. Слабка основа дає невелику частку гідроксидних іонів. Розчинні іонні гідроксиди, такі як NaOH, вважаються сильними основами, оскільки вони повністю дисоціюються при розчиненні у воді.
Як ми це робили з кислотами, ми можемо виміряти відносні сили основ, вимірюючи їх постійну базово-іонізації (K b) у водних розчині. У розчині тієї ж концентрації сильніші підстави іонізуються більшою мірою, і так дають більш високі концентрації гідроксид-іонів, ніж роблять слабші підстави. Більш міцна основа має більшу постійну іонізації, ніж слабша основа. Для реакції підстави\(\ce{B}\):
\[\ce{B}(aq)+\ce{H2O}(l)⇌\ce{HB+}(aq)+\ce{OH-}(aq), \nonumber \]
запишемо рівняння для константи іонізації як:
\[K_\ce{b}=\ce{\dfrac{[HB+][OH- ]}{[B]}} \nonumber \]
де концентрації знаходяться в рівновазі. Знову ж таки, ми не бачимо води в рівнянні, оскільки вода є розчинником і має активність 1. Хімічні реакції та константи іонізації трьох показаних основ:
\[ \begin{aligned} \ce{NO2-}(aq)+\ce{H2O}(l) &⇌\ce{HNO2}(aq)+\ce{OH-}(aq) \quad &K_\ce{b}=2.17×10^{−11} \\[4pt] \ce{CH3CO2-}(aq)+\ce{H2O}(l) &⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) &K_\ce{b}=5.6×10^{−10} \\[4pt] \ce{NH3}(aq)+\ce{H2O}(l) &⇌\ce{NH4+}(aq)+\ce{OH-}(aq) &K_\ce{b}=1.8×10^{−5} \end{aligned} \nonumber \]
Таблиця констант іонізації слабких основ представлена в таблиці Е2. Як і у випадку з кислотами, відсоток іонізації може бути виміряний для основних розчинів, але буде змінюватися в залежності від базової постійної іонізації і початкової концентрації розчину.
Розглянемо реакції іонізації для кон'югатної кислотно-лужної пари,\(\ce{HA − A^{−}}\):
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
с\(K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}}\).
\[\ce{A-}(aq)+\ce{H2O}(l)⇌\ce{OH-}(aq)+\ce{HA}(aq) \nonumber \]
с\(K_\ce{b}=\ce{\dfrac{[HA][OH]}{[A- ]}}\).
Додавання цих двох хімічних рівнянь дає рівняння для автоіонізації води:
\[\begin{align*} \cancel{\ce{HA}(aq)}+\ce{H2O}(l)+\cancel{\ce{A-}(aq)}+\ce{H2O}(l) &⇌ \ce{H3O+}(aq)+\cancel{\ce{A-}(aq)}+\ce{OH-}(aq)+\cancel{\ce{HA}(aq)} \\[4pt] \ce{2H2O}(l) &⇌\ce{H3O+}(aq)+\ce{OH-}(aq) \end{align*} \nonumber \]
Як показано в попередньому розділі про рівновагу,\(K\) вираз для хімічного рівняння, отриманого від додавання двох або більше інших рівнянь, є математичним добутком\(K\) виразів інших рівнянь. Помножуючи вирази масової дії разом і скасовуючи загальні терміни, ми бачимо, що:
\[K_\ce{a}×K_\ce{b}=\ce{\dfrac{[H3O+][A- ]}{[HA]}×\dfrac{[HA][OH- ]}{[A- ]}}=\ce{[H3O+][OH- ]}=K_\ce{w} \nonumber \]
Наприклад, константа кислотної іонізації оцтової кислоти (СН 3 СООН) становить 1,8 × 10 −5, а базова постійна іонізації її кон'югатної основи, ацетатного іона (\(\ce{CH3COO-}\)), становить 5,6 × 10 −10. Добуток цих двох констант дійсно дорівнює\(K_w\):
\[K_\ce{a}×K_\ce{b}=(1.8×10^{−5})×(5.6×10^{−10})=1.0×10^{−14}=K_\ce{w} \nonumber \]
Те, наскільки кислота\(\ce{HA}\), дарує протони молекулам води, залежить від міцності кон'югатної основи\(\ce{A^{−}}\), кислоти. Якщо\(\ce{A^{−}}\) це сильна основа, будь-які протони, які подаються молекулам води, відловлюються\(\ce{A^{−}}\). При цьому є відносно мало\(\ce{A^{−}}\) і\(\ce{H3O+}\) в розчині, і кислоти\(\ce{HA}\), слабка. Якщо\(\ce{A^{−}}\) є слабкою основою, вода пов'язує протони сильніше, а розчин містить в першу чергу\(\ce{A^{−}}\) і\(\ce{H3O^{+}}\) —кислота сильна. Сильні кислоти утворюють дуже слабкі кон'югатні підстави, а слабкі кислоти утворюють більш міцні кон'югатні підстави (рис.\(\PageIndex{2}\)).
 "стиль = "ширина: 784px; висота: 271 пікселів;» ширина = «784px» висота = «271px» SRC =»/@api /deki/files/65684/CNX_Chem_14_03_strengths.jpg «>
"стиль = "ширина: 784px; висота: 271 пікселів;» ширина = «784px» висота = «271px» SRC =»/@api /deki/files/65684/CNX_Chem_14_03_strengths.jpg «>
На малюнку\(\PageIndex{3}\) наведено ряд кислот і підстав в порядку зменшення сильних сторін кислот та відповідних зростаючих сильних сторін підстав. Кислота і основа в даному ряду сполучаються один з одним.
Перші шість кислот на малюнку\(\PageIndex{3}\) є найбільш поширеними сильними кислотами. Ці кислоти повністю дисоціюються у водному розчині. Кон'югатні підстави цих кислот є більш слабкими підставами, ніж вода. Коли одна з цих кислот розчиняється у воді, їх протони повністю переносяться у воду, більш міцну основу.
Ті кислоти, які лежать між іоном гідронію та водою на малюнку,\(\PageIndex{3}\) утворюють кон'югатні основи, які можуть конкурувати з водою за володіння протоном. І іони гідронію, і молекули неіонізованої кислоти присутні в рівновазі в розчині однієї з цих кислот. Сполуки, які є слабшими кислотами, ніж вода (ті, що знаходяться нижче води в стовпці кислот) на малюнку, не\(\PageIndex{3}\) виявляють помітної кислотної поведінки при розчиненні у воді. Їх кон'югатні основи міцніші, ніж іон гідроксиду, і якби утворилася якась кон'югатна основа, вона реагувала б з водою для повторного утворення кислоти.
 "стиль = "ширина: 798 пікселів; висота: 715 пікселів;» ширина = «798px» висота = «715px» SRC =»/@api /deki/files/65685/CNX_Chem_14_03_Corresp.jpg «>
"стиль = "ширина: 798 пікселів; висота: 715 пікселів;» ширина = «798px» висота = «715px» SRC =»/@api /deki/files/65685/CNX_Chem_14_03_Corresp.jpg «>
Ступінь, в якій основа утворює гідроксид-іон у водному розчині, залежить від міцності основи щодо міцності гідроксид-іона, як показано в останньому стовпці на рис\(\PageIndex{3}\). Міцна основа, така як одна з тих, що лежать нижче гідроксид-іона, приймає протони з води, щоб отримати 100% кон'югатної кислоти та гідроксид-іона. Ці основи, що лежать між водою та гідроксидним іоном, приймають протони з води, але суміш гідроксид-іона та основи результатів. Підстави, які слабкіші за воду (ті, що лежать над водою в стовпі підстав), не показують жодної спостережуваної основної поведінки у водному розчині.
Використовуйте\(K_b\) для нітрит-іона\(\ce{NO2-}\), щоб розрахувати\(K_a\) для його кон'югатної кислоти.
Рішення
K b для\(\ce{NO2-}\) наведено у цьому розділі як 2,17 × 10 −11. Кон'югатна кислота HNO 2; K a для HNO 2 може бути розрахована за допомогою співвідношення:\(\ce{NO2-}\)
\[K_\ce{a}×K_\ce{b}=1.0×10^{−14}=K_\ce{w} \nonumber \]
Вирішуючи для К а, отримуємо:
\[\begin{align*} K_\ce{a} &=\dfrac{K_\ce{w}}{K_\ce{b}} \\[4pt] &=\dfrac{1.0×10^{−14}}{2.17×10^{−11}} \\[4pt] &=4.6×10^{−4} \end{align*} \nonumber \]
Цю відповідь можна перевірити, знайшовши K a для HNO 2 в таблиці E1
Ми можемо визначити відносні кислотні сили\(\ce{NH4+}\) і\(\ce{HCN}\) порівнявши їх константи іонізації. Константа іонізації\(\ce{HCN}\) наведена в таблиці Е1 як 4,9 × 10 −10. Константа\(\ce{NH4+}\) іонізації не вказана, але константа іонізації її сполученого підстави\(\ce{NH3}\), вказана як 1,8 × 10 −5. Визначте постійну іонізації\(\ce{NH4+}\), і вирішіть, яка є сильнішою кислотою,\(\ce{HCN}\) або\(\ce{NH4+}\).
- Відповідь
-
\(\ce{NH4+}\)є трохи сильнішою кислотою (К а для\(\ce{NH4+}\) = 5,6 × 10 −10).
Іонізація слабких кислот і слабких основ
Багато кислот і основ слабкі; тобто вони не іонізуються повністю у водному розчині. Розчин слабкої кислоти у воді являє собою суміш неіонізованої кислоти, іона гідронію та кон'югатної основи кислоти, з неіонізованою кислотою, присутньою в найбільшій концентрації. Таким чином, слабка кислота збільшує концентрацію іонів гідронію у водному розчині (але не стільки ж, скільки такої ж кількості сильної кислоти).
Оцтова кислота (\(\ce{CH3CO2H}\)) - слабка кислота. Коли ми додаємо оцтову кислоту в воду, вона в невеликій мірі іонізується відповідно до рівняння:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
надання рівноважної суміші з більшою частиною кислоти, присутньої в неіонізованої (молекулярної) формі. Ця рівновага, як і інші рівноваги, є динамічною; молекули оцтової кислоти передають іони водню молекулам води і утворюють іони гідронію та ацетатні іони з тією ж швидкістю, що іони гідронію передають іони водню ацетатним іонам для реформування молекул оцтової кислоти та молекул води. Вимірюючи рН водного розчину відомої концентрації, можна сказати, що в будь-який момент іонізується лише частка слабкої кислоти (рис.\(\PageIndex{4}\)). Решта слабка кислота присутня в неіонізованому вигляді.
Для оцтової кислоти, при рівновазі:
\[K_\ce{a}=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}}=1.8 \times 10^{−5} \nonumber \]

| Реакція іонізації | К а при 25 °C |
|---|---|
| \(\ce{HSO4- + H2O ⇌ H3O+ + SO4^2-}\) | 1,2 × 10 −2 |
| \(\ce{HF + H2O ⇌ H3O+ + F-}\) | 3,5 × 10 −4 |
| \(\ce{HNO2 + H2O ⇌ H3O+ + NO2-}\) | 4,6 × 10 −4 |
| \(\ce{HNCO + H2O ⇌ H3O+ + NCO-}\) | 2 × 10 −4 |
| \(\ce{HCO2H + H2O ⇌ H3O+ + HCO2-}\) | 1,8 × 10 −4 |
| \(\ce{CH3CO2H + H2O ⇌ H3O+ + CH3CO2-}\) | 1,8 × 10 −5 |
| \(\ce{HCIO + H2O ⇌ H3O+ + CIO-}\) | 2,9 × 10 −8 |
| \(\ce{HBrO + H2O ⇌ H3O+ + BrO-}\) | 2,8 × 10 −9 |
| \(\ce{HCN + H2O ⇌ H3O+ + CN-}\) | 4,9 × 10 −10 |
У таблиці\(\PageIndex{1}\) наведені константи іонізації для декількох слабких кислот; додаткові константи іонізації можна знайти в таблиці Е1.
При рівновазі розчин слабкої основи у воді являє собою суміш неіонізованої основи, кон'югатної кислоти слабкої основи і гідроксид-іона з присутнім в найбільшій концентрації неіонізованої основою. Таким чином, слабка основа збільшує концентрацію гідроксид-іонів у водному розчині (але не стільки ж, скільки такої ж кількості міцної основи).
Наприклад, розчин слабкої основи триметиламіну, (СН 3) 3 Н, у воді реагує за рівнянням:
\[\ce{(CH3)3N}(aq)+\ce{H2O}(l)⇌\ce{(CH3)3NH+}(aq)+\ce{OH-}(aq) \nonumber \]
Це дає рівноважну суміш з більшою частиною основи, присутньої у вигляді неіонізованого аміну. Ця рівновага аналогічна описаному для слабких кислот.
Ми можемо підтвердити, виміряючи рН водного розчину слабкої основи відомої концентрації, що з водою реагує тільки частка основи (рис. 14.4.5). Решта слабке підставу присутній у вигляді не прореагували форми. Константа рівноваги для іонізації слабкої основи\(K_b\), називається постійною іонізації слабкої основи, і дорівнює коефіцієнту реакції, коли реакція знаходиться в рівновазі. Для триметиламіну при рівновазі:
\[K_\ce{b}=\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}} \nonumber \]
Константи іонізації декількох слабких основ наведені в таблиці\(\PageIndex{2}\) і таблиці Е2.
| Реакція іонізації | К б при 25° С |
|---|---|
| \(\ce{(CH3)2NH + H2O ⇌ (CH3)2NH2+ + OH-}\) | 5,9 × 10 −4 |
| \(\ce{CH3NH2 + H2O ⇌ CH3NH3+ + OH-}\) | 4,4 × 10 −4 |
| \(\ce{(CH3)3N + H2O ⇌ (CH3)3NH+ + OH-}\) | 6,3 × 10 −5 |
| \(\ce{NH3 + H2O ⇌ NH4+ + OH-}\) | 1,8 × 10 −5 |
| \(\ce{C6H5NH2 + H2O ⇌ C6N5NH3+ + OH-}\) | 4,3 × 10 −10 |
Оцтова кислота є основним інгредієнтом оцту, тому на смак він кислий. При рівновазі розчин містить [СН 3 СО 2 Н] = 0,0787 М і\(\ce{[H3O+]}=\ce{[CH3CO2- ]}=0.00118\:M\). Яке значення\(K_a\) для оцтової кислоти?

Рішення
Нас просять обчислити константу рівноваги з рівноважних концентрацій. При рівновазі значення константи рівноваги дорівнює коефіцієнту реакції для реакції:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
\[\begin{align*} K_\ce{a} &=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}} \\[4pt] &=\dfrac{(0.00118)(0.00118)}{0.0787} \\[4pt] &=1.77×10^{−5} \end{align*} \nonumber \]
Яка постійна рівноваги для іонізації\(\ce{HSO4-}\) іона, слабка кислота використовується в деяких побутових миючих засобах:
\[\ce{HSO4-}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) \nonumber \]
В одній суміші NaHSO 4 і Na 2 SO 4 при рівновазі,\(\ce{[H3O+]}\) = 0,027 М\(\ce{[HSO4- ]}=0.29\:M\);; і\(\ce{[SO4^2- ]}=0.13\:M\).
- Відповідь
-
\(K_a\)для\(\ce{HSO_4^-}= 1.2 ×\times 10^{−2}\)
Кофеїн, C 8 H 10 N 4 O 2 є слабкою основою. Яке значення K b для кофеїну, якщо розчин при рівновазі має [C 8 H 10 N 4 O 2] = 0,050 М,\(\ce{[C8H10N4O2H+]}\) = 5,0 × 10 −3 М, а [ОН −] = 2,5 × 10 −3 М?
Рішення
При рівновазі значення константи рівноваги дорівнює коефіцієнту реакції для реакції:
\[\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq) \nonumber \]
тому
\[K_\ce{b}=\ce{\dfrac{[C8H10N4O2H+][OH- ]}{[C8H10N4O2]}}=\dfrac{(5.0×10^{−3})(2.5×10^{−3})}{0.050}=2.5×10^{−4} \nonumber \]
Що таке постійна рівноваги для іонізації\(\ce{HPO4^2-}\) іона, слабке підставу:
\[\ce{HPO4^2-}(aq)+\ce{H2O}(l)⇌\ce{H2PO4-}(aq)+\ce{OH-}(aq) \nonumber \]
У розчині, що містить суміш\(\ce{NaH2PO4}\) і\(\ce{Na2HPO4}\) при рівновазі з:
- \([\ce{OH^{−}}] = 1.3 × 10^{−6} M\)
- \(\ce{[H2PO4^{-}]=0.042\:M}\)і
- \(\ce{[HPO4^{2-}]=0.341\:M}\).
- Відповідь
-
К б для\(\ce{HPO4^2-}=1.6×10^{−7} \)
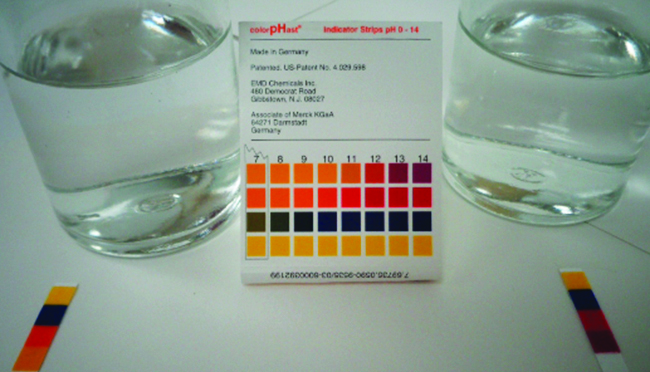
Показник рН 0,0516- М розчину азотної кислоти\(\ce{HNO2}\), становить 2,34. Що це таке\(K_a\)?
\[\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) \nonumber \]
Рішення
Визначено константу рівноваги, починаючи з початкових концентрацій HNO 2\(\ce{H3O+}\), а\(\ce{NO2-}\) також одну з кінцевих концентрацій - концентрацію іона гідронію при рівновазі. (Пам'ятайте, що рН - це просто інший спосіб виразити концентрацію іона гідронію.)
Ми можемо вирішити цю проблему наступними кроками, в яких х - це зміна концентрації виду в реакції:
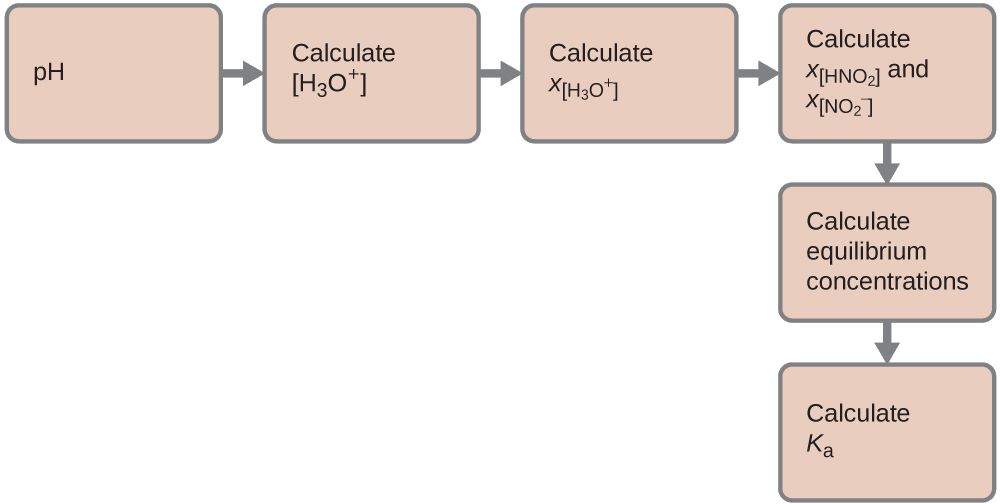
Ми можемо узагальнити різні концентрації та зміни, як показано тут. Оскільки вода є розчинником, вона має фіксовану активність, рівну 1. Будь-яка невелика кількість води, що утворюється або витрачається під час реакції, не змінить роль води як розчинника, тому значення її активності залишається рівним 1 протягом всієї реакції.
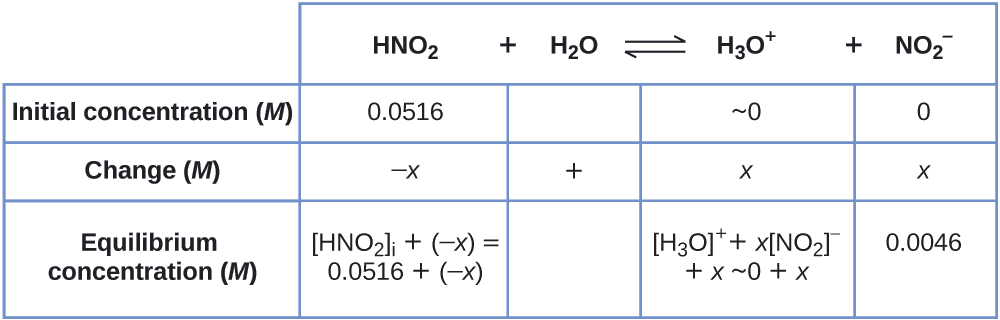
Щоб отримати різні значення в таблиці ДВС (Початкова, Зміна, Рівновага), спочатку обчислимо\(\ce{[H3O+]}\), рівноважна концентрація\(\ce{H3O+}\), з рН:
\[\ce{[H3O+]}=10^{−2.34}=0.0046\:M \nonumber \]
Зміна концентрації\(\ce{H3O+}\)\(x_{\ce{[H3O+]}}\), - це різниця між рівноважною концентрацією Н 3 О +, яку ми визначили з рН, і початковою концентрацією,\(\mathrm{[H_3O^+]_i}\). Початкова концентрація\(\ce{H3O+}\) - це його концентрація в чистій воді, яка настільки менше кінцевої концентрації, що ми наближаємо її як нуль (~0).
Зміна концентрації\(\ce{NO2-}\) дорівнює зміні концентрації\(\ce{[H3O+]}\). На кожну 1 моль\(\ce{H3O+}\) цієї форми 1 моль\(\ce{NO2-}\) форм. Рівноважна концентрація HNO 2 дорівнює його початковій концентрації плюс зміна її концентрації.
Тепер ми можемо заповнити таблицю ICE концентраціями в рівновазі, як показано тут:
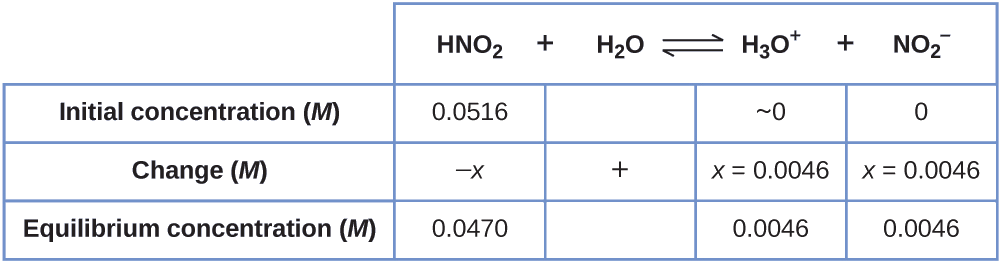
Нарешті, обчислимо значення константи рівноваги, використовуючи дані таблиці:
\[K_\ce{a}=\ce{\dfrac{[H3O+][NO2- ]}{[HNO2]}}=\dfrac{(0.0046)(0.0046)}{(0.0470)}=4.5×10^{−4} \nonumber \]
Показник рН розчину побутового аміаку, 0,950- М розчину NH 3, становить 11,612. Що таке K b для NH 3.
- Відповідь
-
\(K_b = 1.8 × 10^{−5}\)
Мурашина кислота, HCO 2 H, є подразником, який викликає реакцію організму на укуси мурашок.

Яка концентрація іона гідронію і рН в 0,534- М розчині мурашиної кислоти?
\[\ce{HCO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{HCO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−4} \nonumber \]
Рішення немає
1. Визначте х і рівноважні концентрації. Вираз рівноваги таке:
\[\ce{HCO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{HCO2-}(aq) \nonumber \]
Оскільки вода є розчинником, вона має фіксовану активність, рівну 1. Будь-яка невелика кількість води, що утворюється або витрачається під час реакції, не змінить роль води як розчинника, тому значення її активності залишається рівним 1 протягом всієї реакції, тому нам не потрібно враховувати її при налаштуванні столу ICE.
У таблиці наведені початкові концентрації (концентрації до іонізації кислоти), зміни концентрації і рівноважні концентрації слідують (дані, наведені в задачі, відображаються в кольорі):
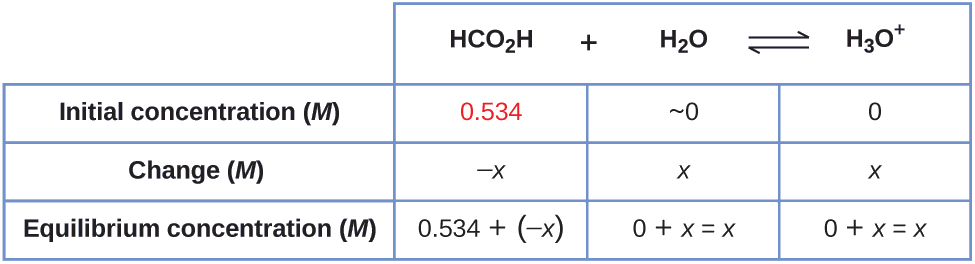
2. Вирішити для\(x\) і рівноважні концентрації. При рівновазі:
\[\begin{align*} K_\ce{a} &=1.8×10^{−4}=\ce{\dfrac{[H3O+][HCO2- ]}{[HCO2H]}} \\[4pt] &=\dfrac{(x)(x)}{0.534−x}=1.8×10^{−4} \end{align*} \nonumber \]
Тепер вирішуйте для\(x\). Оскільки початкова концентрація кислоти досить велика і\(K_a\) дуже мала, ми припускаємо\(x << 0.534\), що, що дозволяє нам спростити знаменник терміном як\((0.534 − x) = 0.534\). Це дає:
\[K_\ce{a}=1.8×10^{−4}=\dfrac{x^{2}}{0.534} \nonumber \]
Вирішити для\(x\) наступним чином:
\[\begin{align*} x^2 &=0.534×(1.8×10^{−4}) \\[4pt] &=9.6×10^{−5} \\[4pt] x &=\sqrt{9.6×10^{−5}} \\[4pt] &=9.8×10^{−3} \end{align*} \nonumber \]
Щоб перевірити припущення,\(x\) яке невелике в порівнянні з 0,534, обчислюємо:
\[\begin{align*} \dfrac{x}{0.534} &=\dfrac{9.8×10^{−3}}{0.534} \\[4pt] &=1.8×10^{−2} \, \textrm{(1.8% of 0.534)} \end{align*} \nonumber \]
\(x\)становить менше 5% від початкової концентрації; припущення дійсне.
Ми знаходимо рівноважну концентрацію іона гідронію в цьому розчині мурашиної кислоти від його початкової концентрації та зміни цієї концентрації, як зазначено в останньому рядку таблиці:
\[\begin{align*} \ce{[H3O+]} &=~0+x=0+9.8×10^{−3}\:M. \\[4pt] &=9.8×10^{−3}\:M \end{align*} \nonumber \]
РН розчину можна дізнатися, взявши негативний журнал\(\ce{[H3O+]}\), так:
\[pH = −\log(9.8×10^{−3})=2.01 \nonumber \]
Лише мала частка слабкої кислоти іонізується у водному розчині. Який відсоток іонізації оцтової кислоти в 0,100- М розчині оцтової кислоти, СН 3 СО 2 Н?
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−5} \nonumber \]
- Підказка
-
Визначте\(\ce{[CH3CO2- ]}\) при рівновазі.) Нагадаємо, що відсоток іонізації - це частка оцтової кислоти, яка іонізована × 100, або\(\ce{\dfrac{[CH3CO2- ]}{[CH3CO2H]_{initial}}}×100\).
- Відповідь
-
відсоток іонізації = 1,3%
Наступний приклад показує, що концентрацію продуктів, одержуваних іонізацією слабкої основи, можна визначити по тій же серії етапів, що застосовуються зі слабкою кислотою.
Знайти концентрацію гідроксид-іона в 0,25- М розчині триметиламіну, слабкої основи:
\[\ce{(CH3)3N}(aq)+\ce{H2O}(l)⇌\ce{(CH3)3NH+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=6.3×10^{−5} \nonumber \]
Рішення Ця задача вимагає обчислити рівноважну концентрацію, визначаючи зміни концентрації, коли іонізація основи переходить до рівноваги. Розчин підходить так само, як і для іонізації мурашиної кислоти в прикладі\(\PageIndex{6}\). Реагенти і продукти будуть різними і цифри будуть різними, але логіка буде однаковою:

1. Визначте х і рівноважні концентрації. У таблиці наведені зміни і концентрації:
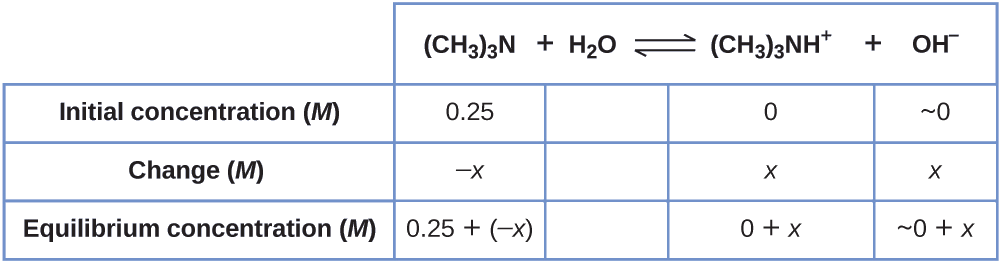
2. Вирішити для\(x\) і рівноважні концентрації. При рівновазі:
\[K_\ce{b}=\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}}=\dfrac{(x)(x)}{0.25−x=}6.3×10^{−5} \nonumber \]
Якщо припустити, що x малий відносно 0,25, то ми можемо замінити (0,25 − x) у попередньому рівнянні на 0.25. Розв'язування спрощеного рівняння дає:
\[x=4.0×10^{−3} \nonumber \]
Ця зміна становить менше 5% від початкової концентрації (0,25), тому припущення виправдано.
Нагадаємо, що для цього розрахунку\(x\) дорівнює рівноважна концентрація гідроксид-іона в розчині (див. Раніше таблицю):
\[\begin{align*} (\ce{[OH- ]}=~0+x=x=4.0×10^{−3}\:M \\[4pt] &=4.0×10^{−3}\:M \end{align*} \nonumber \]
Потім розрахуйте poH наступним чином:
\[\ce{pOH}=−\log(4.3×10^{−3})=2.40 \nonumber \]
Використовуючи відношення, введене в попередньому розділі цього розділу:
\[\mathrm{pH + pOH=p\mathit{K}_w=14.00}\nonumber \]
дозволяє обчислення рН:
\[\mathrm{pH=14.00−pOH=14.00−2.37=11.60} \nonumber \]
Перевірте роботу. Перевірка нашої арифметики показує, що\(K_b = 6.3 \times 10^{−5}\).
- Показати, що обчислення на кроці 2 цього прикладу дає x 4.3 × 10 −3, а обчислення на кроці 3 показує K b = 6.3 × 10 −5.
- Знайти концентрацію гідроксид-іона в 0,0325- М розчині аміаку, слабкої основи з K b 1,76 × 10 −5. Обчисліть відсоток іонізації аміаку, фракції іонізованої × 100, або\(\ce{\dfrac{[NH4+]}{[NH3]}}×100 \%\)
- Відповідь на
-
\(7.56 × 10^{−4}\, M\), 2,33%
- Відповідь б
-
2.33%
Деякі слабкі кислоти і слабкі підстави іонізуються до такої міри, що спрощує припущення про те, що х невеликий щодо початкової концентрації кислоти або основи, недоцільно. Коли ми вирішуємо для рівноважних концентрацій в таких випадках, ми побачимо, що ми не можемо нехтувати зміною початкової концентрації кислоти або основи, і ми повинні вирішити рівняння рівноваги, використовуючи квадратне рівняння.
Бісульфат натрію, NaHSO 4, використовується в деяких побутових миючих засобах, оскільки він містить\(\ce{HSO4-}\) іон, слабку кислоту. Що таке рН 0,50-М розчину\(\ce{HSO4-}\)?
\[\ce{HSO4-}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{a}=1.2×10^{−2} \nonumber \]
Рішення немає
Нам потрібно визначити рівноважну концентрацію іона гідронію, що виникає в результаті іонізації,\(\ce{HSO4-}\) щоб ми могли використовувати\(\ce{[H3O+]}\) для визначення рН. Як і в попередніх прикладах, ми можемо підійти до вирішення наступними кроками:

1. Визначають\(x\) і рівноважні концентрації. У цій таблиці наведені зміни і концентрації:

2. Вирішити для\(x\) і концентрації.
Коли ми почнемо вирішувати для\(x\), ми виявимо, що це складніше, ніж у попередніх прикладах. Коли ми обговорюємо ці ускладнення, ми не повинні втрачати сліди того факту, що це все ще мета цього кроку, щоб визначити значення\(x\).
При рівновазі:
\[K_\ce{a}=1.2×10^{−2}=\ce{\dfrac{[H3O+][SO4^2- ]}{[HSO4- ]}}=\dfrac{(x)(x)}{0.50−x} \nonumber \]
Якщо припустити, що x малий і приблизний (0.50 − x) як 0.50, то знайдемо:
\[x=7.7×10^{−2} \nonumber \]
Коли ми перевіряємо припущення, підтверджуємо:
\[\dfrac{x}{\mathrm{[HSO_4^- ]_i}} \overset{?}{\le} 0.05 \nonumber \]
який для цієї системи
\[\dfrac{x}{0.50}=\dfrac{7.7×10^{−2}}{0.50}=0.15(15\%) \nonumber \]
Значення\(x\) не менше 5% від 0,50, тому припущення не є дійсним. Нам потрібна квадратична формула, щоб знайти\(x\).
Рівняння:
\[K_\ce{a}=1.2×10^{−2}=\dfrac{(x)(x)}{0.50−x}\nonumber \]
дає
\[6.0×10^{−3}−1.2×10^{−2}x=x^{2+} \nonumber \]
або
\[x^{2+}+1.2×10^{−2}x−6.0×10^{−3}=0 \nonumber \]
Це рівняння можна вирішити за допомогою квадратичної формули. Для рівняння виду
\[ax^{2+} + bx + c=0, \nonumber \]
\(x\)задається квадратним рівнянням:
\[x=\dfrac{−b±\sqrt{b^{2+}−4ac}}{2a} \nonumber \]
У цій проблемі,\(a = 1\),\(b = 1.2 × 10^{−3}\), і\(c = −6.0 × 10^{−3}\).
Розв'язування для x дає негативний корінь (який не може бути правильним, оскільки концентрація не може бути негативною) та позитивний корінь:
\[x=7.2×10^{−2} \nonumber \]
Тепер визначаємо концентрацію іонів гідронію і рН:
\[\begin{align*} \ce{[H3O+]} &=~0+x=0+7.2×10^{−2}\:M \\[4pt] &=7.2×10^{−2}\:M \end{align*} \nonumber \]
Показник рН цього розчину становить:
\[\mathrm{pH=−log[H_3O^+]=−log7.2×10^{−2}=1.14} \nonumber \]
- Показати, що дає квадратична формула\(x = 7.2 × 10^{−2}\).
- Розрахуйте рН в 0,010- М розчині кофеїну, слабку основу:
\[\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=2.5×10^{−4} \nonumber \]
- Підказка
-
Потрібно буде перетворити [OH −] в pH\(\ce{[H3O+]}\) або pH на pH ближче до кінця обчислення.
- Відповідь
-
рН 11,16
Відносні сили сильних кислот і основ
Сильні кислоти, такі як\(\ce{HCl}\)\(\ce{HBr}\), і\(\ce{HI}\), все проявляють однакову міцність у воді. Молекула води є настільки сильною основою в порівнянні з кон'югатними основами Cl −, Br - і I - що іонізація цих сильних кислот по суті повна у водних розчині. У розчинниках менш основних, ніж у воді\(\ce{HCl}\), ми знаходимо\(\ce{HBr}\), і помітно\(\ce{HI}\) відрізняються своєю схильністю відмовлятися від протона до розчинника. Наприклад, при розчиненні в етанолі (більш слабкій основі, ніж у воді) ступінь іонізації збільшується в порядку\(\ce{HCl < HBr < HI}\), і тому\(\ce{HI}\) демонструється найсильніша з цих кислот. Нездатність розрізнити відмінності в міцності серед сильних кислот, розчинених у воді, відома як вирівнюючий ефект води.
Вода також надає вирівнюючу дію на сили міцних підстав. Наприклад, іон оксиду, O 2 − і амід-іон\(\ce{NH2-}\), є такими міцними основами, що вони повністю реагують з водою:
\[\ce{O^2-}(aq)+\ce{H2O}(l)⟶\ce{OH-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2-}(aq)+\ce{H2O}(l)⟶\ce{NH3}(aq)+\ce{OH-}(aq) \nonumber \]
Таким чином, O 2− і,\(\ce{NH2-}\) здається, мають однакову міцність основи у воді; обидва вони дають 100% вихід гідроксид-іона.
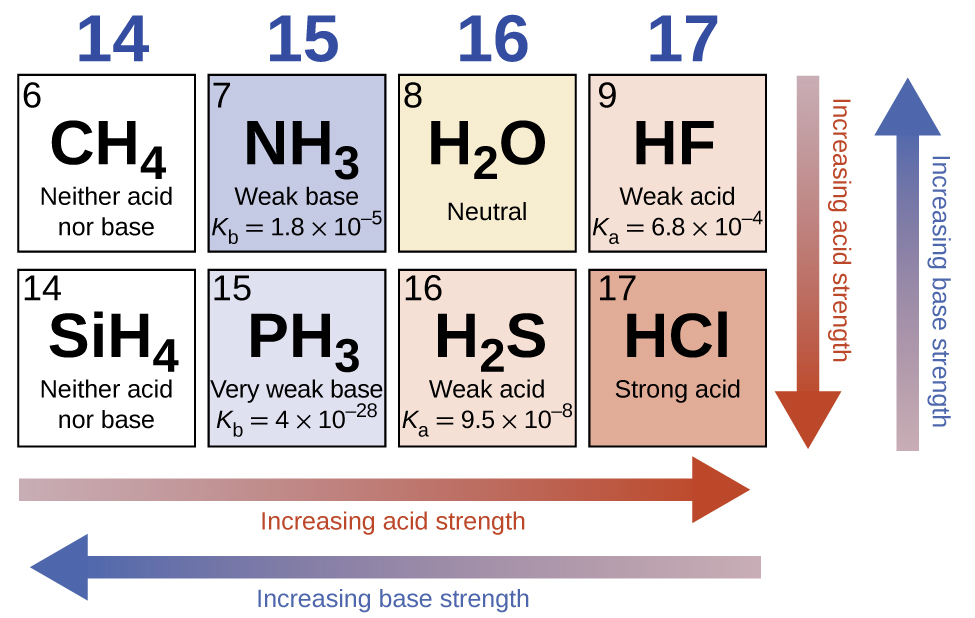
При відсутності будь-якого вирівнюючого ефекту кислотна міцність бінарних сполук водню з неметалами (А) збільшується в міру зменшення міцності зв'язку H-A вниз по групі в таблиці Менделєєва. Для 17 групи порядок підвищення кислотності становить\(\ce{HF < HCl < HBr < HI}\). Так само для групи 16 порядок збільшення сили кислоти становить H 2 O < H 2 S < H 2 Se < H 2 Se < H 2 Te. Через ряд у таблиці Менделєєва кислотна міцність бінарних сполук водню зростає зі збільшенням електронегативності неметалевого атома, оскільки полярність зв'язку H-A збільшується. Таким чином, порядок підвищення кислотності (для видалення одного протона) по всьому другому ряду дорівнює\(\ce{CH4 < NH3 < H2O < HF}\); поперек третього ряду - це\(\ce{SiH4 < PH3 < H2S < HCl}\) (див. Рис.\(\PageIndex{6}\)).
Сполуки, що містять кисень і одну або кілька гідроксильних (ОН) груп, можуть бути кислотними, основними або амфотерними, в залежності від положення в періодичній таблиці центрального атома Е, атома, пов'язаного з гідроксильною групою. Такі сполуки мають загальну формулу O n E (OH) m, і включають сірчану кислоту\(\ce{O2S(OH)2}\), сірчану кислоту\(\ce{OS(OH)2}\), азотну кислоту\(\ce{O2NOH}\), хлорну кислоту\(\ce{O3ClOH}\), гідроксид алюмінію\(\ce{Al(OH)3}\), гідроксид кальцію\(\ce{Ca(OH)2}\), гідроксид калію,\(\ce{KOH}\):
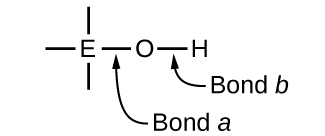
Якщо центральний атом, Е, має низьку електронегативність, його тяжіння для електронів низька. Існує невелика тенденція до утворення центрального атома міцного ковалентного зв'язку з атомом кисню, і зв'язок a між елементом і киснем легше розривається, ніж зв'язок b між киснем і воднем. Отже, зв'язок а є іонним, гідроксидні іони виділяються в розчин, а матеріал поводиться як основа - це стосується Са (ОН) 2 та КОН. Більш низька електронегативність характерна для більш металевих елементів; отже, металеві елементи утворюють іонні гідроксиди, які за визначенням є основними сполуками.
Якщо, з іншого боку, атом Е має відносно високу електронегативність, він сильно притягує електрони, які він ділить з атомом кисню, роблячи зв'язок відносно сильно ковалентним. Киснево-водневий зв'язок, зв'язок b, тим самим послаблюється, оскільки електрони зміщуються в бік Е. Бонд b полярний і легко вивільняє іони водню в розчин, тому матеріал поводиться як кислота. Високі електронегативності характерні для більш неметалевих елементів. Так, неметалеві елементи утворюють ковалентні сполуки, що містять кислі групи −ОН, які називаються оксикислотами.
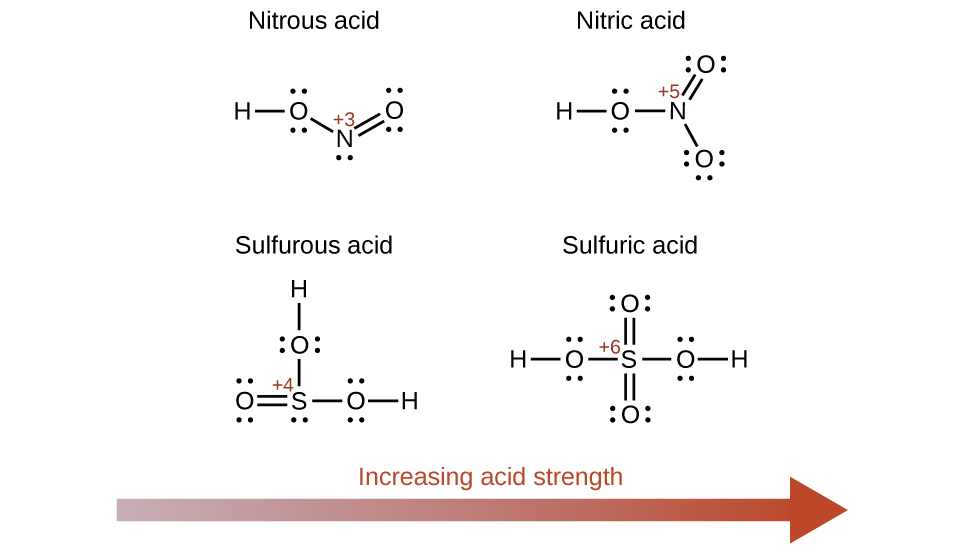
Збільшення числа окислення центрального атома Е також збільшує кислотність оксикислоти, оскільки це збільшує тяжіння Е для електронів, які він ділить з киснем, і тим самим послаблює O-H зв'язок. Сірчана кислота, H 2 SO 4, або O 2 S (OH) 2 (з числом окислення сірки +6), більш кисла, ніж сірчана кислота, H 2 SO 3, або OS (OH) 2 (з числом окислення сірки +4). Аналогічно азотна кислота, HNO 3 або O 2 NOH (число окислення N = +5), є більш кислою, ніж азотна кислота, HNO 2 або ONOH (число окислення N = +3). У кожній з цих пар число окислення центрального атома більше для більш сильної кислоти (рис.\(\PageIndex{7}\)).
Гідроксисполуки елементів з проміжною електронегативністю і відносно високими числами окислення (наприклад, елементи поблизу діагональної лінії, що відокремлюють метали від неметалів в таблиці Менделєєва) зазвичай амфотерні. Це означає, що гідроксисполуки діють як кислоти, коли вони реагують з сильними підставами і як основи, коли вони реагують з сильними кислотами. Амфотеризм гідроксиду алюмінію, який зазвичай існує як гідрат\(\ce{Al(H2O)3(OH)3}\), відображається в його розчинності як в сильних кислотах, так і в сильних підставах. У сильних підставах відносно нерозчинний гідратований гідроксид алюмінію\(\ce{Al(H2O)3(OH)3}\), перетворюється в розчинний іон\(\ce{[Al(H2O)2(OH)4]-}\), шляхом реакції з гідроксид-іоном:
\[[\ce{Al(H2O)3(OH)3}](aq)+\ce{OH-}(aq)⇌\ce{H2O}(l)+\ce{[Al(H2O)2(OH)4]-}(aq) \nonumber \]
У цій реакції протон переноситься з однієї з зв'язаних алюмінієм молекул Н 2 О в гідроксидний іон в розчині. \(\ce{Al(H2O)3(OH)3}\)З'єднання при цьому діє як кислота в цих умовах. З іншого боку, при розчиненні в сильних кислотах він перетворюється в розчинний іон\(\ce{[Al(H2O)6]^3+}\) шляхом реакції з іоном гідронію:
\[\ce{3H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq)⇌\ce{Al(H2O)6^3+}(aq)+\ce{3H2O}(l) \nonumber \]
При цьому протони переносяться з іонів гідронію в розчині\(\ce{Al(H2O)3(OH)3}\), а з'єднання функціонує як основа.
Резюме
Сильні сторони кислот і підстав Бронстеда-Лоурі у водних розчині можуть бути визначені їх кислотними або основними константами іонізації. Більш сильні кислоти утворюють слабші кон'югатні основи, а слабші кислоти утворюють більш міцні кон'югатні підстави. Таким чином, сильні кислоти повністю іонізуються у водному розчині, оскільки їх кон'югатні основи є слабшими основами, ніж вода. Слабкі кислоти іонізуються лише частково, оскільки їх кон'югатні основи досить сильні, щоб успішно конкурувати з водою за володіння протонами. Сильні підстави реагують з водою з кількісним утворенням гідроксидних іонів. Слабкі підстави дають лише невеликі кількості гідроксид-іона. Сильні сторони бінарних кислот збільшуються зліва направо протягом періоду періодичної таблиці (CH 4 < NH 3 < H 2 O < HF), і вони збільшуються вниз по групі (HF < HCl < HBr < HI). Сильні сторони оксикислот, які містять той же центральний елемент, збільшуються зі збільшенням числа окислення елемента (H 2 SO 3 < H 2 SO 4). Сильні сторони оксикислот також збільшуються у міру збільшення електронегативності центрального елемента [H 2 SeO 4 < H 2 SO 4].
Ключові рівняння
- \(K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}}\)
- \(K_\ce{b}=\ce{\dfrac{[HB+][OH- ]}{[B]}}\)
- \(K_a \times K_b = 1.0 \times 10^{−14} = K_w \,(\text{at room temperature})\)
- \(\textrm{Percent ionization}=\ce{\dfrac{[H3O+]_{eq}}{[HA]_0}}×100\)
Глосарій
- Постійна іонізації кислоти (K a)
- постійна рівноваги для іонізації слабкої кислоти
- базова постійна іонізації (K b)
- постійна рівноваги для іонізації слабкої основи
- вирівнюючий ефект води
- будь-яка кислота сильніше\(\ce{H3O+}\), ніж або будь-яка основа, сильніша за ОН - реагуватиме з водою з утворенням\(\ce{H3O+}\), або OH - відповідно; вода діє як основа, щоб усі сильні кислоти виглядали однаково сильними, і вона діє як кислота, щоб всі міцні основи виглядали однаково сильними
- оксикислота
- з'єднання, що містить неметал і одну або кілька гідроксильних груп
- відсоток іонізації
- відношення концентрації іонізованої кислоти до початкової концентрації кислоти, раз 100
