14.1: Бронстед-низькі кислоти та основи
- Page ID
- 22779
- Визначте кислоти, основи та кон'юговані кислотно-лужні пари відповідно до визначення Бронстеда-Лоурі
- Напишіть рівняння для реакцій іонізації кислоти та основи
- Використовуйте постійну іонного продукту для води для розрахунку концентрації іонів гідронію та гідроксиду
- Охарактеризуйте кислотно-лужну поведінку амфіпротичних речовин
Кислоти і основи відомі з давніх-давен. Коли Роберт Бойл охарактеризував їх в 1680 році, він зазначив, що кислоти розчиняють багато речовин, змінюють колір деяких природних барвників (наприклад, вони змінюють лакмус з синього на червоний), і втрачають ці характерні властивості після контакту з лугами (підставами). У вісімнадцятому столітті було визнано, що кислоти мають кислий смак, вступають в реакцію з вапняком для звільнення газоподібної речовини (тепер відомо як СО 2), і взаємодіють з лугами з утворенням нейтральних речовин. У 1815 році Хамфрі Деві багато в чому сприяв розвитку сучасної кислотно-лужної концепції, продемонструвавши, що водень є незамінною складовою кислот. Приблизно в той же час Джозеф Луї Гей-Люссак дійшов висновку, що кислоти - це речовини, які можуть нейтралізувати основи і що ці два класи речовин можна визначити лише з точки зору один одного. Значення водню було знову підкреслено в 1884 році, коли Сванте Арреніус визначив кислоту як сполуку, яка розчиняється у воді з утворенням катіонів водню (тепер визнаних іонами гідронію) і основу як сполуку, яка розчиняється у воді з утворенням гідроксидних аніонів.
У попередньому розділі про хімічні реакції ми визначили кислоти та основи, як це робив Арреній: Ми визначили кислоту як сполуку, яка розчиняється у воді з отриманням іонів гідронію (H 3 O +), і основу як сполуку, яка розчиняється у воді з утворенням гідроксидних іонів (\(\ce{OH-}\)). Це визначення не є неправильним, воно просто обмежене.
Пізніше ми розширили визначення кислоти або основи, використовуючи більш загальне визначення, запропоноване в 1923 році датським хіміком Йоханнесом Бронстедом та англійським хіміком Томасом Лоурі. Їх визначення зосереджується на протоні,\(\ce{H^+}\). Протон - це те, що залишається, коли нормальний атом водню\(\ce{^1_1H}\), втрачає електрон. Сполука, яка дарує протон іншій сполуці, називається кислотою Бренстеда-Лоурі, а сполука, яка приймає протон, називається основою Бренстеда-Лоурі. Кислотно-лужна реакція - це перенесення протона від донора протона (кислоти) до протонного акцептора (основи). У наступному розділі цього тексту ми представимо найбільш загальну модель кислотно-лужної поведінки, введену американським хіміком Г.Н. Льюїсом.
Кислоти можуть бути такими сполуками, як HCl або H 2 SO 4, органічними кислотами, такими як оцтова кислота (\(\ce{CH_3COOH}\)) або аскорбінова кислота (вітамін С), або H 2 O. Аніони (такі як\(\ce{HSO_4^-}\)\(\ce{H_2PO_4^-}\)\(\ce{HS^-}\),, і\(\ce{HCO_3^-}\)) і катіони (наприклад\(\ce{H_3O^+}\)\(\ce{NH_4^+}\),, і\(\ce{[Al(H_2O)_6]^{3+}}\)) також виступають в якості кислот. Бази діляться на ті ж три категорії. Базами можуть бути нейтральні молекули (наприклад\(\ce{H_2O}\)\(\ce{NH_3}\),, і\(\ce{CH_3NH_2}\)), аніони (такі як\(\ce{OH^-}\)\(\ce{HS^-}\),\(\ce{HCO_3^-}\),\(\ce{CO_3^{2−}}\),\(\ce{F^-}\), і\(\ce{PO_4^{3−}}\)) або катіони (такі як\(\ce{[Al(H_2O)_5OH]^{2+}}\)). Найбільш звичними основами є іонні сполуки, такі як\(\ce{NaOH}\) і\(\ce{Ca(OH)_2}\), які містять іон гідроксиду,\(\ce{OH^-}\). Гідроксид-іон в цих сполуках приймає протон з кислот для утворення води:
\[\ce{H^+ + OH^- \rightarrow H_2O} \label{14.11} \]
Ми називаємо продукт, який залишається після того, як кислота дарує протон кон'югатною основою кислоти. Цей вид є основою, оскільки він може приймати протон (для повторного утворення кислоти):
\[\text{acid} \rightleftharpoons \text{proton} + \text{conjugate base}\label{14.12a} \]
\[\ce{HF \rightleftharpoons H^+ + F^-} \label{14.12b} \]
\[\ce{H_2SO_4 \rightleftharpoons H^+ + HSO_4^{−}}\label{14.12c} \]
\[\ce{H_2O \rightleftharpoons H^+ + OH^-}\label{14.12d} \]
\[\ce{HSO_4^- \rightleftharpoons H^+ + SO_4^{2−}}\label{14.12e} \]
\[\ce{NH_4^+ \rightleftharpoons H^+ + NH_3} \label{14.12f} \]
Ми називаємо продукт, який виходить, коли основа приймає протон, кон'югатну кислоту основи. Цей вид є кислотою, оскільки він може відмовитися від протона (і, таким чином, повторно формувати основу):
\[\text{base} + \text{proton} \rightleftharpoons \text{conjugate acid} \label{14.13a} \]
\[\ce{OH^- +H^+ \rightleftharpoons H2O}\label{14.13b} \]
\[\ce{H_2O + H^+ \rightleftharpoons H3O+}\label{14.13c} \]
\[\ce{NH_3 +H^+ \rightleftharpoons NH4+}\label{14.13d} \]
\[\ce{S^{2-} +H^+ \rightleftharpoons HS-}\label{14.13e} \]
\[\ce{CO_3^{2-} +H^+ \rightleftharpoons HCO3-}\label{14.13f} \]
\[\ce{F^- +H^+ \rightleftharpoons HF} \label{14.13g} \]
У цих двох наборах рівнянь поведінка кислот як донорів протонів та основ як акцепторів протонів представлена ізольовано. Насправді всі кислотно-лужні реакції передбачають перенесення протонів між кислотами і підставами. Для прикладу розглянемо кислотно-лужну реакцію, яка відбувається при розчиненні аміаку у воді. Молекула води (функціонує як кислота) переносить протон до молекули аміаку (функціонуючої як основа), отримуючи кон'югатну основу води\(\ce{OH^-}\), і кон'югатну кислоту аміаку,\(\ce{NH4+}\):
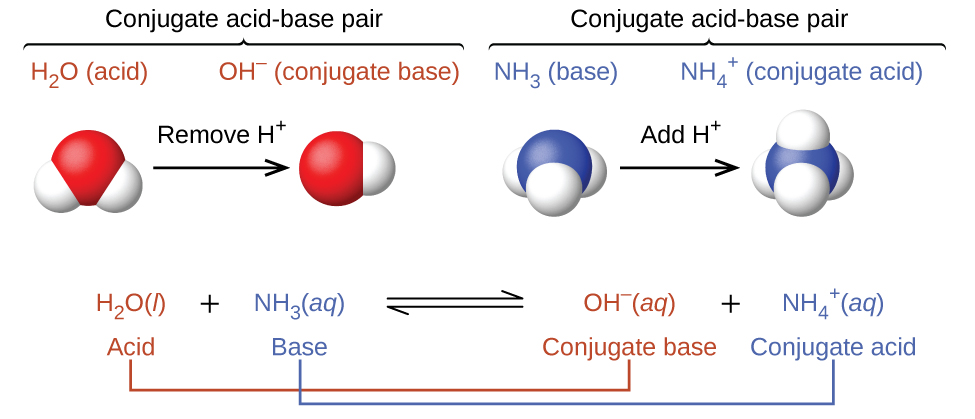
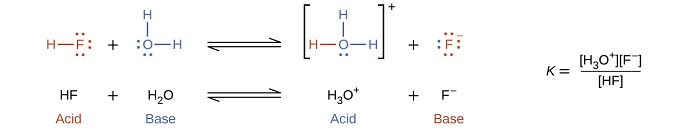
Реакція між кислотою Brønsted-Lowry і водою називається іонізацією кислоти. Наприклад, коли фтористий водень розчиняється у воді і іонізується, протони переносяться з молекул фториду водню в молекули води, утворюючи іони гідронію і фторидні іони:
Коли ми додаємо основу до води, відбувається реакція іонізації основи, в якій протони переносяться від молекул води до молекул основи. Наприклад, додавання піридину у воду дає гідроксид-іони та іони піридинію:
Зверніть увагу, що обидві ці реакції іонізації представлені як процеси рівноваги. Відносна ступінь протікання цих реакцій іонізації кислоти та основи є важливою темою, розглянутою в наступному розділі цієї глави. У попередніх параграфах ми бачили, що вода може функціонувати як кислота або основа, залежно від природи розчиненої в ній розчиненої речовини. Насправді в чистій воді або в будь-якому водному розчині вода виступає і як кислота, і основа. Дуже мала частка молекул води передають протони іншим молекулам води з утворенням іонів гідронію та гідроксидних іонів:
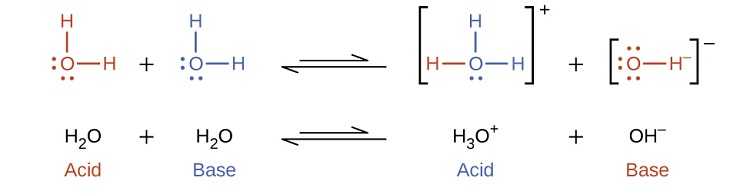
Цей тип реакції, при якій речовина іонізується, коли одна молекула речовини реагує з іншою молекулою тієї ж речовини, називається автоіонізацією. Чиста вода піддається автоіонізації в дуже незначній мірі. Лише близько двох\(10^9\) молекул у зразку чистої води іонізуються при 25 °С, постійна рівноваги для іонізації води називається постійною іонного продукту для води (K w):
\[\ce{H_2O}_{(l)}+\ce{H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)}+\ce{OH^-}_{(aq)}\;\;\; K_\ce{w}=\ce{[H_3O^+][OH^- ]} \label{14.14} \]
Незначна іонізація чистої води відбивається на малому значенні постійної рівноваги; при 25° С кВт має значення\(1.0 \times 10^{−14}\). Процес ендотермічний, і тому ступінь іонізації і результуючі концентрації іонів гідронію і гідроксид-іона збільшуються з температурою. Наприклад, при 100° C значення для приблизно\(5.1 \times 10^{−13}\),\(K_\ce{w}\) приблизно в 50 разів більше, ніж значення при 25° C.
Що таке концентрація іонів гідронію та концентрація гідроксид-іонів у чистій воді при 25° C?
Рішення
Автоіонізація води дає однакову кількість іонів гідронію та гідроксиду. Тому в чистій воді,\(\ce{[H_3O^+]} = \ce{[OH^- ]}\). При 25 °C:
\[K_\ce{w}=\ce{[H_3O^+][OH^- ]}=\ce{[H_3O^+]^2}=\ce{[OH^- ]^2}=1.0 \times 10^{−14} \nonumber \]
Отже:
\[\ce{[H_3O^+]}=\ce{[OH^- ]}=\sqrt{1.0 \times 10^{−14}} =1.0 \times 10^{−7}\; M \nonumber \]
Концентрація іонів гідронію та концентрація гідроксид-іонів однакові, і ми знаходимо, що обидва рівні\(1.0 \times 10^{−7}\; M\).
Іонний продукт води при 80° C становить\(2.4 \times 10^{−13}\). Які концентрації іонів гідронію та гідроксиду в чистій воді при 80° C?
- Відповідь
-
\(\ce{[H_3O^+]} = \ce{[OH^- ]} = 4.9 \times 10^{−7}\; M\)
Важливо усвідомлювати, що автоіонізаційна рівновага для води встановлюється у всіх водних розчині. Додавання кислоти або основи в воду не змінить положення рівноваги. Приклад 14.12 демонструє кількісні аспекти цього співвідношення між концентраціями гідронію та гідроксид-іонів.
Зворотна пропорційність [H 3 O +] і [ОН -] Розчин вуглекислого газу у воді має концентрацію іонів гідронію\(2.0 \times 10^{−6}\; M\). Яка концентрація гідроксид-іона при 25° C?
Рішення
Відомо значення постійної іонного продукту для води при 25 °С:
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)} + \ce{OH^-}_{(aq)} \nonumber \]
\[K_\ce{w}=\ce{[H3O+][OH^- ]}=1.0 \times 10^{−14} \nonumber \]
Таким чином, ми можемо обчислити відсутню концентрацію рівноваги.
Перестановка виразу K w дає\([\ce{OH^- }]\) прямо пропорційну оберненому [H 3 O +]:
\[[\ce{OH^- }]=\dfrac{K_{\ce w}}{[\ce{H_3O^+}]}=\dfrac{1.0 \times 10^{−14}}{2.0 \times 10^{−6}}=5.0 \times 10^{−9} \nonumber \]
Концентрація гідроксид-іонів у воді зменшується до\(5.0 \times 10^{−9}\: M\), коли концентрація іонів водню збільшується до\(2.0 \times 10^{−6}\; M\). Це очікується від принципу Ле Шательє; реакція автоіонізації зміщується вліво, щоб зменшити напругу підвищеної концентрації іонів гідронію і\(\ce{[OH^- ]}\) зменшується відносно цієї в чистій воді.
Перевірка цих концентрацій підтверджує, що наша арифметика правильна:
\[\begin{align*} K_\ce{w} &=\ce{[H_3O^+][OH^- ]} \\[4pt] &=(2.0 \times 10^{−6})(5.0 \times 10^{−9})\\[4pt] &=1.0 \times 10^{−14} \end{align*} \nonumber \]
Яка концентрація іонів гідронію у водному розчині з концентрацією гідроксид-іонів 0,001 М при 25 °С?
- Відповідь
-
\[\ce{[H3O+]} = 1 \times 10^{−11} M \nonumber \]
амфіпротичні види
Як і вода, багато молекул та іонів можуть або набирати, або втрачати протон за відповідних умов. Такі види, як кажуть, амфіпротичні. Іншим терміном, який використовується для опису таких видів, є амфотерним, який є більш загальним терміном для виду, який може діяти як кислота або основа за будь-яким визначенням (не лише Бронстед-Лоурі). Розглянемо, наприклад, іон бікарбонату, який може або пожертвувати, або приймати протон, як показано тут:
\[\ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{CO^{2-}}_{3(aq)} + \ce{H_3O^+}_{(aq)} \label{14.15a} \]
\[ \ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{H_2CO}_{3(aq)} + \ce{OH^-}_{(aq)} \label{14.15b} \]
Напишіть окремі рівняння, що представляють реакцію\(\ce{HSO3-}\)
- як кислота з\(\ce{OH^-}\)
- як основа з HI
Рішення
- \(\ce{HSO3-}(aq)+ \ce{OH^-}(aq)\rightleftharpoons \ce{SO3^2-}(aq)+ \ce{H_2O}_{(l)} \)
- \(\ce{HSO3-}(aq)+\ce{HI}(aq)\rightleftharpoons \ce{H2SO3}(aq)+\ce{I-}(aq)\)
Напишіть окремі рівняння, що представляють реакцію\(\ce{H2PO4-}\)
- в якості основи з HBr
- як кислота з\(\ce{OH^-}\)
- Відповідь
-
\(\ce{H2PO4-}(aq)+\ce{HBr}(aq)\rightleftharpoons \ce{H3PO4}(aq)+\ce{Br-}(aq)\)
- Відповідь б
-
\(\ce{H2PO4-}(aq)+\ce{OH^-} (aq)\rightleftharpoons \ce{HPO4^2-}(aq)+ \ce{H_2O}_{(l)} \)
Резюме
З'єднання, яке може пожертвувати протон (іон водню) іншій сполуці, називається кислотою Бронстеда-Лоурі. З'єднання, яке приймає протон, називається основою Бронстеда-Лоурі. Вид, що залишився після того, як кислота Бронстеда-Лоурі втратила протон, є кон'югатною основою кислоти. Вид, що утворився, коли основа Бронстеда-Лоурі отримує протон, є кон'югатною кислотою основи. Таким чином, кислотно-лужна реакція відбувається при переході протона з кислоти в основу, з утворенням кон'югатної основи реактивної кислоти і утворенням кон'югатної кислоти основи реагенту. Амфіпротичні види можуть виступати як донорами протонів, так і протонними акцепторами. Вода - найважливіший амфіпротичний вид. Він може утворювати як іон гідронію, H 3 O +, так і гідроксид-іон,\(\ce{OH^-}\) коли піддається автоіонізації:
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}(aq)+\ce{OH^-} (aq) \nonumber \]
Іонний твір води, K w - постійна рівноваги для реакції автоіонізації:
\[K_\ce{w}=\mathrm{[H_3O^+][OH^- ]=1.0 \times 10^{−14} \; at\; 25°C} \nonumber \]
Ключові рівняння
- \[K_{\ce w} = \ce{[H3O+][OH^- ]} = 1.0 \times 10^{−14}\textrm{ (at 25 °C)} \nonumber \]
Глосарій
- іонізація кислоти
- реакція, що включає перенесення протона з кислоти у воду, що дає іони гідронію та кон'югатну основу кислоти
- амфіпротичний
- види, які можуть або отримати або втратити протон в реакції
- амфотерних
- види, які можуть виступати в якості кислоти або основи
- автоіонізація
- реакція між однаковими видами, що дають іонні продукти; для води ця реакція передбачає перенесення протонів з утворенням іонів гідронію та гідроксиду
- базова іонізація
- реакція, що включає перенесення протона з води на основу, що дає гідроксид-іони і кон'югатну кислоту основи
- Бронстро-Лоурі кислота
- донор протонів
- Бронстед-Лоурі база
- протонний акцептор
- кон'югатна кислота
- речовина, що утворюється, коли основа отримує протон
- сполучені підстави
- речовина, що утворюється, коли кислота втрачає протон
- константа іонного продукту для води (K w)
- константа рівноваги для автоіонізації води
