12.3: Бронстед-низькі кислоти та основи
- Page ID
- 22486
←
- Визначте кислоту Бронстеда-Лоурі та основу Бронстеда-Лоурі.
- Визначте кон'югатні кислотно-лужні пари в кислотно-лужній реакції.
Визначення Arrhenius кислоти і основи обмежується водними (тобто водними) розчинами. Хоча це корисно, оскільки вода є звичайним розчинником, вона обмежена взаємозв'язком між іоном H + та OH − іоном. Що було б корисним, так це загальне визначення, більш застосовне до інших хімічних реакцій і, що важливо, незалежне від Н 2 О.
У 1923 році датський хімік Йоганнес Бронстед та англійський хімік Томас Лоурі самостійно запропонували нові визначення кислот і основ, які зосереджені на перенесенні протонів. Кислота Бронстеда-Лоурі - це будь-який вид, який може пожертвувати протон (H +) іншій молекулі. Основа Бронстеда-Лоурі - це будь-який вид, який може приймати протон з іншої молекули. Коротше кажучи, кислота Бронстеда-Лоурі є донором протонів (ПД), тоді як основа Бронстеда-Лоурі - це акцептор протонів (ПА).
Легко помітити, що визначення Бронстеда-Лоурі охоплює визначення Arrhenius кислот і підстав. Розглянемо прототипову кислотно-лужну реакцію Arrhenius:
\[\underset{acid}{H^{+}(aq)}+\underset{base}{OH^{-}(aq)}\rightarrow H_{2}O\, (l)\nonumber \]
Відзначаються кислотні види і базові види. Однак протон є (за визначенням) донором протонів (позначений PD), тоді як ОН − іон діє як акцептор протона (позначений ПА):
\[\underset{PD}{H^{+}(aq)}+\underset{PA}{OH^{-}(aq)}\rightarrow H_{2}O\, (l)\nonumber \]
Донором протонів є кислота Бронстеда-Лоурі, а акцептор протона - основа Бронстеда-Лоурі:
\[\underset{BL\, acid}{H^{+}(aq)}+\underset{BL\, base}{OH^{-}(aq)}\rightarrow H_{2}O\, (l)\nonumber \]
Таким чином, H + є кислотою за обома визначеннями, а OH − є базою за обома визначеннями.
Аміак (NH 3) є основою, хоча він не містить іонів OH − у своїй формулі. Натомість він генерує OH − іони як продукт реакції переносу протонів з молекулами H 2 O; NH 3 діє як основа Бронстеда-Лоурі, а H 2 O діє як кислота Бронстеда-Лоурі:
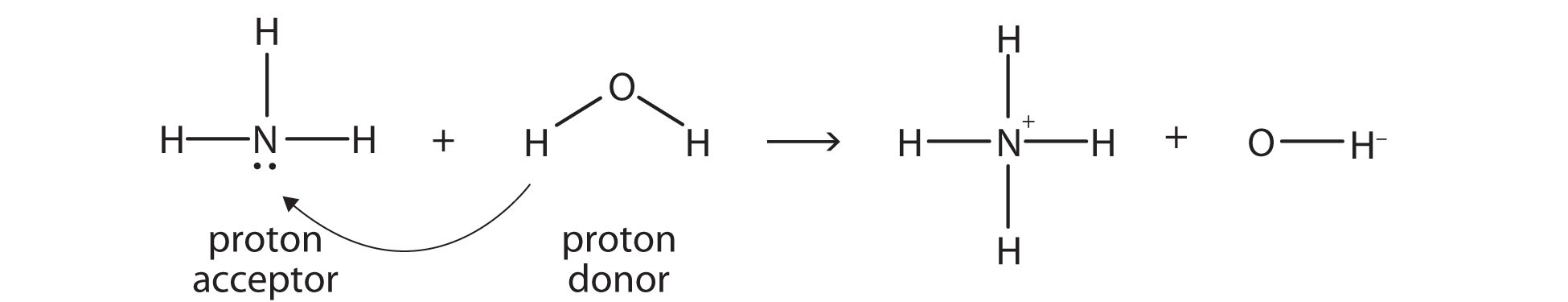
Реакція з водою називається гідролізом; ми говоримо, що NH 3 гідролізується, утворюючи іони NH 4+ та OH − іони.
Навіть розчинення кислоти Arrhenius у воді можна вважати кислотно-лужною реакцією Бронстеда-Лоурі. Розглянемо процес розчинення HCl (g) у воді, щоб зробити водний розчин соляної кислоти. Процес можна записати наступним чином:
\[\ce{HCl(g) + H2O(ℓ) → H3O+(aq) + Cl^{-}(aq)} \nonumber \nonumber \]
HCl (g) є донором протонів і, отже, кислотою Бронстеда-Лоурі, тоді як H 2 O є акцептором протонів і основою Бронстеда-Лоурі. Ці два приклади показують, що Н 2 О може виступати як донором протонів, так і акцептором протонів, залежно від того, яка інша речовина знаходиться в хімічній реакції. Речовина, яка може виступати донором протонів або акцептором протонів, називається амфіпротом. Вода, мабуть, найпоширеніша амфіпротична речовина, з якою ми зіткнемося, але інші речовини також амфіпротичні.
Визначте кислоту Бренстеда-Лоурі та основу Бренстеда-Лоурі в цьому хімічному рівнянні.
\[\ce{C6H5OH + NH2^{-} -> C6H5O^{-} + NH3} \nonumber \nonumber \]
Рішення
Молекула C 6 H 5 OH втрачає H +; це донор протонів та кислота Бренстеда-Лоурі. NH 2 − іон (званий амідним іоном) приймає іон H +, щоб стати NH 3, тому це основа Бронстеда-Лоурі.
Визначте кислоту Бренстеда-Лоурі та основу Бренстеда-Лоурі в цьому хімічному рівнянні.
\[\ce{Al(H2O)6^{3+} + H2O -> Al(H2O)5(OH)^{2+} + H3O^{+}} \nonumber \nonumber \]
- Відповідь
-
Бронстед-Lowry кислота: Al (H 2 O) 6 3+; Бронстед-Лоурі основа: H 2 O
У реакції між NH 3 і H 2 O,
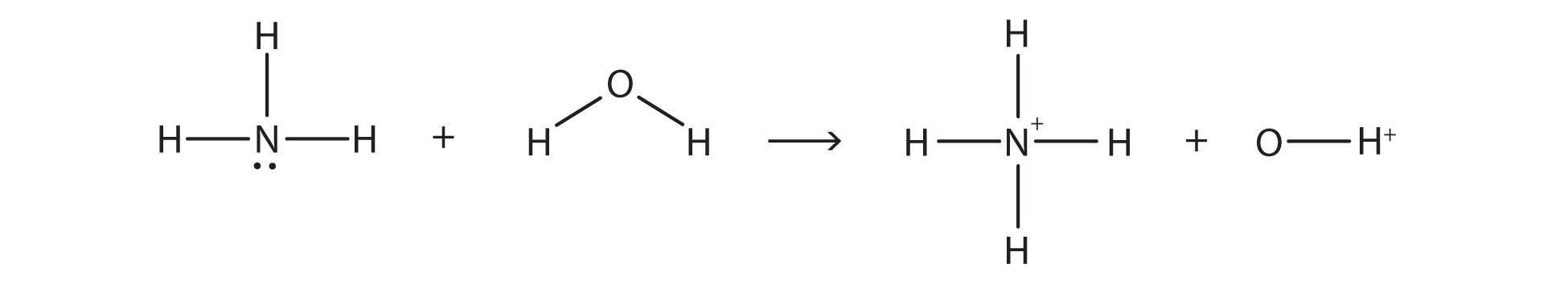
хімічна реакція не доходить до завершення; швидше, відбувається і зворотний процес, і врешті-решт два процеси скасовують будь-які додаткові зміни. У цей момент ми говоримо, що хімічна реакція знаходиться в рівновазі. Обидва процеси все ще відбуваються, але будь-яка чиста зміна одним процесом протистоїть однаковій чистій зміні іншого процесу; це динамічна, а не статична рівновага. Оскільки відбуваються обидві реакції, має сенс використовувати подвійну стрілку замість однієї стрілки:
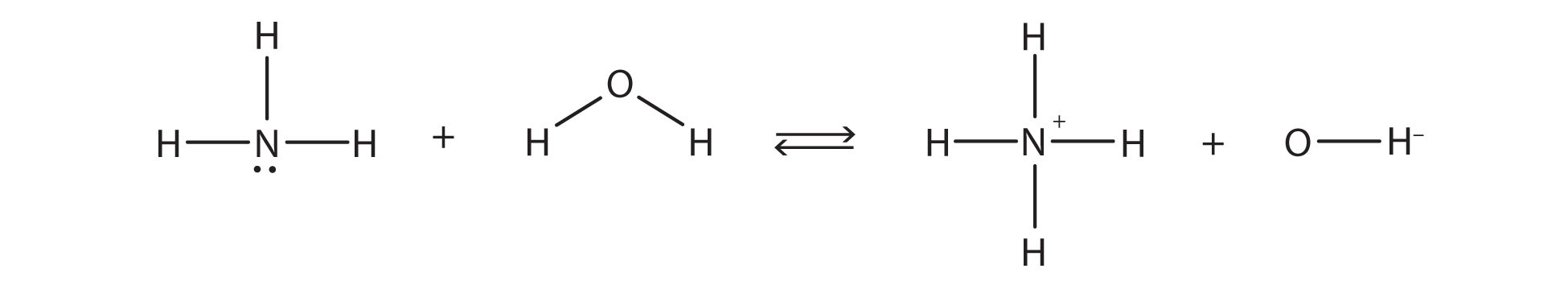
Що ви помічаєте про зворотну реакцію? Іон NH 4 + дарує протон іону OH −, який приймає його. Це означає, що іон NH 4 + діє як донор протонів, або кислота Бронстеда-Лоурі, тоді як OH - іон, акцептор протонів, діє як основа Бронстеда-Лоурі. Зворотна реакція також є реакцією кислотної основи Бронстеда-Лоурі:
Основи BL. NH4+ і H2O є BL кислоти. lt-chem-64081" стиль = "ширина: 750px; висота: 173px;» ширина = «750px» висота = «173px» src=»/@api /deki/files/92035/3765cabac9591a0fb3dd5878f56075e2.jpg "дані перепела ID = «174">
Це означає, що обидві реакції є кислотно-лужними реакціями за визначенням Бронстеда-Лоурі. Якщо розглядати види в цій хімічній реакції, два набори подібних видів існують з обох сторін. У межах кожного набору два види відрізняються протоном у своїх формулах, і один член набору - кислота Бронстеда-Лоурі, тоді як інший член - основа Бронстеда-Лоурі. Ці набори позначені тут:
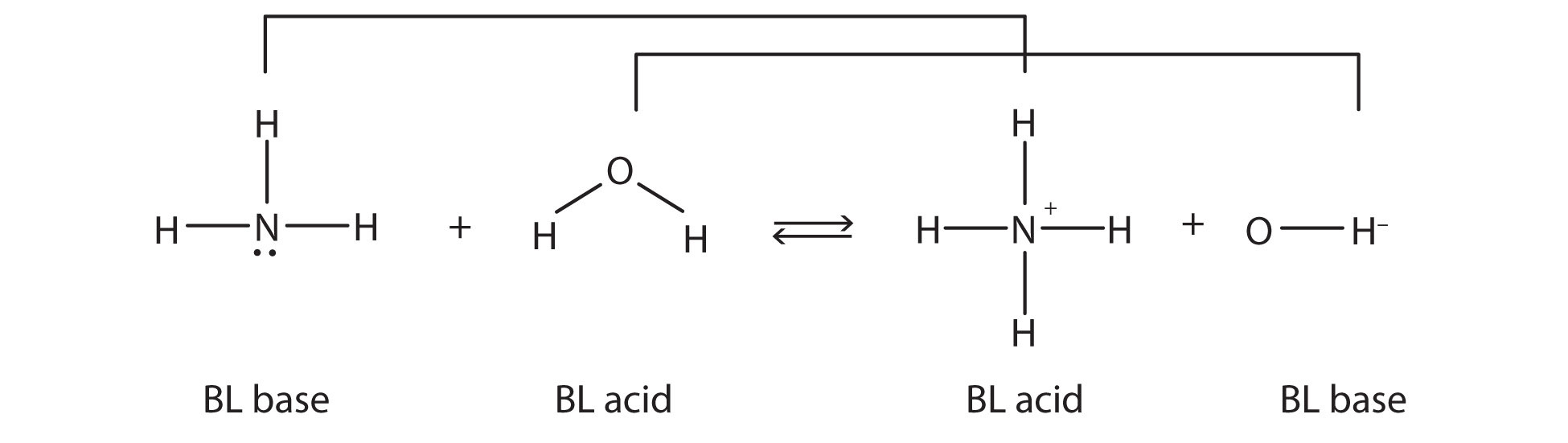
Два набори - NH 3/NH 4 + та H 2 O/OH - називаються сполученими кислотно-лужними парами. Ми говоримо, що NH 4 + - це кон'югатна кислота NH 3, OH - це сполучена основа H 2 O тощо. Кожну кислотно-лужну реакцію Бронстеда-Лоурі можна позначити двома кон'югованими кислотно-лужними парами.
Визначте сполучені кислотно-лужні пари в цій рівновазі.
\[(CH_{3})_{3}N+H_{2}O\rightleftharpoons (CH_{3})_{3}NH^{+}+OH^{-} \nonumber \nonumber \]
Рішення
Одна пара - H 2 O і OH −, де H 2 O має ще одну H + і є кон'югованою кислотою, тоді як OH - має на одну меншу H + і є сполученою основою. Інша пара складається з (CH 3) 3 N і (CH 3) 3 NH +, де (CH 3) 3 NH + є кон'югатна кислота (вона має додатковий протон) і (СН 3) 3 Н є кон'югатною основою.
Визначте сполучені кислотно-лужні пари в цій рівновазі.
\[NH_{2}^{-}+H_{2}O\rightleftharpoons NH_{3}+OH^{-} \nonumber \nonumber \]
- Відповідь
-
H 2 O (кислота) і OH − (основа); NH 2 − (основа) і NH 3 (кислота)
Багато побутові засоби - це кислоти або основи. Наприклад, власник басейну може використовувати соляну кислоту для очищення басейну. Муріатична кислота - інша назва HCl (aq). У розділі 4.6 оцет згадувався як розведений розчин оцтової кислоти [HC 2 H 3 O 2 (aq)]. У аптечці можна знайти пляшку з таблетками вітаміну С; хімічна назва вітаміну С - аскорбінова кислота (HC 6 H 7 O 6).
Однією з більш звичних побутових баз є NH 3, яка зустрічається в численних чистячих засобах. NH 3 є основою, оскільки збільшує концентрацію OH − іонів, реагуючи з H 2 O:
Н 3 (ак) + Н 2 О () → Н 4 + (ак) + ОН − (ак)Багато мила також трохи основні, оскільки вони містять сполуки, які діють як основи Бренстеда-Лоурі, приймаючи протони з H 2 O і утворюючи надлишок OH − іонів. Це одне з пояснень того, чому мильні розчини слизькі.
Мабуть, найнебезпечнішою побутовою хімією є очищувач дренажу на основі лугу. Lye - загальна назва NaOH, хоча він також використовується як синонім KOH. Луг - надзвичайно їдка хімічна речовина, яка може вступати в реакцію з жиром, волоссям, частинками їжі та іншими речовинами, які можуть накопичуватися та засмічувати водопровід. На жаль, луг також може атакувати тканини тіла та інші речовини в нашому організмі. Таким чином, коли ми використовуємо очищувачі зливу на основі лугу, ми повинні бути дуже обережними, щоб не торкнутися жодного твердого очищувача зливу або пролити воду, в яку він був налитий. Більш безпечні, що не лужать дренажні очисники (як той, що на супровідному малюнку) використовують перекисні сполуки, щоб реагувати на матеріали в засміченні і очистити стік.

Ключові виноси
- Кислота Бронстеда-Лоурі є донором протонів; основа Бронстеда-Лоурі - це акцептор протонів.
- Кислотно-лужні реакції включають два набори кон'югатних кислотно-лужних пар.
