4.4: Урожайність реакції
- Page ID
- 22784
- Поясніть поняття теоретичного виходу і граничних реагентів/реагентів.
- Вивести теоретичний вихід для реакції за заданих умов.
- Обчисліть відсотковий вихід для реакції.
Відносні кількості реагентів і продуктів, представлених у збалансованому хімічному рівнянні, часто називають стехіометричними кількостями. Всі вправи попереднього модуля задіяні стехіометричні кількості реагентів. Наприклад, при розрахунку кількості продукту, що утворюється з заданої кількості реагенту, передбачалося, що будь-які інші необхідні реагенти були доступні в стехіометричних кількостях (або більших). У цьому модулі розглядаються більш реалістичні ситуації, при яких реагенти відсутні в стехіометричних кількостях.
обмежуючий реагент
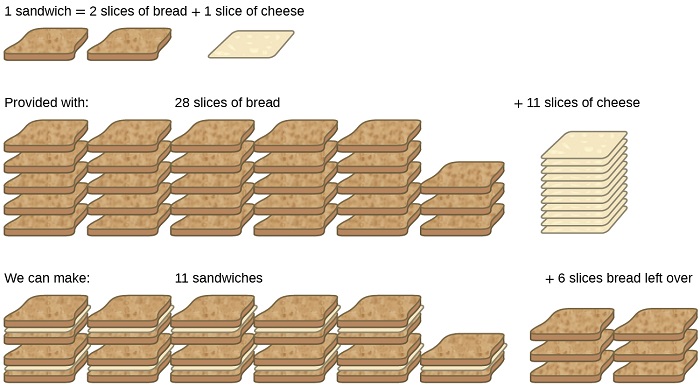
Розглянемо ще одну аналогію їжі, роблячи бутерброди з сиром на грилі (рис.\(\PageIndex{1}\)):
\[\text{1 slice of cheese} + \text{2 slices of bread} \rightarrow \text{1 sandwich} \label{4.5.A} \]
Стіхіометричні кількості інгредієнтів сендвіча для цього рецепта - це шматочки хліба та сиру в співвідношенні 2:1. За умови 28 скибочок хліба і 11 скибочок сиру, можна приготувати 11 бутербродів за наданою рецептурою, використовуючи весь наданий сир і залишивши шість скибочок хліба. При цьому сценарії кількість приготованих бутербродів була обмежена кількістю скибочок сиру, а хлібні скибочки були надані в надлишку.
Розглянемо зараз це поняття щодо хімічного процесу, реакції водню з хлором з виходом хлористого водню:
\[\ce{H2}(g) + \ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
Збалансоване рівняння показує, що водень і хлор реагують у стехіометричному співвідношенні 1:1. Якщо ці реагенти надаються в будь-яких інших кількостях, один з реагентів майже завжди буде повністю споживатися, тим самим обмежуючи кількість продукту, який може генеруватися. Ця речовина є граничним реагентом, а інша речовина - надлишковим реагентом. Визначення граничних та надлишкових реагентів для даної ситуації вимагає обчислення молярних кількостей кожного наданого реагенту та порівняння їх зі стехіометричними кількостями, представленими у збалансованому хімічному рівнянні.
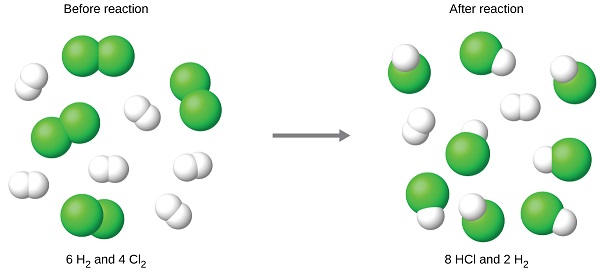
Наприклад, уявіть, що поєднують 6 родимок H 2 і 4 родимки Cl 2. Визначення граничного реагенту передбачає порівняння кількості продукту, очікуваного для повної реакції кожного реагенту. Кожна кількість реагенту використовується для окремого розрахунку кількості продукту, який буде утворюватися в стехіометрії реакції. Реагент, що дає меншу кількість продукту, є граничним реагентом.
Для прикладу в попередньому пункті повна реакція водню дасть
\[\mathrm{mol\: HCl\: produced=6\: mol\:H_2\times \dfrac{2\: mol\: HCl}{1\: mol\:H_2}=12\: mol\: HCl} \nonumber \]
Повна реакція наданого хлору буде виробляти
\[\mathrm{mol\: HCl\: produced=4\: mol\:Cl_2\times \dfrac{2\: mol\: HCl}{1\: mol\:Cl_2}=8\: mol\: HCl} \nonumber \]
Хлор буде повністю споживатися після того, як буде вироблено 8 моль HCl. Оскільки було надано достатньо водню для отримання 12 молів HCl, після завершення цієї реакції залишиться нереагуючий водень. Тому хлор є граничним реагентом, а водень - надлишковим реагентом (рис.\(\PageIndex{2}\)). Для визначення кількості надлишку реагенту, яке залишилося, кількість водню, споживаного в реакції, можна відняти від вихідної кількості водню.
Кількість споживаного водню становить
\[\mathrm{mol\: H_2\: produced=8\: mol\:HCl\times \dfrac{1\: mol\: H_2}{2\: mol\:HCl}=4\: mol\: H_2} \nonumber \]
Відніміть витрачений водень з початкової кількості
\[\mathrm{mole\: of\: excess\:H_{2}=6\:mol\:H_{2}\:starting\:-\:4\:mol\:H_{2}\:consumed\:=\:2\:mol\:H_{2}\; excess} \nonumber \]
Нітрид кремнію - це дуже тверда, стійка до високих температур кераміка, яка використовується як компонент лопатей турбін в реактивних двигунів. Його готують за наступним рівнянням:
\[\ce{3Si}(s)+\ce{2N2}(g)\rightarrow \ce{Si3N4}(s) \nonumber \]
Який граничний реагент, коли реагують 2,00 г Si і 1,50 г N 2?
Рішення
Обчисліть надані молярні кількості реагентів, а потім порівняйте ці суми з збалансованим рівнянням, щоб визначити граничний реагент.
\[\mathrm{mol\: Si=2.00\:\cancel{g\: Si}\times \dfrac{1\: mol\: Si}{28.09\:\cancel{g\: Si}}=0.0712\: mol\: Si} \nonumber \]
\[\mathrm{mol\:N_2=1.50\:\cancel{g\:N_2}\times \dfrac{1\: mol\:N_2}{28.02\:\cancel{g\:N_2}}=0.0535\: mol\:N_2} \nonumber \]
Надане молярне співвідношення Si:N 2 становить:
\[\mathrm{\dfrac{0.0712\: mol\: Si}{0.0535\: mol\:N_2}=\dfrac{1.33\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
Стіхіометричне співвідношення SiN: 2 становить:
\[\mathrm{\dfrac{3\: mol\: Si}{2\: mol\:N_2}=\dfrac{1.5\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
Порівняння цих співвідношень показує, що Si забезпечується в меншій, ніж стехіометричної кількості, як і граничний реагент.
Крім того, обчислити кількість продукту, очікуваного для повної реакції кожного з наданих реагентів. 0.0712 молі кремнію дадуть
\[\mathrm{mol\:Si_3N_4\:produced=0.0712\: mol\: Si\times \dfrac{1\:mol\:Si_3N_4}{3\: mol\: Si}=0.0237\: mol\:Si_3N_4} \nonumber \]
тоді як 0,0535 молів азоту вироблятиме
\[\mathrm{mol\:Si_3N_4\:produced=0.0535\: mol\:N_2\times \dfrac{1\: mol\:Si_3N_4}{2\: mol\:N_2}=0.0268\: mol\:Si_3N_4} \nonumber \]
Оскільки кремній дає меншу кількість продукту, він є граничним реагентом.
Який граничний реагент, коли 5,00 г Н 2 і 10,0 г O 2 реагують і утворюють воду?
- Відповідь
-
О 2
Відсоток прибутковості
Кількість продукту, яке може бути отримано реакцією в заданих умовах, розраховане за стехіометрією відповідного збалансованого хімічного рівняння, називається теоретичним виходом реакції. На практиці кількість отриманого продукту називається фактичним виходом, і воно часто менше теоретичного виходу з ряду причин. Деякі реакції за своєю суттю неефективні, супроводжуючись побічними реакціями, які генерують інші продукти. Інші за своєю природою неповні (розглянемо часткові реакції слабких кислот і підстав, розглянуті раніше в цьому тексті). Деякі продукти важко зібрати без деяких втрат, і тому менш досконале відновлення знизить фактичну врожайність. Ступінь, в якій досягається теоретичний вихід реакції, зазвичай виражається як її відсотковий вихід:
\[\mathrm{percent\: yield=\dfrac{actual\: yield}{theoretical\: yield}\times 100\%} \nonumber \]
Фактичний і теоретичний вихід може виражатися як маси або молярні суми (або будь-яке інше відповідне властивість; наприклад, обсяг, якщо продукт є газом). Поки обидві врожайності виражаються з використанням однакових одиниць, ці одиниці скасовуватимуться, коли обчислюється відсоткова прибутковість.
При реакції 1,274 г мідного купоросу з надлишком металу цинку отримано 0,392 г мідного металу за рівнянням:
\[\ce{CuSO4}(aq)+\ce{Zn}(s)\rightarrow \ce{Cu}(s)+\ce{ZnSO4}(aq) \nonumber \]
Що таке відсоткова прибутковість?
Рішення
Надана інформація ідентифікує мідний купорос як граничний реагент, і тому теоретичний вихід виявляється підходом, проілюстрованим у попередньому модулі, як показано тут:
\[\mathrm{1.274\:\cancel{g\:Cu_SO_4}\times \dfrac{1\:\cancel{mol\:CuSO_4}}{159.62\:\cancel{g\:CuSO_4}}\times \dfrac{1\:\cancel{mol\: Cu}}{1\:\cancel{mol\:CuSO_4}}\times \dfrac{63.55\:g\: Cu}{1\:\cancel{mol\: Cu}}=0.5072\: g\: Cu} \nonumber \]
Використовуючи цю теоретичну прибутковість і надане значення для фактичної прибутковості, відсоток прибутковості розраховується як
\[\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100} \nonumber \]
\ [\ почати {вирівнювати*}
\ математика {відсоток\: вихід} &=\ математика {\ лівий (\ dfrac {0.392\: g\: Cu} {0.5072\: g\: Cu}\ праворуч)\ раз 100}\
&=77.3\%
\ end {вирівнювати*}\ nonumber\]
Який відсоток виходу реакції, яка виробляє 12,5 г газу фреон CF 2 Cl 2 з 32,9 г cCl 4 і надлишок HF?
\[\ce{CCl4 + 2HF \rightarrow CF2Cl2 + 2HCl} \nonumber \]
- Відповідь
-
48,3%
Цілеспрямоване проектування хімічних продуктів і процесів, що мінімізують використання екологічно небезпечних речовин і утворення відходів, відомо як зелена хімія. Зелена хімія - це філософський підхід, який застосовується до багатьох областей науки і техніки, і її практика узагальнена керівними принципами, відомими як «Дванадцять принципів зеленої хімії». Один з 12 принципів спрямований саме на максимальну ефективність процесів синтезу хімічних продуктів. Атомна економія процесу є мірою цієї ефективності, визначеною як відсоток за масою кінцевого продукту синтезу щодо мас усіх використовуваних реагентів:
\[\mathrm{atom\: economy=\dfrac{mass\: of\: product}{mass\: of\: reactants}\times 100\%} \nonumber \]
Хоча визначення атомної економіки на перший погляд здається дуже схожим на визначення відсоткового виходу, майте на увазі, що ця властивість являє собою різницю в теоретичній ефективності різних хімічних процесів. З іншого боку, відсоток виходу даного хімічного процесу оцінює ефективність процесу, порівнюючи вихід фактично отриманого продукту з максимальним виходом, прогнозованим стехіометрією.
Синтез загальних безрецептурних знеболюючих препаратів, ібупрофену, красиво ілюструє успіх зеленого хімії підходу (рис.\(\PageIndex{3}\)). Вперше продавався на початку 1960-х, ібупрофен вироблявся з використанням шестиступінчастого синтезу, який вимагав 514 г реагентів для генерації кожного моля (206 г) ібупрофену, атомна економіка 40%. У 1990-х роках компанія BHC (нині корпорація BHC) розробила альтернативний процес, який вимагає всього трьох кроків і має атомну економіку ~ 80%, майже вдвічі більше, ніж початковий процес. Процес BHC генерує значно менше хімічних відходів; використовує менш небезпечні та переробні матеріали; і забезпечує значну економію коштів виробнику (а згодом і споживачеві). На знак визнання позитивного впливу процесу BHC на навколишнє середовище компанія отримала нагороду «Екологічні синтетичні шляхи» Агентства з охорони навколишнього середовища в 1997 році.

Резюме
Коли реакції проводяться з використанням менш стехіометричних кількостей реагентів, кількість виробленого продукту буде визначатися граничним реагентом. Кількість продукту, що утворюється в результаті хімічної реакції, є його фактичним виходом. Цей вихід часто менше кількості продукту, передбаченого стехіометрією збалансованого хімічного рівняння, що представляє реакцію (її теоретичний вихід). Ступінь, в якій реакція генерує теоретичну кількість продукту, виражається як його відсотковий вихід.
Ключові рівняння
- \(\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100}\)
Глосарій
- фактична прибутковість
- кількість продукту, що утворюється в реакції
- надлишок реагенту
- реагент присутній в кількості, більшій, ніж потрібно стехіометрії реакції
- обмежуючий реагент
- реагент присутній в кількості, меншій, ніж потрібно стехіометрії реакції, тим самим обмежуючи кількість виробленого продукту
- відсоток прибутковості
- міра ефективності реакції, виражена у відсотках від теоретичного виходу
- теоретична прибутковість
- кількість продукту, який може бути отриманий із заданої кількості реагенту (ів) відповідно до стехіометрії реакції
