4.3: Реакційна стехіометрія
- Page ID
- 22770
- Поясніть поняття стехіометрії, оскільки вона стосується хімічних реакцій
- Використовуйте збалансовані хімічні рівняння для отримання стехіометричних факторів, що стосуються кількості реагентів та продуктів
- Виконання стехіометричних розрахунків за участю маси, кротів та молярності розчину
Збалансоване хімічне рівняння забезпечує велику кількість інформації в дуже стислому форматі. Хімічні формули забезпечують ідентичність реагентів та продуктів, що беруть участь у хімічній зміні, дозволяючи класифікувати реакцію. Коефіцієнти забезпечують відносні числа цих хімічних видів, дозволяючи кількісну оцінку взаємозв'язків між кількостями спожитих і вироблених реакцією речовин. Ці кількісні співвідношення відомі як стехіометрія реакції, термін, похідний від грецьких слів stoicheion (означає «елемент») та метрон (що означає «міра»). У цьому модулі досліджено використання збалансованих хімічних рівнянь для різних стехіометричних застосувань.
Загальний підхід до використання стехіометричних відносин схожий за концепцією з тим, як люди займаються багатьма спільними видами діяльності. Кулінарія, наприклад, пропонує відповідне порівняння. Припустимо, рецепт приготування восьми млинців вимагає 1 склянки млинцевої суміші,\(\dfrac{3}{4}\) чашки молока та одного яйця. «Рівняння», що представляє приготування млинців за цим рецептом, є
\[\mathrm{1\:cup\: mix+\dfrac{3}{4}\:cup\: milk+1\: egg \rightarrow 8\: pancakes} \label{4.4.1} \]
Якщо для великого сімейного сніданку потрібні два десятка млинців, кількість інгредієнтів необхідно збільшити пропорційно відповідно до кількості, наведених в рецепті. Наприклад, кількість яєць, необхідних для приготування 24 млинців, становить
\[\mathrm{24\: \cancel{pancakes} \times \dfrac{1\: egg}{8\: \cancel{pancakes}}=3\: eggs} \label{4.4.2} \]
Збалансовані хімічні рівняння використовуються приблизно однаково для визначення кількості одного реагенту, необхідного для реакції з заданою кількістю іншого реагенту, або для отримання заданої кількості продукту тощо. Коефіцієнти в збалансованому рівнянні використовуються для отримання стехіометричних факторів, що дозволяють обчислити бажану величину. Щоб проілюструвати цю ідею, розглянемо отримання аміаку реакцією водню і азоту:
\[\ce{N2}(g)+\ce{3H2}(g)\rightarrow \ce{2NH3}(g) \label{4.4.3} \]
Це рівняння показує, що молекули аміаку виробляються з молекул водню в співвідношенні 2:3, а стехіометричні фактори можуть бути отримані з використанням будь-якої одиниці кількості (числа):
\[\ce{\dfrac{2NH3 \: molecules}{3H2 \: molecules}\: or \: \dfrac{2 \: doz \: NH3\: molecules}{3\: doz\:H2 \:molecules} \: or \: \dfrac{2\: mol\: NH3\: molecules}{3\: mol\: H2\: molecules}} \label{4.4.4} \]
Ці стехіометричні фактори можуть бути використані для обчислення кількості молекул аміаку, вироблених із заданої кількості молекул водню, або кількості молекул водню, необхідних для отримання заданої кількості молекул аміаку. Подібні фактори можуть бути виведені для будь-якої пари речовин в будь-якому хімічному рівнянні.
Скільки родимок I 2 потрібно для реакції з 0,429 моль Al відповідно до наступного рівняння (див. Рис.\(\PageIndex{2}\))?
\[\ce{2Al + 3I2 \rightarrow 2AlI3} \label{4.4.5} \]

Рішення
Посилаючись на збалансоване хімічне рівняння, стехіометричний коефіцієнт, що стосується двох речовин, що цікавлять, є\(\ce{\dfrac{3\: mol\: I2}{2\: mol\: Al}}\). Молярна кількість йоду отримують шляхом множення наданого молярного кількості алюмінію на цей коефіцієнт:

\[\begin{align*} \mathrm{mol\: I_2} &=\mathrm{0.429\: \cancel{mol\: Al}\times \dfrac{3\: mol\: I_2}{2\:\cancel{mol\: Al}}} \\[4pt] &=\mathrm{0.644\: mol\: I_2} \end{align*} \nonumber \]
Скільки молів Ca (OH) 2 потрібно реагувати з 1,36 моль H 3 PO 4 для отримання Ca 3 (PO 4) 2 відповідно до рівняння\(\ce{3Ca(OH)2 + 2H3PO4 \rightarrow Ca3(PO4)2 + 6H2O}\)?
- Відповідь
-
2,04 моль
Скільки молекул вуглекислого газу утворюється при згорянні 0,75 моль пропану згідно з цим рівнянням?
\[\ce{C3H8 + 5O2 \rightarrow 3CO2 + 4H2O} \label{4.4.6} \]
S рішення
Підхід тут такий же, як наприклад\(\PageIndex{1}\), хоча запитується абсолютна кількість молекул, а не кількість молей молекул. Це просто зажадає використання коефіцієнта перетворення молів до чисел, числа Авогадро.
Збалансоване рівняння показує, що вуглекислий газ виробляється з пропану в співвідношенні 3:1:
\[\ce{\dfrac{3\: mol\: CO2}{1\: mol\: C3H8}} \label{4.4.7} \]
Використовуючи цей стехіометричний фактор, надана молярна кількість пропану та число Авогадро,

\[\mathrm{0.75\: \cancel{mol\: C_3H_8}\times \dfrac{3\: \cancel{mol\: CO_2}}{1\:\cancel{mol\:C_3H_8}}\times \dfrac{6.022\times 10^{23}\:CO_2\:molecules}{\cancel{mol\:CO_2}}=1.4\times 10^{24}\:CO_2\:molecules} \label{4.4.8} \]
Скільки молекул NH 3 виробляється реакцією 4,0 моль Ca (OH) 2 за наступним рівнянням:
\[\ce{(NH4)2SO4 + Ca(OH)2 \rightarrow 2NH3 + CaSO4 + 2H2O} \label{4.4.9} \]
- Відповідь
-
4,8 × 10 24 молекули NH 3
Ці приклади ілюструють легкість, з якою можуть бути пов'язані кількості речовин, що беруть участь у хімічній реакції відомої стехіометрії. Безпосередньо вимірювання чисел атомів і молекул - це, однак, непросте завдання, і практичне застосування стехіометрії вимагає, щоб ми використовували більш легко виміряну властивість маси.
Яка маса гідроксиду натрію, NaOH, знадобиться для отримання 16 г антацидного молока магнезії [гідроксид магнію, Mg (OH) 2] наступною реакцією?
S рішення
Підхід, який раніше використовувався в Прикладах,\(\PageIndex{1}\) і також\(\PageIndex{2}\) використовується тут; тобто ми повинні вивести відповідний стехіометричний фактор із збалансованого хімічного рівняння і використовувати його для зв'язку кількостей двох речовин, що цікавлять. У цьому випадку, однак, маси (не молярні суми) надаються та запитуються, тому необхідні додаткові кроки сортування, вивчені в попередньому розділі. Необхідні розрахунки викладені в цій блок-схемі:
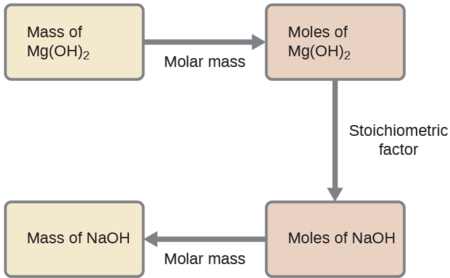
\[\mathrm{16\:\cancel{g\: Mg(OH)_2} \times \dfrac{1\:\cancel{mol\: Mg(OH)_2}}{58.3\:\cancel{g\: Mg(OH)_2}}\times \dfrac{2\:\cancel{mol\: NaOH}}{1\:\cancel{mol\: Mg(OH)_2}}\times \dfrac{40.0\: g\: NaOH}{\cancel{mol\: NaOH}}=22\: g\: NaOH} \nonumber \]
Яку масу оксиду галію, Ga 2 O 3, можна приготувати з 29,0 г металу галію? Рівняння для реакції є\(\ce{4Ga + 3O2 \rightarrow 2Ga2O3}\).
- Відповідь
-
39,0 г
Яка маса газу кисню, О 2, з повітря витрачається при згорянні 702 г октану, С 8 Н 18, одного з головних компонентів бензину?
\[\ce{2C8H18 + 25O2 \rightarrow 16CO2 + 18H2O} \nonumber \]
S рішення
Підхід, необхідний тут, такий же, як і для Прикладу\(\PageIndex{3}\), відрізняється лише тим, що надані та запитувані маси є як для реагентів.
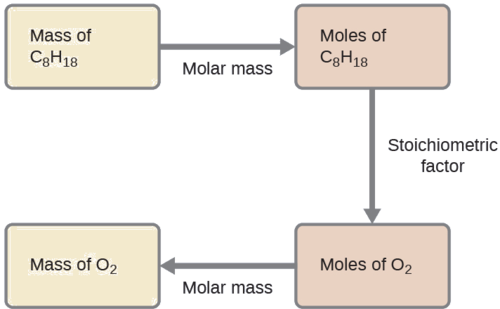
\(\mathrm{702\:\cancel{g\:\ce{C8H18}}\times \dfrac{1\:\cancel{mol\:\ce{C8H18}}}{114.23\:\cancel{g\:\ce{C8H18}}}\times \dfrac{25\:\cancel{mol\:\ce{O2}}}{2\:\cancel{mol\:\ce{C8H18}}}\times \dfrac{32.00\: g\:\ce{O2}}{\cancel{mol\:\ce{O2}}}=2.46\times 10^3\:g\:\ce{O2}}\)
Яка маса СО потрібна для реакції з 25,13 г Fe 2 O 3 згідно з рівнянням\(\ce{Fe2O3 + 3CO \rightarrow 2Fe + 3CO2}\)?
- Відповідь
-
13,22 г
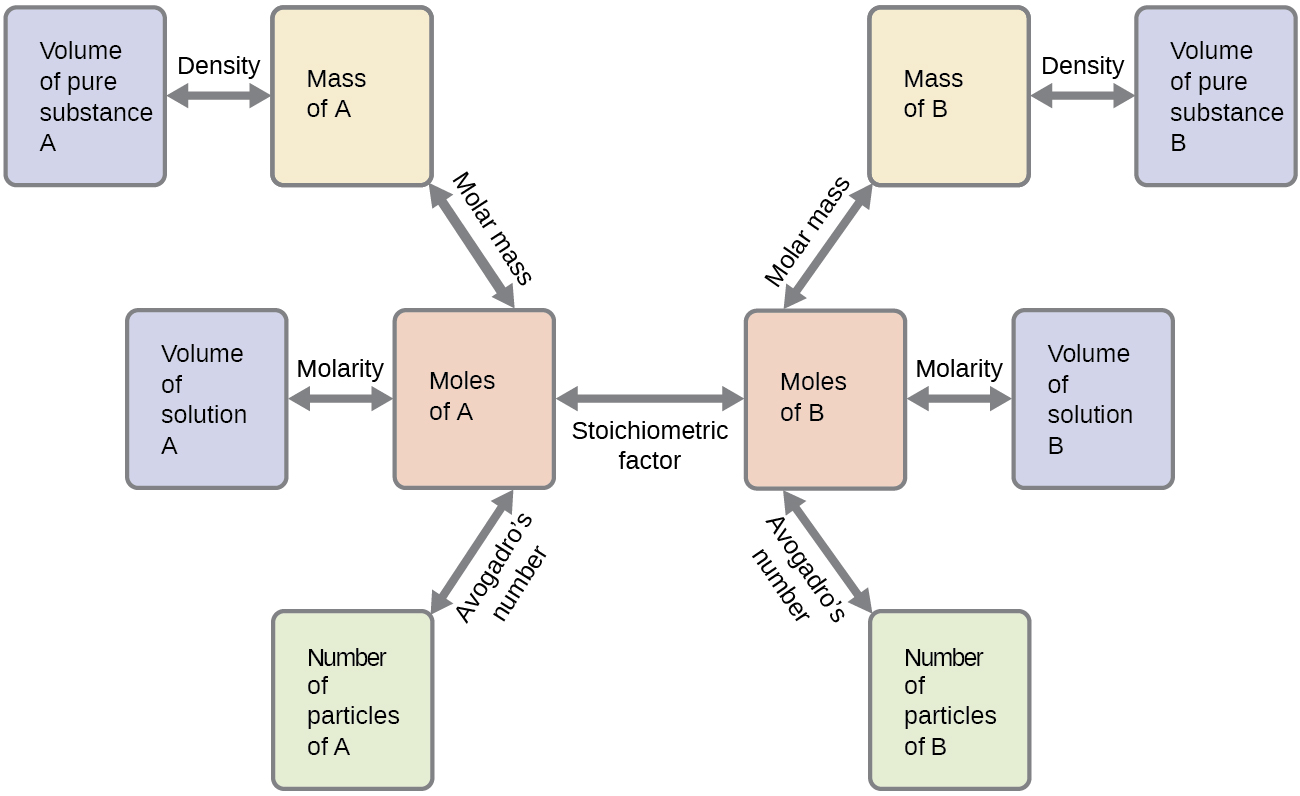
Ці приклади ілюструють лише кілька прикладів розрахунків стехіометрії реакції. Можливі численні варіації початкового та кінцевого обчислювальних кроків залежно від того, які конкретні величини надаються та шукаються (обсяги, концентрації розчину тощо). Незалежно від деталей, всі ці розрахунки мають спільну істотну складову: використання стехіометричних факторів, отриманих від збалансованих хімічних рівнянь. На малюнку\(\PageIndex{2}\) представлена загальна схема різних обчислювальних кроків, пов'язаних з багатьма розрахунками стехіометрії реакції.
Подушки безпеки (рис.\(\PageIndex{3}\)) - це функція безпеки, що надається в більшості автомобілів з 1990-х років. Ефективна робота подушки безпеки вимагає, щоб вона була швидко надута відповідною кількістю (об'ємом) газу, коли транспортний засіб бере участь у зіткненні. Ця вимога задовольняється в багатьох системах автомобільних подушок безпеки за рахунок використання вибухонебезпечних хімічних реакцій, одним загальним вибором є розкладання азиду натрію, NaN 3. Коли датчики в транспортному засобі виявляють зіткнення, електричний струм пропускається через ретельно виміряну кількість NaN 3, щоб ініціювати його розкладання:
\[\ce{2NaN3}(s)\rightarrow \ce{3N2}(g)+\ce{2Na}(s) \nonumber \]
Ця реакція дуже швидка, утворюючи газоподібний азот, який може розгорнути та повністю надути типову подушку безпеки за частку секунди (~ 0,03-0,1 с). Серед багатьох інженерних міркувань кількість використовуваного азиду натрію повинна бути відповідною для отримання достатньої кількості азотного газу, щоб повністю надути повітряну подушку та забезпечити її належну функцію. Наприклад, невелика маса (~100 г) NaN 3 буде генерувати приблизно 50 л N 2.

Резюме
Збалансоване хімічне рівняння може бути використано для опису стехіометрії реакції (співвідношення між кількістю реагентів та продуктів). Коефіцієнти з рівняння використовуються для отримання стехіометричних факторів, які згодом можуть бути використані для обчислень, що стосуються маси реагентів і продуктів, молярних кількостей та інших кількісних властивостей.
Глосарій
- стехіометричний коефіцієнт
- співвідношення коефіцієнтів в збалансованому хімічному рівнянні, що використовується при розрахунках, що стосуються кількості реагентів і продуктів
- стехіометрія
- співвідношення між кількістю реагентів і продуктів хімічної реакції
