4.5: Кількісний хімічний аналіз
- Page ID
- 22769
- Охарактеризуйте фундаментальні аспекти титрування та гравіметричного аналізу.
- Виконуйте стехіометричні розрахунки, використовуючи типові титрування і гравіметричні дані.
У 18 столітті міцність (власне концентрацію) зразків оцту визначали, відзначивши кількість карбонату калію, К 2 СО 3, який довелося додавати, потроху за раз, перш ніж барботування припинилося. Чим більша вага карбонату калію доданий для досягнення точки, де закінчилося барботування, тим більше концентрований оцет.
Тепер ми знаємо, що шипучість, яка сталася під час цього процесу, була обумовлена реакцією з оцтовою кислотою, СН 3 СО 2 Н, сполукою, яка в першу чергу відповідає за запах і смак оцту. Оцтова кислота вступає в реакцію з карбонатом калію за наступним рівнянням:
\[\ce{2CH3CO2H}(aq)+\ce{K2CO3}(s)\rightarrow 2 \ce{KCH3CO3}(aq)+\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Барботаж відбувся завдяки виробництву СО 2.
Тест оцту з карбонатом калію є одним з видів кількісного аналізу - визначення кількості або концентрації речовини в зразку. При аналізі оцту концентрацію розчиненої речовини (оцтової кислоти) визначали з кількості реагенту, який з'єднався з розчиненою речовиною, присутньою в відомому обсязі розчину. В інших видах хімічних аналізів кількість речовини, присутньої у зразку, визначається шляхом вимірювання кількості продукту, що виходить.
Титрування
Описаний підхід до вимірювання сили оцту був ранньою версією аналітичного методу, відомого як аналіз титрування. Типовий титрувальний аналіз передбачає використання бюрета (рис.\(\PageIndex{1}\)), щоб зробити додаткові додавання розчину, що містить відому концентрацію деякої речовини (титранта), до зразкового розчину, що містить речовину, концентрація якої повинна бути виміряна ( аналіт). Титрант і аналіт проходять хімічну реакцію відомої стехіометрії, і тому вимірювання обсягу розчину титранту, необхідного для повної реакції з аналітом (точка еквівалентності титрування), дозволяє розрахувати концентрацію аналіту. Точка еквівалентності титрування може бути виявлена візуально, якщо чітке зміна зовнішнього вигляду розчину зразка супроводжує завершення реакції. Припинення утворення бульбашок в класичному аналізі оцту є одним з таких прикладів, хоча, частіше, спеціальні барвники, які називаються індикаторами, додаються до розчинів зразків для додання зміни кольору в точці еквівалентності титрування або дуже близько неї. Точки еквівалентності також можуть бути виявлені шляхом вимірювання деякої властивості розчину, яка змінюється передбачуваним чином під час титрування. Незалежно від підходу до виявлення точки еквівалентності титрування, фактично виміряний обсяг титранту називається кінцевою точкою. Правильно розроблені методи титрування зазвичай гарантують, що різниця між еквівалентністю та кінцевими точками незначна. Хоча будь-який тип хімічної реакції може служити основою для аналізу титрування, три описані в цьому розділі (опади, кислотно-лужні та окислювально-відновні) є найбільш поширеними. Додаткові відомості щодо титрувального аналізу наведені в розділі про кислотно-лужні рівноваги.

Кінцева точка при титруванні 50,00-мл зразка водного HCl була досягнута додаванням 35,23 мл 0,250 М титранту NaOH. Реакція титрування буває:
\[\ce{HCl}(aq)+\ce{NaOH}(aq)\rightarrow \ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
Що таке молярність HCl?
Рішення
Що стосується всіх розрахунків стехіометрії реакції, то ключовим питанням є зв'язок між молярними кількостями цікавить хімічних видів, зображених у збалансованому хімічному рівнянні. Підхід, викладений у попередніх модулів цієї глави, дотримується з додатковими міркуваннями, оскільки кількість реагентів, що надаються та запитуються, виражаються як концентрації розчину.
Для цієї вправи розрахунок буде слідувати наступним окресленим крокам:
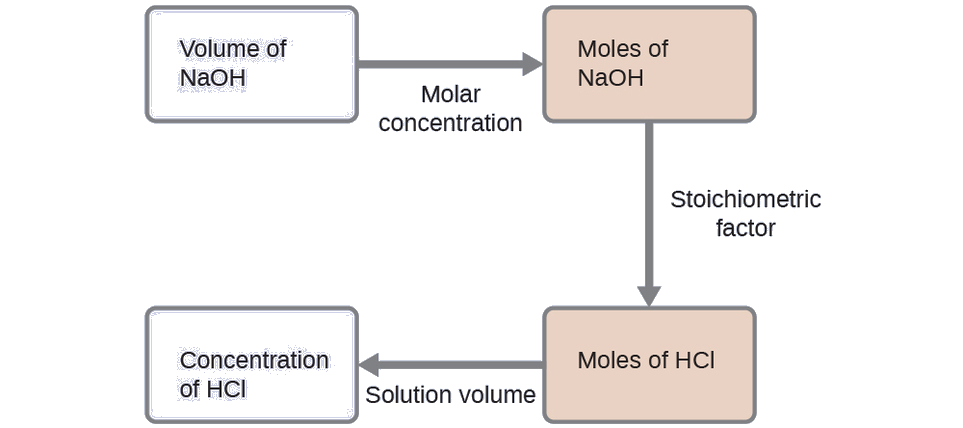
Молярна кількість HCl розраховується таким чином:
\[\mathrm{35.23\:\cancel{mL\: NaOH}\times \dfrac{1\:\cancel{L}}{1000\:\cancel{mL}}\times \dfrac{0.250\:\cancel{mol\: NaOH}}{1\:\cancel{L}}\times \dfrac{1\: mol\: HCl}{1\:\cancel{mol\: NaOH}}=8.81\times 10^{-3}\:mol\: HCl} \nonumber \]
Використовуючи наданий обсяг розчину HCl і визначення молярності, концентрація HCl становить:
\ [\ почати {вирівнювати*} M
& =\ mathrm {\ dfrac {моль\: HCl} {L\: розчин}}\\ M
& =\ mathrm {\ dfrac {8.81\ раз 10^ {-3}\ :моль\: HCl} {50.00\: мл\ час\ dfrac {1\: L} {1000\ мл}}\ M
& = 0.176\ :M
\ кінець {вирівнювати*}\ nonumber\]
Примітка: Для цих типів обчислень титрування зручно визнати, що молярність розчину також дорівнює кількості молів розчиненої речовини на мілілітр розчину:
\[M=\mathrm{\dfrac{mol\: solute}{L\: solution}\times \dfrac{\dfrac{10^3\:mmol}{mol}}{\dfrac{10^3\:mL}{L}}=\dfrac{mmol\: solute}{mL\: solution}} \nonumber \]
Використання даного варіанту одиниці молярності дозволить скоротити розрахунок за рахунок виключення двох коефіцієнтів перетворення:
\[\mathrm{\dfrac{35.23\:mL\: NaOH\times \dfrac{0.250\:mmol\: NaOH}{mL\: NaOH}\times \dfrac{1\:mmol\: HCl}{1\:mmol\: NaOH}}{50.00\:mL\: solution}=0.176\: \mathit M\: HCl} \nonumber \]
20,00-мл проби водної щавлевої кислоти H 2 C 2 O 4 титрували 0,09113- М розчином марганцівки, KMnO 4.
\[\ce{2MnO4-}(aq)+\ce{5H2C2O4}(aq)+\ce{6H+}(aq)\rightarrow \ce{10CO2}(g)+\ce{2Mn^2+}(aq)+\ce{8H2O}(l) \nonumber \]
Обсяг 23,24 мл знадобився для досягнення кінцевої точки. Що таке молярність щавлевої кислоти?
- Відповідь
-
0.2648 М
Гравіметричний аналіз
Гравіметричний аналіз - це той, при якому зразок піддається деякій обробці, яка викликає зміну фізичного стану аналіту, що дозволяє його відокремити від інших компонентів зразка. Масові вимірювання зразка, ізольованого аналіту або якогось іншого компонента системи аналізу, що використовується разом із відомою стехіометрією задіяних сполук, дозволяють розраховувати концентрацію аналіту. Гравіметричні методи були першими методами, використовуваними для кількісного хімічного аналізу, і вони залишаються важливими інструментами в сучасній хімічній лабораторії.
Необхідна зміна стану при гравіметричному аналізі може бути досягнуто різними фізико-хімічними процесами. Наприклад, вміст вологи (води) зразка зазвичай визначається шляхом вимірювання маси зразка до і після того, як він піддається контрольованому процесу нагрівання, що випаровує воду. Також поширені гравіметричні методи, в яких аналіт піддається реакції опадів такого роду, як описано раніше в цьому розділі. Осад зазвичай виділяють з реакційної суміші шляхом фільтрації, ретельно висушують, а потім зважують (рис.\(\PageIndex{2}\)). Потім маса осаду може бути використана разом із відповідними стехіометричними співвідношеннями для розрахунку концентрації аналіту.

0,4550 г твердої суміші, що містить MgSO 4, розчиняють у воді і обробляють надлишком Ba (NO 3) 2, в результаті чого випадає 0,6168 г BasO 4.
\[\ce{MgSO4}(aq)+\ce{Ba(NO3)2}(aq)\rightarrow \ce{BaSO4}(s)+\ce{Mg(NO3)2}(aq) \nonumber \]
Яка концентрація (відсоток) MgSO 4 в суміші?
Рішення
План цього розрахунку аналогічний іншим, використовуваним в стехіометричних розрахунках, центральним кроком є зв'язок між молями BasO 4 і MgSO 4 через їх стехіометричний коефіцієнт. Після обчислення маси MgSO 4 вона може бути використана разом з масою зразкової суміші для розрахунку запитуваної процентної концентрації.
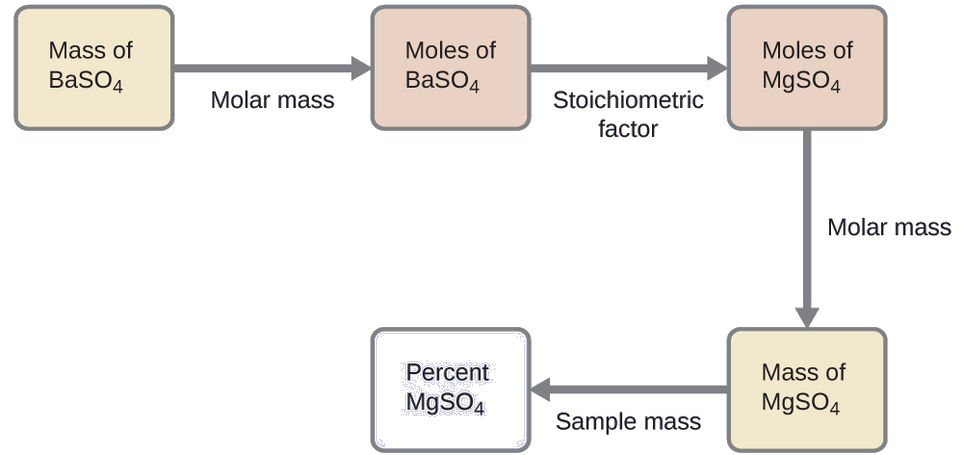
Маса MgSO 4, яка б вийшла надана маса осаду, становить
\[\mathrm{0.6168\:\cancel{g\: BaSO_4}\times \dfrac{1\:\cancel{mol\: BaSO_4}}{233.43\:\cancel{g\: BaSO_4}}\times \dfrac{1\:\cancel{mol\: MgSO_4}}{1\:\cancel{mol\: BaSO_4}}\times \dfrac{120.37\:g\: MgSO_4}{1\:\cancel{mol\: MgSO_4}}=0.3181\:g\: MgSO_4} \nonumber \]
Концентрація MgSO 4 в суміші зразка потім розраховується, щоб бути
\ [\ почати {вирівнювати*}
\ ce {відсоток\: MgSO4} &=\ ce {\ dfrac {маса\: MgSO4} {маса\: зразок}}\ times100\%
\\ mathrm {\ dfrac {0.3181\: g} {0.4550\: g}\ times100\ %&= 69.91
\%\ кінець {align*}\ номер\]
Який відсоток іона хлориду в зразку, якщо 1,1324 г зразка утворює 1,0881 г AgCl при обробці надлишком Ag +?
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
- Відповідь
-
23,76%
Аналіз горіння
Елементний склад вуглеводнів і споріднених сполук може бути визначений за допомогою гравіметричного методу, відомого як аналіз горіння. При аналізі горіння зважений зразок сполуки нагрівається до високої температури під струменем газу кисню, в результаті чого його повне згоряння з отриманням газоподібних продуктів відомих ідентичностей. При повному згорянні вуглеводнів, наприклад, вийде вуглекислий газ і вода в якості єдиних продуктів. Газоподібні продукти згоряння змітаються через окремі, попередньо зважені збірні пристрої, що містять сполуки, які вибірково поглинають кожен продукт (рис.\(\PageIndex{3}\)). Збільшення маси кожного пристрою відповідає масі поглиненого продукту і може бути використано у відповідному стехіометричному розрахунку для отримання маси відповідного елемента.
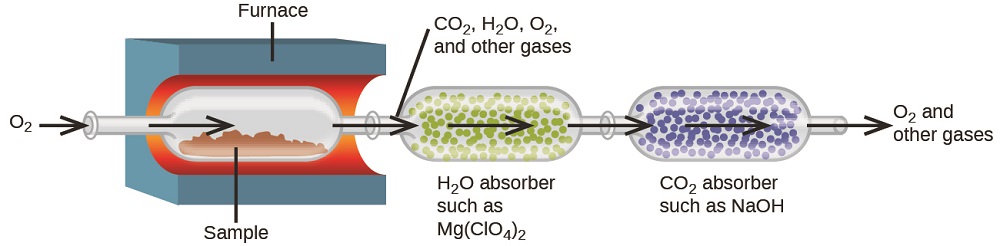
Поліетилен - це вуглеводневий полімер, який використовується для виробництва мішків для зберігання продуктів харчування та багатьох інших гнучких пластикових виробів. Аналіз горіння 0,00126-г проби поліетилену дає 0,00394 г СО 2 і 0,00161 г Н 2 О. Яка емпірична формула поліетилену?
Рішення
Первинне припущення в цій вправі полягає в тому, що весь вуглець у згорілому зразку перетворюється на вуглекислий газ, а весь водень у зразку перетворюється в воду:
\[\mathrm{C_xH_y}(s)+\ce{excess\: O2}(g)\rightarrow x\ce{CO2}(g)+ \dfrac{y}{2} \ce{H2O}(g) \nonumber \]
Зверніть увагу, що збалансоване рівняння не є необхідним для поставленого завдання. Щоб вивести емпіричну формулу сполуки, потрібні лише індекси x і y.
Спочатку розрахуйте молярні кількості вуглецю і водню в зразку, використовуючи надані маси вуглекислого газу і води відповідно. При цих молярних кількостях емпірична формула сполуки може бути написана так, як описано в попередньому розділі цього тексту. Контур цього підходу наведено в наступній блок-схемі:
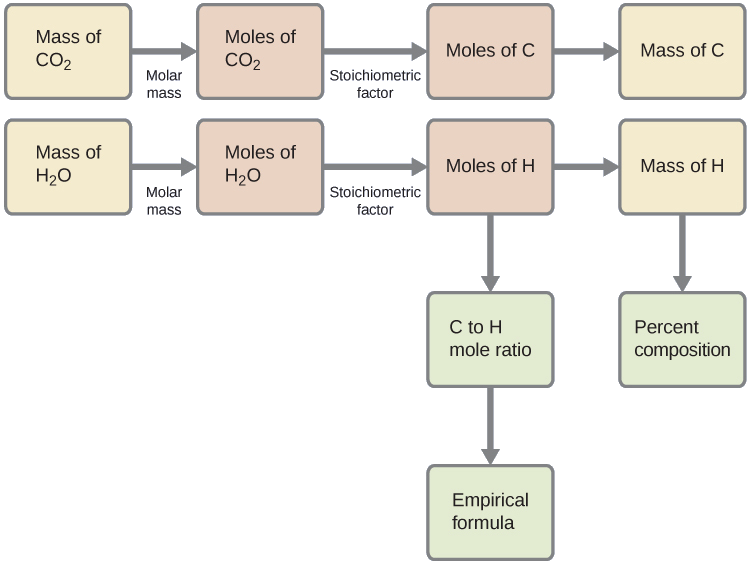
\[\mathrm{mol\: C=0.00394\:g\: CO_2\times\dfrac{1\:mol\: CO_2}{44.01\: g/mol}\times\dfrac{1\:mol\: C}{1\:mol\: CO_2}=8.95\times10^{-5}\:mol\: C} \nonumber \]
\[\mathrm{mol\: H=0.00161\:g\: H_2O\times\dfrac{1\:mol\: H_2O}{18.02\:g/mol}\times\dfrac{2\:mol\: H}{1\:mol\: H_2O}=1.79\times10^{-4}\:mol\: H} \nonumber \]
Емпірична формула для сполуки потім виводиться шляхом ідентифікації найменших цілих чисел кратних для цих молярних кількостей. Молярне співвідношення H до C становить
\[\mathrm{\dfrac{mol\: H}{mol\: C}=\dfrac{1.79\times10^{-4}\:mol\: H}{8.95\times10^{-5}\:mol\: C}=\dfrac{2\:mol\: H}{1\:mol\: C}} \nonumber \]
а емпірична формула для поліетилену - СН 2.
Зразок полістиролу 0,00215 г, полімеру, що складається з вуглецю та водню, отримав 0,00726 г CO 2 та 0,00148 г H 2 O в аналізі горіння. Яка емпірична формула полістиролу?
- Відповідь
-
Ч
Резюме
Стехіометрія хімічних реакцій може служити основою для кількісних методів хімічного аналізу. Титрування передбачають вимірювання обсягу розчину титранту, необхідного для повної реакції з розчином зразка. Цей обсяг потім використовується для розрахунку концентрації аналіту в зразку за допомогою стехіометрії реакції титрування. Гравіметричний аналіз передбачає відділення аналіту від зразка фізичним або хімічним процесом, визначення його маси, а потім розрахунок його концентрації в зразку на основі стехіометрії відповідного процесу. Аналіз горіння - це гравіметричний метод, який використовується для визначення елементного складу сполуки шляхом збору і зважування газоподібних продуктів його згоряння.
Глосарій
- аналіт
- хімічні види, що представляють інтерес
- бюрет
- пристрій, що використовується для точної доставки змінних обсягів рідини, наприклад, при титруванні аналізу
- аналіз горіння
- гравіметричний метод, що застосовується для визначення елементного складу сполуки шляхом збору та зважування його газоподібних продуктів згоряння
- кінцева точка
- виміряний об'єм розчину титранту, який дає зміну вигляду розчину зразка або іншої властивості, очікуваної для стехіометричної еквівалентності (див. Точку еквівалентності)
- точка еквівалентності
- обсяг розчину титранту, необхідний для повної реакції з аналітом в титрувальному аналізі; забезпечує стехіометричну кількість титранту для аналіту зразка відповідно до реакції титрування
- гравіметричний аналіз
- кількісний метод хімічного аналізу, що включає відділення аналіту від зразка фізичним або хімічним процесом та подальші вимірювання маси аналіту, продукту реакції та/або зразка
- показник
- речовина, додана до зразка в титрувальному аналізі, щоб дозволити візуальне виявлення кінцевої точки
- кількісний аналіз
- визначення кількості або концентрації речовини в зразку
- титрант
- розчин, що містить відому концентрацію речовини, яка буде реагувати з аналітом в титруючому аналізі
- аналіз титрування
- кількісний метод хімічного аналізу, який передбачає вимірювання обсягу розчину реагенту, необхідного для повної реакції з аналітом у зразку
